Cichlidae
La famille des Cichlidés appartient à l'ordre des Cichliformes. Cette famille comporte plus de 200 genres et entre 1 600[1] et 1 800 espèces, réparties principalement en Afrique, en Amérique centrale, Amérique du Sud, Texas (une espèce), Israël, Madagascar, Syrie, Iran, Sri Lanka et sur les côtes sud des Indes. Le lac Malawi abrite à lui seul près d'un milier d'espèces. De nombreuses espèces sont importées et parfois élevées en Europe à des fins aquariophiles, en raison de leurs couleurs vives et de leurs mœurs parfois évoluées. On compte parmi ses membres les plus célèbres le scalaire, l'oscar ou encore le discus. La disparition massive des 200 espèces différentes de Cichlidés du lac Victoria, espèces qui se sont diversifiées depuis 12 000 ans, est une illustration des menaces qui pèsent sur la biodiversité.

Sous-familles de rang inférieur
Répartition géographique
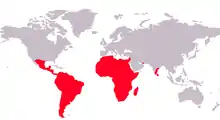
Il existe chez les poissons une grande diversité phénotypique et variabilité en ce qui concerne les patrons de développement. Les recherches se sont principalement tournées vers le modèle du poisson zèbre, pour lequel on possède de nombreuses données génétiques et développementales. Cependant il semblerait que les études ne se cantonnent plus exclusivement aux modèles de base : « En raison de leur diversité phénotypique extrême […], de leur caractérisation écologique et de leur grand nombre de génomes séquencés, [les cichlidés] constituent un modèle émergent susceptible de fournir des informations sur l'évolution du polymorphisme de pigmentation dans la nature[2]. »
Caractéristiques
Caractéristiques physiques
- Nageoires dorsale et anale constituées de rayons épineux dans la partie antérieure et mous dans la partie postérieure.
- Nageoires pelviennes dotées de quelques rayons épineux durs et pointus.
- Absence de dents sur le palais mais présence de dents pharyngiennes et dents maxillaires.
- Une seule paire de narines (contre deux pour la plupart des poissons).
- Ligne latérale interrompue chez la plupart des espèces, en deux et parfois trois segments.
Dimorphisme sexuel
On observe, chez certaines espèces de Cichlidés, un dimorphisme sexuel basé sur la couleur de la peau. Cela joue un rôle dans la sélection sexuelle : les mâles possèdent généralement des couleurs vives (principalement pour attirer les femelles) tandis que chez les femelles les couleurs sont plus discrètes, permettant un camouflage plus efficace[2]. Chez certaines espèces, plus le mâle est dominant plus sa peau deviendra bleue ce qui entraîne une atténuation de ses motifs foncés (taches et lignes médianes).
Comportement
Le comportement évolué des Cichlidés fascine les aquariophiles. Mis à part la faculté d'apprentissage qu'ils montrent en captivité (notamment chez l'oscar, souvent considéré comme l'équivalent aquatique du chien), on peut citer leur mode de reproduction : quand les œufs ne bénéficient pas d'une incubation buccale, maternelle, paternelle ou biparentale, ils sont jalousement surveillés par les parents, qui n'hésitent pas à veiller sur leur progéniture longtemps après l'éclosion, en offrant, pour certaines espèces, leur bouche comme protection et moyen de locomotion aux alevins.
Certains cichilidés sont monogames fidèles, l'attachement affectif ayant été constatées par un stress scientifiquement avéré consécutivement à la séparation du partenaire[3].
Pigmentation : un nouveau modèle en biologie du développement
Chez les téléostéens, la pigmentation de la peau est le principal acteur du camouflage, influence le choix de partenaire sexuel et joue un rôle dans la communication entre les individus d’une même espèce ou entre différentes espèces[2] - [4] - [5]. Elle peut prendre des couleurs et des formes très variées selon de nombreux facteurs biotiques et abiotiques. Même si les motifs sont uniques pour chaque individu, des patrons spécifiques régissent leur mise en place ce qui en fait un sujet de recherche central et un excellent indicateur de l’évolution[4].
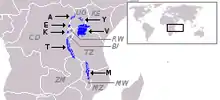
De nombreuses populations de cichlidés vivent dans les eaux des lacs Malawi, Victoria et Tanganyika en Afrique de l’Est et ce depuis plusieurs millions d’années. « On pense que plus de 500 espèces sont apparues dans le lac Malawi au cours des 2 derniers millions d’années » ce qui fait de ce lac un bon modèle d’étude des patrons de pigmentation menée en partie par la sélection sexuelle[4].
Analyse cellulaire
L’étude du modèle du poisson zèbre a montré que le développement des motifs comme des barres, des lignes ou des taches est régi par des interactions cellulaires entre différents types de chromatophores. Ce processus est retrouvable chez les Cichlidés : c’est la combinaison de différents types de chromatophores ou de leur disposition spatiale les uns par rapport aux autres qui est à l’origine de la diversité des couleurs et des patrons. Durant l’embryogénèse les futurs chromatophores issus des crètes neurales migrent depuis le tube neural dans tout le corps pour se placer à la surface de la peau[5].
Une étude a été réalisée sur les espèces Copadichromis azureus et Dimidiochromis compressiceps, deux espèces endémiques de la région des Rifts, afin de comprendre les différences dans les mises en place des motifs. La superposition des cellules pigmentaires rend compliquée l’analyse de leur disposition les unes par rapport aux autres. Les chercheurs ont donc procédé, pour chacune des deux espèces étudiées, à un traitement à la L-adrenaline pour concentrer les pigments de même nature entre eux en plusieurs petites tâches ce qui facilite leur étude. Trois types de cellules pigmentaires ont été identifiées chez les cichlidés du lac Malawi : des mélanophores (brun foncé/noir, contiennent de la mélanine), des xantophores (jaune/orange, contiennent des dérivés de caroténoïdes) et des iridophores (argenté/bleu, contiennent des cristaux de guanine)[4]. Les cellules se superposent de la sorte, du plus interne à la surface : xantophore, mélanophore, iridiophore. Le développement du motif adulte commence au cours du développement larvaire et définit le début de la métamorphose[5].
_et_Dimidiochromis_compressiceps_(au_dessous).jpg.webp)
Comparaison de la mise en place de la pigmentation des adultes chez C. azureus et D. compressiceps
Pour C. azureus la pigmentation est faite de la superposition de deux patrons trouvés chez d’autres Cichlidés de la vallée du Grands Rift. Elle est caractérisée par une alternance de bandes verticales et par des taches sombres sur le flanc (figure 1). Ces motifs sont valables chez tous les individus de l’espèce cependant la peau est bleu azur chez le mâle (les taches sombres sont atténuées par le bleu) tandis que les juvéniles et les femelles ont une couleur grise et des taches marquées. Chez C. azureus les mélanophores sont 23% plus abondants dans les barres que dans les interbarres et ces cellules sont de plus grande taille dans les barres que dans les interbarres. On trouve les xantophores de même abondance que les mélanophores dans les taches et dans les barres (voir figure 2). Il y a 9 barres et 8 interbarres chez le juvénile mais ces nombres sont amenés à augmenter avec l’âge et la taille. Chez cette espèce les motifs deviennent visibles progressivement au cours de la métamorphose, dans une période de 3 à 6 semaines après la fécondation[5].
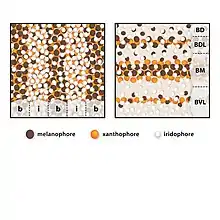
Le patron de pigmentation de D. compressiceps est lui aussi trouvé chez de nombreux poissons des lacs Malawi, Victoria et Tanganyika. Il est formé de bandes horizontales intercalées par des interbandes argentées (voir figure 1). Comme chez C. azureus les chromatophores qui régissent la pigmentation de D. compressiceps sont des mélanophores, les xantophores et les iridiophores. Plus la densité de mélanophores est élevée dans une ligne plus celle-ci sera foncée. Ainsi, la bande médiane (BM) a la plus forte densité de mélanophores, les bandes dorsale (BD) et dorso-latérale (BDL) ont une densité intermédiaire et la bande ventro-latérale (BVL) a une faible densité de mélanophores. Les interbarres ventrales sont uniquement composées d’iridiophores et les interbarres les plus dorsales contiennent aussi des mélanophores (voir figure 2). Contrairement à C. azureus, le pattern est fixé dès la métamorphose chez D. compressiceps[5].
Analyse génétique
L’hybridation est possible entre de nombreuses espèces de Cichlidés du lac Malawi. De ce fait, les chercheurs tentent de comprendre quels sont les mécanismes moléculaires sous-jacents à la mise en place des motifs pigmentaires de cette espèce[4]. Ces études sont principalement basées sur l’analyse génétique et la comparaison des génomes de deux espèces proches via l’analyse du polymorphisme nucléotidique (SNP) ou des locus de caractère quantitatifs (QTL) par séquençage des sites de restriction (via la méthode RAD-Seq)[4]. De nombreux gènes que l’on suppose acteurs de la mise en place des motifs de pigmentation ont été identifiés via ces méthodes.
Le gène pax7a est un exemple de remodelage du patron de développement chez les cichlidés : Le phénotype tacheté, largement retrouvé chez les individus femelles, est associé à un SNP non codant en amont du facteur de transcription pax7a. L’analyse des génomes hybrides a démontré l’existence de 3 allèles du gène pax7a, responsables d’une expression plus ou moins importante de la protéine associée. L’étude montre que la modification de la composition des cellules pigmentaires, et donc des taches, est corrélée avec ce gène[2].
Difficultés d'analyse du modèle
L'étude des modèles comme celui du Cichlidé est complexe car il met en jeu la micro et macro évolution, la sélection naturelle et sexuelle et la dynamique des populations. Il est donc nécessaire de comprendre la dynamique des mutations et leur impact sur la mise en place des patrons de développement[2].
Classification
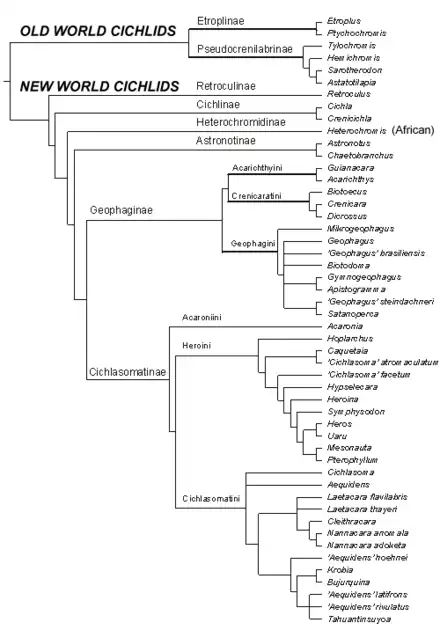
- Etroplinae : deux genres en Inde et à Madagascar
- Ptychochrominae : quatre genres à Madagascar
- Paratilapiinae (ou tribu de Ptychochrominae) : un genre à Madagascar
- Heterochromidinae : bassin du Congo
- Tylochrominae Poll, 1986 (ou tribu de Pseudocrenilabrinae) : cinq genres en Afrique
- Tylochromini Poll, 1986
- Trematocarini Poll, 1986
- Boulengerochrominae (ou tribu de Pseudocrenilabrinae) : un genre en Afrique
- Tilapiinae (ou tribu de Pseudocrenilabrinae) : 34 genres en Afrique
- Pseudocrenilabrinae : 111 genres en Afrique
- Retroculinae : néotropical
- Cichlinae : néotropical
- Astronotinae : néotropical
- Geophaginae : néotropical
- Cichlasomatinae : néotropical
Genres
- genre Abactochromis (Trewavas, 1935)[6]
- genre Acarichthys Eigenmann, 1912
- genre Acaronia Myers, 1940
- genre Aequidens Eigenmann et Bray, 1894 (Aequidens pulcher, Cichlidé-drapeau…)
- genre Alcolapia Thys van den Audenaerde, 1969
- genre Allochromis Greenwood, 1980
- genre Alticorpus Stauffer et McKaye, 1988
- genre Altolamprologus Poll, 1986
- genre Amatitlania Schmitter-Soto 2007
- genre Amphilophus Agassiz, 1859
- genre Andinoacara Musilová, Říčan & Novák, 2009
- genre Anomalochromis Greenwood, 1985
- genre Apistogramma Regan, 1913
- genre Apistogrammoides Meinken, 1965
- genre Archocentrus Gill in Gill et Bransford, 1877
- genre Aristochromis Trewavas, 1935
- genre Astatoreochromis Pellegrin, 1904
- genre Astatotilapia Pellegrin, 1904
- genre Astronotus Swainson, 1839 (Oscar…)
- genre Aulonocara Regan, 1922
- genre Aulonocranus Regan, 1920
- genre Australoheros Říčan and Kullander, 2006 (non reconnu par ITIS)
- genre Baileychromis Poll, 1986
- genre Bathybates Boulenger, 1898
- genre Benitochromis Lamboj, 2001
- genre Benthochromis Poll, 1986
- genre Biotodoma Eigenmann et Kennedy, 1903
- genre Biotoecus Eigenmann et Kennedy, 1903
- genre Boulengerochromis Pellegrin, 1904
- genre Buccochromis Eccles et Trewavas, 1989
- genre Bujurquina Kullander, 1986
- genre Callochromis Regan, 1920
- genre Caprichromis Eccles et Trewavas, 1989
- genre Caquetaia Fowler, 1945
- genre Cardiopharynx Poll, 1942
- genre Chaetobranchopsis Steindachner, 1875
- genre Chaetobranchus Heckel, 1840
- genre Chalinochromis Poll, 1974
- genre Champsochromis Boulenger, 1915
- genre Cheilochromis Eccles et Trewavas, 1989
- genre Chetia Trewavas, 1961
- genre Chilochromis Boulenger, 1902
- genre Chilotilapia Boulenger, 1908
- genre Chromidotilapia Boulenger, 1898
- genre Cichla Bloch et Schneider, 1801
- genre Cichlasoma Swainson, 1839 Cichlidé à tête bossue, Cichlidé-forçat ou zébré, Cichlidé-drapeau…)
- genre Cleithracara Kullander et Nijssen, 1989
- genre Congochromis Stiassny & Schliewen 2007
- genre Copadichromis Eccles et Trewavas, 1989
- genre Copora Fernández-Yépez, 1969 (non reconnu par FishBase car sans espèce selon ITIS)
- genre Coptodon Gervais, 1848
- genre Corematodus Boulenger, 1897
- genre Crenicara Steindachner, 1875
- genre Crenicichla Heckel, 1840
- genre Ctenochromis Pfeffer, 1893
- genre Cryptoheros Allgayer, 2001
- genre Ctenopharynx Eccles et Trewavas, 1989
- genre Cunningtonia Boulenger, 1906
- genre Cyathochromis Trewavas, 1935
- genre Cyathopharynx Regan, 1920
- genre Cyclopharynx Poll, 1948
- genre Cynotilapia Regan, 1922
- genre Cyphotilapia Regan, 1920
- genre Cyprichromis Scheuermann, 1977
- genre Cyrtocara Boulenger, 1902
- genre Danakilia Thys van den Audenaerde, 1969
- genre Dicrossus Steindachner, 1875
- genre Dimidiochromis Eccles et Trewavas, 1989
- genre Diplotaxodon Trewavas, 1935
- genre Divandu Lamboj et Snoeks, 2000
- genre Docimodus Boulenger, 1897
- genre Eclectochromis Eccles et Trewavas, 1989
- genre Ectodus Boulenger, 1898
- genre Enantiopus Boulenger, 1906
- genre Enigmatochromis Lamboj, 2009
- genre Eretmodus Boulenger, 1898
- genre Etia Schliewen et Stiassny, 2003
- genre Etroplus Cuvier in Cuvier et Valenciennes, 1830
- genre Exochochromis Eccles et Trewavas, 1989
- genre Fossorochromis Eccles et Trewavas, 1989
- genre Gaurochromis Greenwood, 1980 (non reconnu par FishBase qui nomme Haplochromis obtusidens son unique espèce Gaurochromis obtusidens)
- genre Genyochromis Trewavas, 1935
- genre Geophagus Heckel, 1840
- genre Gephyrochromis Boulenger, 1901
- genre Gnathochromis Poll, 1981
- genre Gobiocichla Kanazawa, 1951
- genre Grammatotria Boulenger, 1899
- genre Greenwoodochromis Poll, 1983
- genre Guianacara Kullander et Nijssen, 1989
- genre Gymnogeophagus Miranda Ribeiro, 1918
- genre Haplochromis Hilgendorf, 1888
- genre Haplotaxodon Boulenger, 1906
- genre Hemibates Regan, 1920
- genre Hemichromis Peters, 1857
- genre Hemitaeniochromis Eccles et Trewavas, 1989
- genre Hemitilapia Boulenger, 1902
- genre Herichthys Baird et Girard, 1854
- genre Heroina Kullander, 1996
- genre Heros Heckel, 1840
- genre Herotilapia Pellegrin, 1904
- genre Heterochromis Regan, 1922 (Cichlidé rouge ou Poisson-joyau…)
- genre Heterotilapia Regan, 1920
- genre Hoplarchus Kaup, 1860
- genre Hoplotilapia Hilgendorf, 1888
- genre Hypselecara Kullander, 1986
- genre Hypsophrys Agassiz, 1859
- genre Interochromis Yamaoka, Hori et Kuwamura, 1988
- genre Iodotropheus Oliver et Loiselle, 1972
- genre Iranocichla Coad, 1982
- genre Julidochromis Boulenger, 1898
- genre Katria Stiassny & Sparks, 2006 (non reconnu par ITIS)
- genre Konia Trewavas in Trewavas, Green et Corbet, 1972
- genre Krobia Kullander et Nijssen, 1989
- genre Labeotropheus Ahl, 1926
- genre Labidochromis Trewavas, 1935
- genre Laetacara Kullander, 1986
- genre Lamprologus Schilthuis, 1891
- genre Lepidiolamprologus Pellegrin, 1904
- genre Lestradea Poll, 1943
- genre Lethrinops Regan, 1922
- genre Lichnochromis Trewavas, 1935
- genre Limbochromis Greenwood, 1987
- genre Limnochromis Regan, 1920
- genre Limnotilapia Regan, 1920
- genre Lithochromis Lippitsch et Seehausen in Seehausen et al., 1998
- genre Lobochilotes Boulenger, 1915
- genre Macropleurodus Regan, 1922
- genre Maravichromis Eccles et Trewavas, 1989
- genre Maylandia Meyer et Foerster, 1984
- genre Mazarunia Kullander, 1990
- genre Mbipia Lippitsch et Seehausen in Seehausen et al., 1998
- genre Mchenga Stauffer & Konings 2006 (non reconnu par ITIS)
- genre Melanochromis Trewavas, 1935
- genre Mesonauta Günther, 1862
- genre Metriaclima Stauffer, Bowers, Kellogg, et McKaye, 1997 (non reconnu par FishBase qui place ses espèces dans Maylandia)
- genre Microchromis Johnson, 1975
- genre Mikrogeophagus Meulengracht-Madson in Schiötz et Christensen, 1968
- genre Myaka Trewavas in Trewavas, Green et Corbet, 1972
- genre Mylochromis Regan, 1920
- genre Naevochromis Eccles et Trewavas, 1989
- genre Nandopsis Gill, 1862
- genre Nannacara Regan, 1905
- genre Nanochromis Pellegrin, 1904
- genre Neochromis Regan, 1920
- genre Neolamprologus Colombe et Allgayer, 1985
- genre Nimbochromis Eccles et Trewavas, 1989
- genre Nyassachromis Eccles et Trewavas, 1989
- genre Ophthalmotilapia Pellegrin, 1904
- genre Oreochromis Günther, 1889
- genre Orthochromis Greenwood, 1954
- genre Otopharynx Regan, 1920
- genre Oxylapia Kiener et Maugé, 1966
- genre Pallidochromis Turner, 1994
- genre Parachromis Agassiz, 1859
- genre Paracyprichromis Poll, 1986
- genre Paralabidochromis Greenwood, 1956
- genre Parananochromis Greenwood, 1987
- genre Paraneetroplus Regan, 1905
- genre Paratilapia Bleeker, 1868
- genre Paretroplus Bleeker, 1868
- genre Pelmatochromis Steindachner, 1894
- genre Pelvicachromis Thys van den Audenaerde, 1968
- genre Perissodus Boulenger, 1898
- genre Petenia Günther, 1862
- genre Petrochromis Boulenger, 1898
- genre Petrotilapia Trewavas, 1935
- genre Pharyngochromis Greenwood, 1979
- genre Placidochromis Eccles et Trewavas, 1989
- genre Platytaeniodus Boulenger, 1906
- genre Plecodus Boulenger, 1898
- genre Protomelas Eccles et Trewavas, 1989
- genre Pseudocrenilabrus Fowler, 1934
- genre Pseudosimochromis Nelissen, 1977
- genre Pseudotropheus Regan, 1922
- genre Pterochromis Trewavas, 1973
- genre Pterophyllum Heckel, 1840 (Scalaire…)
- genre Ptychochromis Steindachner, 1880
- genre Ptychochromoides Kiener et Maugé, 1966
- genre Pundamilia Seehausen et Lippitsch in Seehausen et al., 1998
- genre Pungu Trewavas in Trewavas, Green et Corbet, 1972
- genre Pyxichromis Greenwood, 1980
- genre Reganochromis Whitley, 1929
- genre Retroculus Eigenmann et Bray, 1894
- genre Rocio Schmitter-Soto, 2007
- genre Rhamphochromis Regan, 1922
- genre Sargochromis Regan, 1920
- genre Sarotherodon Rüppell, 1852
- genre Satanoperca Günther, 1862
- genre Schubotzia Boulenger, 1914
- genre Schwetzochromis Poll, 1948
- genre Sciaenochromis Eccles et Trewavas, 1989
- genre Serranochromis Regan, 1920
- genre Simochromis Boulenger, 1898
- genre Spathodus Boulenger, 1900
- genre Steatocranus Boulenger, 1899
- genre Stigmatochromis Eccles et Trewavas, 1989
- genre Stomatepia Trewavas, 1962
- genre Symphysodon Heckel, 1840 (Disque/Discus brun, Disque/Discus bleu, Disque/Discus rouge, Disque/Discus vert…)
- genre Taeniacara Myers, 1935
- genre Taeniochromis Eccles et Trewavas, 1989
- genre Taeniolethrinops Eccles et Trewavas, 1989
- genre Tahuantinsuyoa Kullander, 1986
- genre Tangachromis Poll, 1981
- genre Tanganicodus Poll, 1950
- genre Teleocichla Kullander, 1988
- genre Teleogramma Boulenger, 1899
- genre Telmatochromis Boulenger, 1898
- genre Theraps Günther, 1862
- genre Thoracochromis Greenwood, 1979
- genre Thorichthys Meek, 1904
- genre Thysochromis Daget, 1988
- genre Tilapia Smith, 1840
- genre Tomocichla Regan, 1908
- genre Tramitichromis Eccles et Trewavas, 1989
- genre Trematocara Boulenger, 1899
- genre Trematochromis Poll, 1987
- genre Trematocranus Trewavas, 1935
- genre Triglachromis Poll et Thys van den Audenaerde, 1974
- genre Tristramella Trewavas, 1942
- genre Tropheops Trewavas, 1984[7]
- genre Tropheus Boulenger, 1898
- genre Tylochromis Regan, 1920
- genre Tyrannochromis Eccles et Trewavas, 1989
- genre Uaru Heckel, 1840
- genre Variabilichromis Colombe et Allgayer, 1985
- genre Vieja Fernández-Yépez, 1969
- genre Xenochromis Boulenger, 1899
- genre Xenotilapia Boulenger, 1899
Galerie
 L'oscar (Astronotus ocellatus) est l'un des Cichlidés les plus populaires en aquariophilie.
L'oscar (Astronotus ocellatus) est l'un des Cichlidés les plus populaires en aquariophilie.
 Oreochromis niloticus est élevé et consommé dans de nombreuses régions du monde.
Oreochromis niloticus est élevé et consommé dans de nombreuses régions du monde. Le scalaire (Pterophyllum scalare) a longtemps été élevé pour le commerce aquariophile.
Le scalaire (Pterophyllum scalare) a longtemps été élevé pour le commerce aquariophile. Le dimorphisme sexuel est visible chez les Cichlidés. Un mâle (devant) et une femelle (à l'arrière) Maylandia lombardoi.
Le dimorphisme sexuel est visible chez les Cichlidés. Un mâle (devant) et une femelle (à l'arrière) Maylandia lombardoi. Un couple de ramirezi (Mikrogeophagus ramirezi), mâle devant, femelle derrière. Beaucoup de Cichlidés forment des couples pour se reproduire.
Un couple de ramirezi (Mikrogeophagus ramirezi), mâle devant, femelle derrière. Beaucoup de Cichlidés forment des couples pour se reproduire. Un discus (Symphysodon) surveille ses œufs. La protection des œufs est l'une des caractéristiques des Cichlidés.
Un discus (Symphysodon) surveille ses œufs. La protection des œufs est l'une des caractéristiques des Cichlidés. Le lac Malawi en Afrique de l'Ouest abrite de nombreuses espèces de Cichlidés, dont Nimbochromis livingstonii.
Le lac Malawi en Afrique de l'Ouest abrite de nombreuses espèces de Cichlidés, dont Nimbochromis livingstonii. Un cichlidé du genreNeolamprologus originaire du lac Tanganyika en Afrique de l'Est.
Un cichlidé du genreNeolamprologus originaire du lac Tanganyika en Afrique de l'Est..jpg.webp) Le cichlidé du Texas (Herichthys cyanoguttatus) est le seul cichlidé indigène des États-Unis.
Le cichlidé du Texas (Herichthys cyanoguttatus) est le seul cichlidé indigène des États-Unis..jpg.webp) Pelvicachromis pulcher est un cichlidé nain originaire de l'Afrique de l'Ouest.
Pelvicachromis pulcher est un cichlidé nain originaire de l'Afrique de l'Ouest.

Notes et références
- Fishbase consulté le 22/02/2009
- (en) M. Emília Santos, « One gene, multiple alleles: insights into the microevolution of pigmentation polymorphisms », Molecular Ecology, vol. 26, no 10, , p. 2605–2607 (DOI 10.1111/mec.14099, lire en ligne, consulté le )
- « Ce petit poisson aussi souffre de chagrins d'amour », sur www.20minutes.fr (consulté le )
- (en) Claire T O’Quin, Alexi C Drilea, Matthew A Conte et Thomas D Kocher, « Mapping of pigmentation QTL on an anchored genome assembly of the cichlid fish, Metriaclima zebra », BMC Genomics, vol. 14, no 1, , p. 287 (ISSN 1471-2164, DOI 10.1186/1471-2164-14-287, lire en ligne, consulté le )
- (en) Laura A. Hendrick, Grace A. Carter, Erin H. Hilbrands et Brian P. Heubel, « Bar, stripe and spot development in sand-dwelling cichlids from Lake Malawi », EvoDevo, vol. 10, no 1, , p. 18 (ISSN 2041-9139, PMID 31417669, PMCID PMC6691528, DOI 10.1186/s13227-019-0132-7, lire en ligne, consulté le )
- (en) « Abactochromis labrosus summary page », sur FishBase (consulté le ).
- http://www.fishbase.org/Nomenclature/ValidNameList.php?syng=Tropheops&syns=&vtitle=Scientific+Names+where+Genus+Equals+%3Ci%3ETropheops%3C%2Fi%3E&crit2=CONTAINS&crit1=EQUAL
Voir aussi
Bibliographie
- Axel Meyer, « Cichlidés : les clés d'une spectaculaire évolution », Pour la science, no 463, , p. 44-50
Liens externes
- (en) Référence Catalogue of Life : Cichlidae (consulté le )
- Référence http://www.la-passion-des-poissons.over-blog.fr/
- (en) Référence Fauna Europaea : Cichlidae (consulté le )
- (fr+en) Référence FishBase : () ()
- (fr+en) Référence ITIS : Cichlidae
- (en) Référence World Register of Marine Species : taxon Cichlidae (+ liste espèces)
- (en) Référence Animal Diversity Web : Cichlidae
- (en) Référence NCBI : Cichlidae (taxons inclus)
- Cichlide38: les Cichlidés des lacs Malawi et Tanganyika