Acidification des océans
L'acidification des océans est la diminution progressive du pH des océans. Il a été estimé que de 1950 à 2021, le pH des eaux superficielles des océans a diminué, passant de 8,15 à 8,05[1] — l'eau de mer est légèrement basique (c'est-à-dire pH > 7) et on parle d'acidification des océans dès lors que le pH devient moins basique. C'est « l'autre problème »[2] induit par l'augmentation des émissions de dioxyde de carbone (CO2) d'origine anthropique dans l'atmosphère.
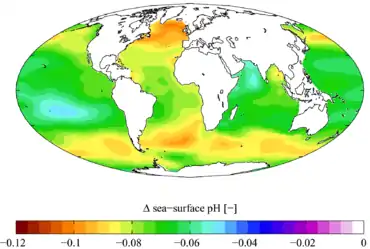

Selon les modèles biogéochimiques disponibles, d'importants changements dans la chimie et la biochimie océaniques sont à attendre[3], de même que des impacts délétères sur les écosystèmes. Les effets sur les récifs coralliens[4] sont très étudiés (dont en mésocosmes[5]) et les plus médiatisés, mais d'autres effets existent et sont attendus dans la plupart des milieux aquatiques. Selon l'Organisation météorologique mondiale (OMM), cette acidification pourrait en partie expliquer l'augmentation annuelle record mesurée en 2013 en termes d'augmentation du taux de CO2 dans l'atmosphère, et donc contribuer au dérèglement climatique. Selon les données réunies par l’OMM en 2013-2014, l'océan mondial absorbe actuellement un quart environ des émissions anthropiques de CO2, soit environ 4 kg de CO2 par jour et par personne[6] (c'est-à-dire près de 22 millions de tonnes de CO2 absorbée par jour de manière globalisée)[7] - [8]. Cet effet « pompe à carbone » contribue fortement à réduire la quantité de CO2 de l’atmosphère, dont le CO2 issu des combustibles fossiles, mais cette capacité semble se dégrader en raison des effets combinés du réchauffement et de l'acidification qui affectent la production et la fixation de carbonates marins (principal puits de carbone planétaire)[6]. Selon l'OMM, le pompage océanique du carbone est déjà réduit en 2013 à 70 % de ce qu'il était au début de l'ère industrielle et il pourrait s'affaiblir jusqu'à 20 % d'ici 2100[6], tandis que, selon les données paléoenvironnementales disponibles, l'acidification des océans suit actuellement un rythme inédit durant les trois-cents derniers millions d'années et ne pourra qu'accélérer encore jusque 2050[6] (et au-delà si d'importants efforts de mitigation ne sont pas entrepris).
Le rapport 2014 du GIEC puis celui de l'OMM[6] ne décèlent d'ailleurs pas d'amélioration dans les tendances en termes de concentration croissante du CO2 émis dans l'air ; et « le scénario retenu par la plupart des scientifiques conduit à une diminution du pH, d'ici la fin du siècle, de 0,3. Si a priori ce chiffre semble faible, il ne faut pas oublier qu'il s'agit d'une grandeur logarithmique, soit une acidité multipliée par deux »[9].
L'acidification des océans est une des neuf limites planétaires, non encore franchie en 2022.
Causes
Cette acidification a au moins trois causes anthropiques identifiées :
- l'absorption de dioxyde de carbone atmosphérique dont le taux augmente (cette augmentation est en grande partie d'origine anthropique) [Note 1] - [6]. C'est la première cause identifiée, et probablement la plus importante ;
- l'absorption par l'océan de pluies ou d'eaux météoriques ou de ruissellement acidifiées par divers composés azotés anthropiques dits azote réactif. Ces composés sont notamment issus (directement ou indirectement par photochimie) de la circulation motorisée, de l'agriculture et du chauffage qui dégagent des oxydes d'azote, source d'acide nitreux et d'acide nitrique qui contaminent l'atmosphère puis les mers via les pluies et les cours d'eau. Les analyses isotopiques montrent que l'humain a plus que doublé la quantité d'azote réactif (Nr) annuellement entrant dans la biosphère, essentiellement à partir de 1895 ± 10 ans (± 1 pour l'écart-type) avec une forte augmentation dans les années 1960 à 2010, principalement dans l'hémisphère Nord[10] ;
- l'absorption de composés soufrés issus des combustibles fossiles (pétrole, charbon, gaz). Le soufre, lors de la combustion se transforme en effet en dioxyde de soufre, source d'acide sulfureux et d'acide sulfurique. La plupart des navires de marine marchande et de marine de guerre utilisent encore des combustibles lourds très polluants et notamment sources d'aérosols soufrés. Ils sont une source importante d'aérosols atmosphériques.
Ces trois facteurs associés pourraient avoir des effets environnementaux synergiques, et acidifient les eaux côtières plus rapidement que ne le prévoyaient les premières modélisations.
Environ six téramoles d'azote actif (et deux téramoles de soufre) seraient annuellement injectées dans l’atmosphère, ce qui est bien moins que les 700 téramoles de CO2, selon une étude récente pilotée par Scott Doney (en) (Institut océanographique de Woods Hole, Massachusetts, USA). Cet azote aurait sur certains littoraux un impact équivalent à 10 à 50 % de celui du CO2. L'océan lointain est moins touché, mais les zones côtières et proches du plateau continental sont largement les plus importantes pour l'Homme (pêche, activité économique et touristique).
Il semble de plus que les estuaires et les zones mortes ne remplissent plus leur rôle de puits de carbone, et que l'acidification est un phénomène qui puisse — parfois (comme dans le cas du drainage minier acide) et dans une certaine mesure — s'autoentretenir.
Perturbation du cycle du carbone
Dans le cycle du carbone naturel, la concentration de dioxyde de carbone (CO2) représente un équilibre de flux entre les océans, la biosphère terrestre, et l'atmosphère. L'usage de combustibles fossiles et notamment la production de ciment entraînent un nouveau flux de CO2 dans l'atmosphère. Une partie reste dans l'atmosphère, une autre partie est absorbée par les plantes terrestres, et une dernière partie d'environ 25 % est absorbée par les océans.
Quand le CO2 se dissout, il réagit avec l'eau pour former un équilibre d'espèces chimiques ioniques et non ioniques : dioxyde de carbone libre dissous CO2(aq) (très partiellement hydraté en acide carbonique dissous H2CO3(aq)), bicarbonate HCO3− et carbonate CO32−. La proportion de ces espèces dépend principalement de l'alcalinité de l'eau et secondairement de facteurs tels que la température et la salinité de l'eau de mer qui décline localement (là où les glaces ou glaciers fondent rapidement).
(voir l'article Solubility pump consacré à la pompe de solubilité (en) de l'océan).
Une idée courante est que la perte de capacité de biominéralisation des organismes à squelette ou coquille calcaire serait principalement due à un manque d'ion carbonate[11], mais les recherches récentes suggèrent que, c'est plus probablement la réduction du pH de l'eau de mer (c'est-à-dire l'augmentation du taux de protons [H+]) qui est le facteur le plus direct des difficultés de calcification apparues chez ces organismes. Trop de protons dans l'eau modifie les équilibres osmotiques et empêchent la plupart de ces organismes de maintenir leur homéostasie du pH[11]. Le manque d'ions carbonate est aussi en jeu, car le coût énergétique de la calcification augmente quand la saturation de l'eau en carbonates diminue[12].
Perturbation du cycle de l'azote
Au niveau planétaire, l'apport anthropique d'azote n'influence quantitativement que modestement l'acidification de l'océan (loin derrière le CO2). Mais près des côtes, où l'on trouve une grande partie de la biodiversité marine (dont une partie est une ressource alimentaire), les apports anthropogéniques de soufre et d'azote (0,8 Tmol/an de soufre réactif et 2,7 Tmol/an d'azote réactif au tout début du XXIe siècle[13]) sont très importants, et leurs effets acidifiants plus sérieux. Des apports d'azote atmosphérique vers l'océan sont en outre aussi en forte augmentation, dont dans le nord-ouest du Pacifique[14].
Dans l'hémisphère nord, le bilan des entrées de ces deux éléments dans les couches supérieures de l'océan est clairement acidifiant.
Sous les tropiques, il est initialement plutôt basique, mais in fine acidifiant en raison du taux de transformation de l'ammoniac en nitrate dans l'écosystème[13]. Sur la planète, le bilan final est presque partout acidifiant et il réduit sur les littoraux la quantité de CO2 que l'océan peut dissoudre.
Ailleurs, on a constaté que dans des parties oligotrophes (pauvres en éléments nutritifs) de l'océan certaines cyanobactéries fixatrices d'azote et responsables de blooms bactériens, comme celles du genre Trichodesmium profitent du taux accru de CO2 et deviennent l'origine d'une partie importante de la productivité primaire de l'océan, au détriment des espèces animales à coquille ou squelette calcaire. Là, une forte augmentation de la fixation de carbone et d'azote est constatée (traduite dans le rapport C/N[15]. En Baltique et dans l'estuaire australien de Peel-Harvey, une microalgue filamenteuse (Nodularia spumigena) se comporte de la même manière[16] - [17]. Au niveau de 750 ppmv de CO2, les taux de fixation de CO2 ont augmenté de 15 à 128 % et des taux de fixation de N2 ont augmenté de 35-100 % par rapport aux tarifs en conditions actuelles de CO2 de jour[18]. Le caractère « hétérocyste » ou « non hétérocyste » de l'espèce pourrait expliquer certaines adaptation ou tolérance à l'acidification de l'eau[17].
Dans le cycle de l'azote[19], l'azote anthropique (NOx), avec les oxydes de soufre atmosphériques contribue à l'acidification des mers[13]. Et cette acidification diminue les capacités de nitrification des écosystèmes marins[20]. La part anthropique de l'azote[21] est en augmentation presque partout dans l'hémisphère nord et dans une partie de l'hémisphère sud.
Les apports terrigènes d'azote et de phosphore des cours d'eau à l'Atlantique Nord ont été mesurés pour 14 grandes régions d'Amérique du Nord et du Sud, d'Europe, d'Afrique : le bassin amazonien domine le flux global de phosphore (c'est aussi le flux le plus élevé de phosphore par unité de surface) mais il est maintenant dépassé en termes de flux total d'azote par les bassins versants du nord-est des États-Unis, qui dépassent tous 1 000 kg d'azote par km2/an[21].
Le flux azote déversé dans Atlantique-Nord par chaque bassin versant est corrélé à la densité de population du bassin (comme cela avait déjà été observé pour les flux de nitrate de grands fleuves du monde) ; les auteurs de cette étude jugent « frappante » la forte corrélation linéaire entre les flux d'azote total et la somme des apports d'azote d'origine anthropique dans les régions tempérées (engrais, dépôts atmosphériques des NOx anthropiques, fixation par les légumineuses, et importation/exportation d'azote via les produits agricoles). Les fleuves des grandes régions étudiées exportent en mer environ 25 % de l'azote qui a été introduit par l'humain dans les écosystèmes (le reste étant éliminé par dénitrification dans les écosystèmes humides et aquatiques qui semblent être le puits d'azote dominant ; mais la forêt semble aussi avoir de l'importance en termes de stockage/pompage de l'azote[21]. Les eaux souterraines en stockent et dénitrifient un peu et localement, mais sont un « très petit puits d'azote » à l'échelle des continents.
L'agriculture est principalement responsable dans de nombreuses régions (dans le bassin du Mississippi et les bassins de la mer du Nord notamment), et les retombées de NOx sont la première cause d'exportation d'azote vers la mer dans plusieurs régions (dont au nord-est des États-Unis).
Si l'on considère les zones peu anthropisées comme référence, les auteurs estiment que le flux d'azote terre → mer a – dans presque toutes les régions tempérées – augmenté de 2 à 20 fois (selon les régions) de l'époque préindustrielle au début du XXIe siècle. Seules quelques régions (ex : Grand-Nord Canadien) ont peu changé de ce point de vue[21].
Les bassins de zone tempérée alimentant la mer du Nord, y apportent 6 à 20 fois plus d'azote qu'au début de l'ère industrielle, et le bassin de l'Amazone au moins 2 à 5 fois plus que les flux estimés à partir des régions de la zone tempérée « intacte », malgré la densité de la population et ses faibles apports directs d'azote d'origine anthropique dans la région. Ceci suggère que les flux d'azote naturels ou causés par la déforestation tropicale peuvent être significativement plus élevé qu'en zone tempérée[21]. Comme la déforestation, l'artificialisation des sols et les apports d'engrais se poursuivent en zone tropicale, les auteurs s'attendent à une « spectaculaire augmentation de la charge d'azote de nombreux systèmes fluviaux tropicaux »[21].
Effets sur coraux et organismes à coquilles ou squelette calcaire
Ces espèces pourraient gravement souffrir de l'acidification, combinée au réchauffement[22], les coraux sont un habitat essentiel pour environ 25 % de la vie océanique[23].
Une étude récente a confirmé que le squelette du corail est bien bioconstruit par l'animal[24] à partir de nanoparticules amorphes collectées dans l'eau et agrégées en structures aragoniques grâce à un groupe de protéines riches en acides coralliens et non par simple précipitation inorganique de l'aragonite autour d'un noyau minéral. Ces protéines peuvent a priori fonctionner à des pH un peu plus acides que le pH actuel de l'eau de mer[23] mais - précisent les auteurs - « cela ne signifie pas que les récifs coralliens sont hors de danger ; premièrement car ils ont encore besoin de carbonate de calcium pour constituer le récif (matériau qui devrait être plus rare dans une mer acidifiée) ; deuxièmement car ils resteront toujours menacés par le réchauffement de l'eau et les proliférations algales qui peuvent conduire au blanchissement des coraux et à leur mort ».[23].
Déterminer précisément la contribution de l'acidification au recul des récifs coralliens est « difficile, voire impossible, en raison d'effets de confusion d'autres facteurs environnementaux tels que la température »[25].
En 2016, la revue Nature publie le résultat d'une expérience in situ de réduction de l'acidité de l'eau baignant un récif corallien (au niveau de l'ère préindustrielle) : la calcification du récif a significativement augmenté dans la zone de l'expérimentation. Selon Janice M. Lough[26], ceci laisse supposer que le niveau actuel de l'acidification des océans « peut déjà compromettre la croissance des récifs coralliens »[27].
Des chercheurs de l'Institut Alfred Wegener en Allemagne ont compilé 167 études scientifiques concernant 150 espèces marines (des coraux aux poissons en passant par les crustacés). Ils concluent de ce travail que « tous les groupes d'animaux sont négativement affectés par l'augmentation de la concentration en CO2 » ; les plus sensibles à l'acidification sont « les coraux, les échinodermes et les mollusques » précise le Dr. Astrid Wittmann. « Les crustacés comme le crabe comestible ou l'araignée de mer semblent peu affectés par l'acidification, même si une hausse simultanée des températures leur sera certainement problématique »[28].
De nombreux organismes planctoniques à squelette calcaire ou d'autres animaux à coquille calcaire (et en particulier leurs larves) ont aussi des difficultés à synthétiser leur thèque, planctonique ou coquille[29].
Le dioxyde de carbone absorbé dans l'océan réagit avec les molécules d'eau pour former de nombreux ions tel que l'hydrogénocarbonate (équivalent au bicarbonate). La formation de ces ions réduit la concentration en ions carbonates qui sont nécessaires à la formation de carbonate de calcium. Or le carbonate de calcium est nécessaire à la calcification des coraux (et des coquillages). Cette réaction chimique empêche donc la formation normale des coraux et des coquilles[30].
Une étude sur les effets de l'acidification en Antarctique chez les ptéropodes (ou papillons de mer) montre qu'à partir d'une certaine acifification de l'eau, les individus meurent (en à peine quarante-huit heures[31]), or ces animaux sont à la base du réseau trophique dans cette région et comme certaines algues (coccolithes) qui sécrètent des coquilles à base de calcium, ils jouent un rôle important dans le cycle du carbone.
De jeunes coraux australiens cultivé dans des conditions de température et de taux de CO2 telles qu'attendues pour 2100 montrent une moindre croissance squelettique, mais ils développent aussi différents types de malformations du squelette qui compromettraient leur chance de survie et de bonne croissance sur le récif[32] - [33].
D’autres travaux menés en Papouasie-Nouvelle-Guinée montrent, dans des conditions d’acidité semblables une forte prolifération des algues non calcaires et une réduction d’environ 40 % de la biodiversité des coraux. Or, comme le note le rapport, les récifs coralliens sont actuellement une source de revenus indirecte pour environ 400 millions de personnes, vivant majoritairement en zone tropicale[34].
Évolution de l'« acidité » des océans, accélération de l'acidification
L'acidité des océans aurait augmenté de 30 % environ depuis le début de la révolution industrielle. Ceci correspond à une chute de 0,1 du pH, pour atteindre 8,1 ou 8,14 selon les sources aujourd'hui (les océans sont ainsi alcalins et non acides, leur pH se situant au-dessus de 7)[35] - [36].
La diminution du pH des eaux de surface de l’océan et l'augmentation de la pression partielle de CO2 (pCO2) se font à des vitesses différentes selon les régions, mais elles sont déjà détectées in situ depuis plusieurs décennies[6] dans de grandes régions subpolaires aux zones subtropicales et tropicales[6]. Les variations les plus extrêmes figurent dans les séries chronologiques enregistrées dans les zones subpolaires, ce qui s'explique par le fait que les différences saisonnières de température et de productivité biologique y sont les plus marquées[6].
Sur la base des prévisions du GIEC (ou IPCC en anglais), l'augmentation actuelle du taux de CO2 dans l’atmosphère devrait encore diminuer le pH des eaux du globe de 8,14 actuellement à 7,8 d'ici la fin du siècle[37]. Un rapport du PNUE fait part d'une diminution du pH de 0,3 d'ici 2100, tandis qu'un communiqué de presse du CNRS avance une baisse de 0,4[38] - [39].
En 2014, le rapport sur les effets de l'acidification des océans sur la biologie marine (synthétisant une centaine d'études sur ce thème), présenté à la 12e réunion de la Convention sur la diversité biologique (CDB) à Pyeongchang (Corée du Sud) confirme que l'acidification a progressé (en moyenne de 26 % depuis l'époque préindustrielle) et que si, depuis deux siècles, l'océan a absorbé plus du quart du CO2 anthropique, contribuant à acidifier le milieu océanique, « de façon quasiment inévitable, d'ici 50 à 100 ans, les émissions de dioxyde de carbone vont encore augmenter l'acidité des océans à des niveaux qui auront des impacts massifs, le plus souvent négatifs, sur les organismes marins et les écosystèmes, ainsi que sur les biens et les services qu'ils fournissent »[40]. « De nombreuses études montrent une réduction des taux de croissance et de survie des coraux, mollusques et échinodermes [étoiles de mer, oursins, concombres de mer, etc.]. » Certaines espèces supporteront mieux l'acidification que d'autres. Certaines subiront une dégradation de leurs systèmes sensoriels induisant des anomalies de comportement (poissons, certains invertébrés)[40]. Les cycles biogéochimiques du carbone, de l'azote du fer et du calcium en seront affectés, dans les habitats côtiers plus qu'en haute mer et plus vite en Arctique qu'en Antarctique (plus froid)[40]. « Le coût global des impacts de l'acidification des océans sur les mollusques et les récifs coralliens tropicaux est estimé à plus de 1000 milliards de dollars par an d'ici la fin du siècle[40]. » Des phénomènes d'acidification ont déjà eu lieu, dont au Paléocène-Éocène (il y a 56 millions d'années), mais il semble aujourd'hui trop rapide pour qu'un grand nombre d'espèces puisse s'y adapter. « Même si les émissions de CO2 sont réduites de manière significative, l'acidification des océans se poursuivra durant des dizaines de milliers d'années, les modifications considérables pour les écosystèmes, et la nécessité d'apprendre à vivre avec ces changements semblent donc certains »[40].
2018 et 2019 ont connu des records de réchauffement des eaux entre 0 et 2 000 mètres[41], les dix dernières années étant les dix plus chaudes jamais enregistrées dans l’océan. 2019 a aussi connu un nouveau record d'absorption nette de CO2 par l'océan pour la période de 1982 à 2019 : ~ 2,4 Pg C, soit u+0,2 Pg C par rapport à 2018, ce qui poursuit une tendance amorcée en 2000-2002 et a aggravé l'acidification des océans (pH diminuant dans la plus grande partie de l'océan, surtout dans ses eaux les plus froides : 0,018 ± 0,004 unité par décennie depuis la période préindustrielle)[41].
Conséquences environnementales, halieutiques et pour les services écosystémiques
En perturbant et dégradant certains écosystèmes (coralliens notamment[42]), l'acidification des mers dégrade d'importants services écosystémiques et de manière générale tous les écosystèmes.
Elle met en péril de nombreuses espèces[42] - [43] - [44].
En affectant les animaux à coquilles, l’acidification peut conduire à une dégradation de la qualité de l'eau et des sédiments, faute d'animaux filtreurs tels que les moules et les huîtres[45] qui filtrent et nettoient quotidiennement de grands volumes d'eau[46].
Certains oursins se montrent sensibles à de faibles baisses de pH (proches de celles qui sont attendues d'ici quelques décennies), qui dégradent leurs capacités de reproduction[47].
Menaces pour la sécurité alimentaire
En 2013, les 540 experts et scientifiques réunis au 3e symposium de Monterey sur l'acidification des océans[48] - [49] (de 2012) ont voulu réattirer l'attention des décideurs sur cet enjeu planétaire en rappelant que – alors que la coquille d'escargots aquatiques commence à être érodées dans certaines parties de l'océan – le chiffre d'affaires généré par les activités des éleveurs de moules et huîtres et pêcheurs d'échinodermes (oursins), de crustacés (crevettes, crabes) et de poissons approche les 130 milliards de dollars (96,5 Md€), et que la régression ou disparition de certaines espèces consommées par l'humain (poissons notamment) aurait des conséquences sur la sécurité alimentaire[50].
Ils ajoutent que via la protection du littoral et de la faune côtière contre la houle et les tempêtes, et via le tourisme et la pêche qu'ils favorisent, les récifs et sables coralliens fournissent des services dont la valeur a été estimée comprise entre 30 et 375 Md$ (22 à 278 Md€) par an (selon les modalités de calcul)[50]. Les huîtres sont d'ailleurs aussi partie majeure dans la ligne de mire de ce phénomène, car dans impossibilité de se développer convenablement étant donné la faible production de coquilles agissant comme élément protecteur dans leur croissance[51].
Les effets de l'acidification s'observent déjà dans le secteur de l'aquaculture dans le Nord-Ouest des États-Unis qui connaît une mortalité élevée dans les écloseries d'huîtres[52].
Le coût global des impacts de l'acidification des océans sur les mollusques et les récifs coralliens tropicaux est estimé à plus de 1.000 milliards de dollars par an d'ici la fin du siècle[52].
Menace climatique
L’océan contient 50 fois plus de carbone que l’atmosphère et il échange chaque année des quantités importantes de carbone avec cette dernière. Au cours des dernières décennies, l’océan a ralenti la vitesse du changement climatique anthropique en absorbant près de 30 % des émissions anthropiques de dioxyde de carbone. Alors que cette absorption de carbone anthropique est le résultat de processus physico-chimiques, la biologie marine joue un rôle clé dans le cycle du carbone naturel en séquestrant de grandes quantités de carbone dans les eaux de l’océan profond. Des modifications de ces processus physiques, chimiques ou biologiques, pourraient conduire à des rétroactions dans le système climatique et ainsi accélérer ou ralentir le changement climatique en cours. Ces rétroactions entre le climat, l’océan et ses écosystèmes ont besoin d’être mieux comprises afin de pouvoir prédire de façon plus solide l’évolution des caractéristiques de l’océan du futur, et l’évolution combinée du CO2 atmosphérique et du climat[53].
L'acidification des eaux dégrade aussi le puits de carbone océanique planétaire, déjà malmené par la réduction de la couche d'ozone et la pollution de l'eau et la surpêche[50].
Perturbations graves du comportement de certains poissons
Dans les années 2000, sur la base de diverses expériences en laboratoire ou in situ, on a compris que les odeurs portées par l'eau peuvent jouer un rôle important pour les larves et les juvéniles[54] de poissons de récifs qui les utilisent pour s'orienter[55], détecter et éviter des prédateurs[56] ou trouver des zones favorables à leur survie et future croissance ; l'odeur du récif fait que les larves ne se laissent pas emporter vers la pleine mer[57]. Les larves de poissons récifaux, dès leur éclosion, bien que ne mesurant que quelques millimètres disposent d'un système sensoriel efficace leur permettant de capter les odeurs en solution dans l'eau[58] - [59].
On a longtemps cru que les larves de poissons coralliens étaient emportées à grande distance et qu'elles pouvaient coloniser d'autres récifs, alors que leur récif natal pouvait être colonisé par des juvéniles nés ailleurs. Une étude basée sur le marquage de 10 millions d'embryons de Pomacentrus amboinensis (en) prélevés sur la grande barrière de corail et relâchés en mer a montré qu'au contraire les larves regagnent leur récif natal[60], probablement en reconnaissant sa signature biochimique et olfactive. La plupart des larves vont en réalité s'installer très près du lieu de leur naissance[61] - [62]. L'odorat a une importance vitale pour les larves des poissons coralliens étudiés ; il leur permet de détecter la présence d'autres poissons (dont prédateurs) dans le récifs[63], et expliquerait leur fidélité au récif, caractéristiques de nombreux poissons coralliens[64] ou à un individu d'une espèce symbiote (anémone pour l'amphiprion par exemple[65]).
En 2009, une étude montre que chez le poisson clown utilisé comme espèce modèle, les larves de poissons exposées à une acidification de l'eau perdent leur capacité à distinguer l'odeur des habitats coralliens qu'elles devraient rechercher pour atteindre l'état adulte ; pire, à un pH de 7,8 (qui sera celui des mers chaudes vers 2100 selon les études prospectives) elles sont alors fortement attirées par des stimuli olfactifs qui normalement les repoussent, et au-delà d'un pH 7,6, elles ne semblent plus percevoir aucun stimuli olfactif[66].
Des travaux plus récents effectués en laboratoire puis vérifiés in situ sur un récif du centre de la barrière de corail de Papouasie-Nouvelle-Guinée naturellement acidifié par un dégazage volcanique sous-marin permanent de CO2 ont montré qu'une eau acidifiée (comparable à celle qui baignera la plupart des récifs coralliens du monde entier dans 50 à 80 ans, selon les chercheurs) a un effet comportemental inattendu et très marqué sur certains poissons : ils ne fuient plus l’odeur de leur prédateur, et ils s’exposent anormalement, de manière suicidaire au risque d’être mangé[67] (très bien montré dans un documentaire australien diffusé sur Arte en 2014[31]). Les poissons carnivores semblent plus touchés par ce phénomènes que les poissons herbivores[9]. On ignore si c'est l'acidification ou l'effet du CO2 en tant que molécule sur le poisson qui est en cause.
Pour toutes ces raisons Munday & al (2010) estiment que la reconstitution des populations de poissons sur des zones récifales dégradées en cours de restauration sera de plus en plus difficile, voire menacée par l'acidification des océans[68] qui pourrait donc dégrader les capacités de résilience écologique des océans. Le fait qu'à 700 ppm de CO2, de nombreux poissons se montrent attirés par l'odeur de prédateurs et qu'à 850 ppm de CO2 ils perdent la capacité de sentir les prédateurs et que les larves exposées à concentration élevée de CO2 se montrent anormalement actives et imprudentes les expose à un risque accru d'être mangées (elles subissent une mortalité 5 à 9 fois supérieure à la normale et plus le taux de CO2 augmente, plus élevée est la mortalité par prédation). Sans odorat normal beaucoup de larves pourraient en outre ne pas trouver le récif ou le lieu du récif où elles devraient s'installer et se perdre et mourir en mer.
En 2011, une autre étude montre que l'audition du poisson clown (Amphiprion percula) est également dégradée (dès le stade juvénile) quand l'eau est acidifiée, ce qui perturbe par exemple leur capacité à se diriger vers le récif ou vers un lieu particulier[69].
En 2012, une étude conclut que la fonction de neurotransmission du système olfactif des poissons est affectée par l'acidification[70].
La réponse de prédateurs aux stimuli olfactifs issus de leurs proies favorites est également amoindrie par l'acidification, comme le montre une étude de 2015 sur des jeunes requins placés pendant cinq jours dans une eau normale ou bien enrichie en CO2 comme on pense que le sera l'eau des océans en 2050 ou 2100[71] - [72].
On ignore encore si ces comportements anormaux et nocifs pour les espèces qui les adoptent pourraient (et à quelle vitesse) disparaitre (via les mécanismes de la sélection naturelle).
Perturbation de l'écologie phytoplanctonique
L'acidification des océans entraîne un changement dans la composition des communautés phytoplanctoniques. L'absorption du dioxyde de carbone atmosphérique par l’océan forme un composé acide, l’acide carbonique (H2CO3 par la réaction entre l'eau et le dioxyde de carbone : CO2 + H2O → H2CO3[73]. Sous cette forme, le carbonate ne peut pas se lier au calcium empêchant donc la formation de coquille chez les espèces de phytoplancton calcifiantes[74].
La présence accrue d'ions H+ dans l'eau océanique acidifiée peut également causer la dissolution des coquilles déjà formées. Le carbonate est arraché du calcium puis se lie à un ion H+ laissant donc la coquille structurellement affaiblie.
L'acidification des océans entraîne une diminution du diamètre des cellules et l'augmentation du taux de croissance chez le coccolithophore E. huxleyi[75]. Chez d'autres espèces de coccolithophore et autres phytoplanctons à coquilles, il est possible d'observer une diminution de la calcification ainsi que la dissolution des coquilles. Une autre étude a aussi démontré qu'il existe une possible diminution de la biomasse et de la productivité des phytoplanctons aux basses et aux moyennes latitude due à une augmentation de la concentration du dioxyde de carbone à la surface des océans. Ceci peut être expliqué par une hausse de la température à la surface de l'océan, ce qui cause une augmentation de la stratification thermique de ses couches supérieures, et provoque une réduction dans le mélange vertical des nutriments aux eaux de surface, ce qui freine le taux de photosynthèse[76].
Les espèces de phytoplanctons non calcifiantes tel que les cyanobactéries et les algues vertes sont affectés différemment par l’acidification. Certaines espèces semblent bénéficier du bouleversement pour différentes raisons. Entre autres, un milieu plus acide aurait pour effet d'augmenter la disponibilité de certains nutriments ainsi que de réduire la compétition interspécifique en réduisant le nombre d'espèces dans un écosystème donné (perte des espèces calcifiantes). Cela cause la croissance exponentielle de certaines espèces de microalgues et conséquemment l'eutrophisation des plans d’eau affectés[77].
Les conséquences liées à la perte de diversité et de biomasse des populations de phytoplancton sont encore peu connues ; toutefois, il est connu que le phytoplancton est à la base du réseau trophique océanique et que ces organismes sont responsables de presque 50 % de la productivité primaire globale[78].
Recherche
L'Allemagne a lancé le un programme national de recherche sur l'acidification des océans (BIOACID[79] pour « biological impacts of ocean acidification ») avec 8,5 millions d'euros sur 3 ans (dont 2,5 millions pour le Leibniz-Institut für Meereswissenschaften de Kiel qui coordonne le programme) apportés par le Ministère fédéral de l'enseignement et de la recherche (BMBF). Dès 2009, plus de 100 chercheurs (biologistes, chimistes, physiciens, paléontologues, mathématiciens, etc.) venant de 14 instituts y contribueront, ainsi qu'une entreprise en pointe dans la technologie des capteurs. Le programme portera sur la mer du Nord et la Baltique, ainsi que sur des zones polaires ou tropicales particulièrement vulnérables à l'acidification.
Des partenariats avec d'autres pays sont prévus, dont avec les scientifiques anglais du programme de recherche sur l'acidification des mers (« UKOA ») lancé en 2010[80], les États-Unis et l'Union européenne (don avec le programme « EPOCA »). Selon ses initiateurs, c'est le premier programme de cette importance dans le monde[81].
Une des difficultés est de mieux comprendre les effets synergiques qui existent entre l'acidification, la montée en température, les zones d'anoxies et d'autres modifications anthropiques des milieux, qui pourraient aggraver et/ou accélérer les changements globaux[82].
Des recherches sur les impacts de cette acidification montrent que plus le taux d'acidification est important, plus les espèces ayant des coquilles (plancton microscopique à la base de la chaîne alimentaire, coquillages, mollusques ou coraux) ont des difficultés à les fabriquer[83]. L'acidification modifie également le comportement des poissons, concernant la capacité à rechercher des proies ou à échapper un prédateur, et des recherches se poursuivent afin d'en connaître la raison[84].
Cartographie de l'acidification des océans
Le nord de l'océan Indien est devenu au moins 10 % plus acide que les océans Atlantique et Pacifique, en raison de sa configuration géographique. L'océan Indien est en effet séparé de l'océan Arctique, et la chimie du nord de son bassin est influencée par les rivières qui drainent l'important continent eurasien, ainsi que par les pluies de mousson.
Le pH des océans varie davantage dans les eaux froides de Sibérie, d'Alaska, du Pacifique Nord-Ouest et de l'Antarctique. Au printemps et en été, les impressionnants blooms planctoniques absorbent une partie du CO2 présent dans l'eau, faisant diminuer l'acidité. Au contraire, en hiver, l'acidité augmente à cause des remontées d'eaux riches en CO2 des profondeurs océaniques.
Acidification de la mer Méditerranée
Une étude publiée en , dirigée par des chercheurs du LSCE, indique qu'entre 1800 et 2001, la Méditerranée a absorbé entre 1 et 1,7 Gt de carbone (milliard de tonnes) d'origine anthropique.
Cela a engendré une diminution du pH de 0,08 unité en moyenne, soit une augmentation de l’acidité de 20 %. Cette variation est similaire à l'évolution des océans ouverts, bien que l’absorption de CO2 anthropique par la Méditerranée y soit plus intense. Le taux d'acidification des eaux de fond de la Méditerranée est par contre plus élevé que celui des océans profonds, à cause de leur renouvellement rapide, comme dans le Golfe du Lion.
L’étude d’une zone proche du Vésuve, en Méditerranée, soumise à un pH comparable à celui attendu pour 2100 montre une baisse de 70 % de la biodiversité des organismes calcaires, explique M. Gattuso. Et une chute de quelque 30 % de la diversité des autres organismes[34].
Illustrations scientifiques
 pH de l'eau de surface (années 1990)
pH de l'eau de surface (années 1990)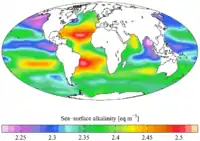 Alcalinité contemporaine
Alcalinité contemporaine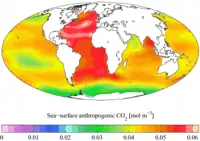 pression anthropique liée au CO2 (années 1990)
pression anthropique liée au CO2 (années 1990) Inventaire vertical CO2 (années 1990)
Inventaire vertical CO2 (années 1990) Carbone inorganique total contemporain
Carbone inorganique total contemporain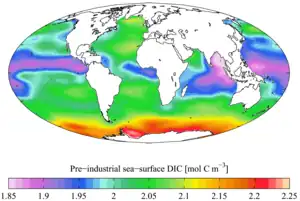 Carbone inorganique total préindustriel
Carbone inorganique total préindustriel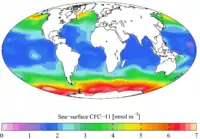 CFC-11 (contemporain)
CFC-11 (contemporain)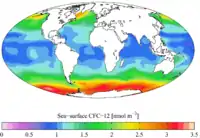 CFC-12 (contemporain)
CFC-12 (contemporain)
Notes et références
Notes
- Il est à noter qu'en théorie ce sont bien principalement les émissions de CO2 qui sont en cause, ou les apports accélérés d'eau douce, et à titre nettement moindre le réchauffement climatique : selon The State of Greenhouse Gases in the Atmosphere Based on Global Observations through 2013 selon l'OMM en 2014 (voir page 4), l'effet du réchauffement sur la vitesse et l'importance de l'acidification représente un peu moins de 10 % de celui de l'augmentation du taux de CO2, et d'importants apports d’eau douce et froide issus de la fonte des glaces pourraient accélérer et aggraver l'acidification et ses effets écologiques et climatiques
Références
- (en) Jens Terhaar, Thomas L. Frölicher et Fortunat Joos, « Ocean acidification in emission-driven temperature stabilization scenarios: the role of TCRE and non-CO2 greenhouse gases », Environmental Research Letters, vol. 18, no 2, , p. 024033 (ISSN 1748-9326, DOI 10.1088/1748-9326/acaf91, lire en ligne)
- Richard A. Feely et Scott C. Doney, « Ocean Acidification: The Other CO2 Problem », Limnology and Oceanography e-Lectures, (ISSN 2157-2933, DOI 10.4319/lol.2011.rfeely_sdoney.5, lire en ligne, consulté le ).
- (en) Ken Caldeira, « Ocean model predictions of chemistry changes from carbon dioxide emissions to the atmosphere and ocean », Journal of Geophysical Research, vol. 110, no C9, (ISSN 0148-0227, DOI 10.1029/2004jc002671, lire en ligne, consulté le ).
- Munday PL, Jones GP, Pratchett MS, Williams AJ (2008) Climate change and the future for coral reef fishes. Fish Fish 9:261–285.
- Leclercq N, Gattuso J-P, Jaubert J (2002) Primary production, respiration, and calcification of a coral reef mesocosm under increased CO2 partial pressure. Limnol Oceanogr 47:558–564.
- he State of Greenhouse Gases in the Atmosphere Based on Global Observations through 2013, consulté 2014-09-11, voire notamment le chapitre “Ocean acidification”, page 4.
- (en) A.B.C. News, « Video Acid Threatens Ocean Life » [vidéo], sur ABC News (consulté le ).
- « planetoscope.com », sur planetoscope.
- Marielle Court (2014) Brève : L'acidité de l'eau déboussole les poissons Le Figaro, 17/04/2014
- Gordon W. Holtgrieve & al (2011) “A Coherent Signature of Anthropogenic Nitrogen Deposition to Remote Watersheds of the Northern Hemisphere” Science Magazine 16 décembre 2011: 1545-1548 (résumé).
- Tyler Cyronak1, Kai G. Schulz & Paul L. Jokiel (2015) The Omega myth : what really drives lower calcification rates in an acidifying ocean Oxford Journals ; Science & Mathematics ; ICES Journal of Marine Science ; Vol73, n°3 Pp. 558-562. publié en ligne le 21 mai 2015
- George G. Waldbusser, Burke Hales & Brian A. Haley (2016), Calcium carbonate saturation state: on myths and this or that stories ; ICES J. Mar. Sci. (Fev/Mars 2016) 73 (3): 563-568. doi: 10.1093/icesjms/fsv174, mis en ligne le 13 décembre 2015 (résumé)
- Doney, S. C., Mahowald, N., Lima, I., Feely, R. A., Mackenzie, F. T., Lamarque, J. F., & Rasch, P. J. (2007). Impact of anthropogenic atmospheric nitrogen and sulfur deposition on ocean acidification and the inorganic carbon system. Proceedings of the National Academy of Sciences, 104(37), 14580-14585.
- Tae-Wook Kim1, Kitack Lee, Raymond G. Najjar, Hee-Dong Jeong, Hae Jin Jeong(2011)Increasing N Abundance in the Northwestern Pacific Ocean Due to Atmospheric Nitrogen Deposition Science 334 (6055) 505-509, 28 Oct. 2011: Online September 22 2011 ; Vol. 334 no. 6055 p. 505-509 ; DOI: 10.1126/science.1206583
- Hutchins et al., 2007, Barcelos e Ramos et al., 2007
- Sellner, K. G. (1997) Physiology, ecology, and toxic properties of marine cyanobacteria blooms, Part 2: The ecology and oceanography of harmful algal blooms, Limnol. Oceanogr., 42, 1089-1104.
- J. Czerny, J. Barcelos e Ramos, and U. Riebesel (2009) Influence of elevated CO2 concentrations on cell division and nitrogen fixation rates in the bloom-forming cyanobacterium Nodularia spumigena ; Biogeosciences, 6, 1865–1875, 2009 www.biogeosciences.net/6/1865/2009/
- Hutchins et al., 2007
- Gruber, N., & Galloway, J. N. (2008). An Earth-system perspective of the global nitrogen cycle. Nature, 451(7176), 293-296.
- . Beman, J. M., Chow, C. E., King, A. L., Feng, Y., Fuhrman, J. A., Andersson, A., ... & Hutchins, D.A (2011) Global declines in oceanic nitrification rates as a consequence of ocean acidification, Proceedings of the National Academy of Sciences, 108(1), 208-213.
- Howarth, R. W., Billen, G., Swaney, D., Townsend, A., Jaworski, N., Lajtha, K., ... & Zhao-Liang, Z. (1996) Regional nitrogen budgets and riverine N & P fluxes for the drainages to the North Atlantic Ocean: Natural and human influences. In Nitrogen cycling in the North Atlantic Ocean and its watersheds (p. 75-139). Springer Netherlands.
- Kintisch E (2017), How do you save a sick coral reef? Pop an antacid ; Chemistry Oceanography Plants & Animals DOI: 10.1126/science.aan6922 24 février 2016
- (en) Ryan Cross, « Corals can still grow their ‘bones' in acid waters : New finding reveals how corals build their skeletons », sur www.science.org, (consulté le ).
- Stanislas Von Euw, Qihong Zhang, Viacheslav Manichev, Nagarajan Murali, Juliane Gross, Leonard C. Feldman, Torgny Gustafsson, Carol Flach, Richard Mendelsohn, Paul G. Falkowski (2017), Biological control of aragonite formation in stony corals ; Science, 02 Jun 2017: Vol. 356, Issue 6341, p. 933-938 DOI: 10.1126/science.aam6371 (résumé)
- (en) Rebecca Albright, Lilian, Jessica Hosfelt, Lester Kwiatkowski, Jana K. Maclaren, Benjamin M. Mason, Yana Nebuchina, Aaron Ninokawa, Julia Pongratz, Katharine L. Ricke, Tanya Rivlin, Kenneth Schneider, Marine Sesboüé, Kathryn Shamberger, Jacob Silverman, Kennedy Wolfe, Kai Zhu et Ken Caldeira, « Reversal of ocean acidification enhances net coral reef calcification », Nature, vol. 531, no 7594, , p. 362–365 (ISSN 1476-4687, DOI 10.1038/nature17155, résumé).
- Australian Institute of Marine Science (en) et Australian Research Council Centre of Excellence for Coral Reef Studies (James Cook University)
- (en) Janice M. Lough, « Coral reefs: Turning back time », Nature, vol. 531, no 7594, , p. 314–315 (ISSN 1476-4687, PMID 26909580, DOI 10.1038/nature17302, résumé).
- « L'acidification des océans aura des conséquences préoccupantes sur les espèces marines », Gentside Découverte, (lire en ligne, consulté le )
- (en) James C. Orr, Victoria J. Fabry, Olivier Aumont, Laurent Bopp, Scott C. Doney, Richard A. Feely, Anand Gnanadesikan, Nicolas Gruber, Akio Ishida, Fortunat Joos, Robert M Key, Keith Lindsay, Ernst Maier-Reimer, Richard Matear, Patrick Monfray, Anne Mouchet, Raymond G. Najjar, Gian-Kasper Plattner, Keith B. Rodgers, Christopher L. Sabine, Jorge L. Sarmiento, Reiner Schlitzer, Richard D. Slater, Ian J. Totterdell, Marie-France Weirig, Yasuhiro Yamanaka et Andrew Yool, « Anthropogenic ocean acidification over the twenty-first century and its impact on calcifying organisms », Nature, vol. 437, no 7059, , p. 681–686 (ISSN 1476-4687, PMID 16193043, DOI 10.1038/nature04095, lire en ligne, consulté le ).
- « Les conditions océaniques & le squelette des coraux », sur Coral Guardian, (consulté le ).
- Arte 2014 Quand les océans deviennent acides, reportage australien (52 min), 1re diffusion : 04 avril à 22h20
- (en) Taryn Foster, James L. Falter, Malcolm T. McCulloch et Peta L. Clode, « Ocean acidification causes structural deformities in juvenile coral skeletons », Science Advances, vol. 2, no 2, , e1501130 (ISSN 2375-2548, PMID 26989776, PMCID PMC4788479, DOI 10.1126/sciadv.1501130, résumé).
- (en) Peta Clode et Taryn Foster, « Ocean acidification causes young corals to develop deformed skeletons », sur The Conversation (consulté le ).
- Stéphane Foucart, « L’acidification des océans aura d’importantes conséquences pour la biodiversité », Le Monde.fr, (ISSN 1950-6244, lire en ligne, consulté le )
- « Les coquilles des organismes marins perdent en calcification », sur Radio France internationale
- « Synthèse scientifique des impacts de l'acidification des océans sur la biodiversité marine », sur cbd.int
- « Changement climatique : causes, effets et enjeux », sur Ministères Écologie Énergie Territoires (consulté le ).
- (en) « Environmental Consequences of Ocean Acidification:A Threat to Food Security », sur unep.org
- « Acidification des océans : impact sur des organismes clés de la faune océanique », sur cnrs.fr
- Laperche D. (2014) Changement climatique : l'acidification des océans s'accélère ; Le rapport sur les effets de l'acidification des océans sur la biologie marine, présenté lors de la 12e réunion de la CDB en Corée, alerte sur la perte de biodiversité et ses impacts socio-économiques ; Actu-Environnement 08 octobre 2014
- (en) Lijing CHENG, « Record-Setting Ocean Warmth Continued in 2019 », sur Springer,
- Hoegh-Guldberg O & al. (2007) Coral reefs under rapid climate change and ocean acidification. Science 318:1737–1742.)
- leypas JA & al. (2006) Impacts of Ocean acidification on Coral Reefs and Other Marine Calcifiers: A Guide for Future Research (NOAA/Pacific Marine Environmental Laboratory, Seattle))
- Fabry VJ, Seibel BA, Feely RA, Orr JC (2008) Impacts of ocean acidification on marine fauna and ecosystem processes. ICES J Mar Sci 65:414–432. Abstract/FREE Full Text
- Sanford E, Gaylord B, Hettinger A, Lenz EA, Meyer k & Hill TM (2014) Ocean acidification increases the vulnerability of native oysters to predation by invasive snails Proc R Soc B 2014 281 (1778) 20132681
- Michaelidis B, Ouzounis C, Paleras A, Pörtner HO (2005) Effects of long-term moderate hypercapnia on acid-base balance and growth rate in marine mussels Mytilus galloprovincialis. Mar Ecol Prog Ser 293:109–118.
- Havenhand JN, Buttler F-R, Thorndyke MC, Williamson JE (2008) Near-future levels of ocean acidification reduce fertilization success in a sea urchin. Curr Biol 18:R651–R652.
- Third Symposium on the Ocean in a High-CO2 World Ocean Acidification
- Valéry Laramée de Tannenberg (2013)Pourquoi il faut lutter contre l’acidification des océans, in Le journal de l'environnement, daté 15 novembre 2013, consulté 17 novembre 2013
- IGBP ; international Geosphere Biosphere Program (2013), Présentation de [Ocean Acidification Summary for Policymakers] ; résumé pour les décideurs (IGBP, IOC, SCOR (2013). Ocean Acidification Summary for Policymakers – Third Symposium on the Ocean in a High-CO2 World. International Geosphere-Biosphere Programme, Stockholm, Sweden) (PDF, 26 pages, 2013, en anglais), et Infographie haute définition sur l'évolution du pH marin (JPG, 4.7mb) et de l'Aragonite (JPG, 4.4mb)
- (en) « Acid Threatens Ocean Life », sur ABCNews
- « Changement climatique : l'acidification des océans s'accélère », Actu-Environnement, (lire en ligne, consulté le )
- « 30 fiches scientifiques Océan et Climat », sur Ocean & Climate Platform (consulté le ).
- Arvedlund M, Takemura A (2006) The importance of chemical environmental cues for juvenile Lethrinus nebulosus Forsskal (Lethrinidae, Teleostei) when settling into their first benthic habitat. J Exp Mar Biol Ecol 338:112–122.
- Dixson DL & al. (2008) Coral reef fish smell leaves to find island homes. Proc R Soc London Ser B 275:2831–2839.
- Atema J, Kingsford MJ, Gerlach G (2002) Larval reef fish could use odour for detection, retention and orientation to reefs. Mar Ecol Progr Ser 241:151–160
- Gerlach G, Atema J, Kingsford MJ, Black KP, Miller-Sims V (2007) Smelling home can prevent dispersal of reef fish larvae. Proc Natl Acad Sci 104:858–863 (résumé).
- Arvedlund M, Munday PL, Takemura A (2007) The morphology and ultrastructure of the peripheral olfactory organ in newly metamorphosed coral-dwelling gobies, Paragobiodon xanthosomus Bleeker (Gobiidae, Teleostei) Tissue Cell 39:335–342
- Lara MR (2008) Development of the nasal olfactory organs in the larvae, settlement-stages and some adults of 14 species of Caribbean reef fishes (Labridae, Scaridae, Pomacentridae) Mar Biol 154:51–64
- Jones GP, Milicich MJ, Emslie MJ, Lunow C (1999) Self-recruitment in a coral reef fish population. Nature 402:802–804 (résumé)
- Jones GP, Planes S, Thorrold SR (2005) Coral reef fish larvae settle close to home. Curr Biol 15:1314–1318
- Swearer SE, Caselle JE, Lea DW, Warner RR (1999) Larval retention and recruitment in an island population of a coral-reef fish. Nature 402:799–802.
- Sweatman HPA (1988) Field evidence that settling coral reef fish larvae detect resident fishes using dissolved chemical cues. J Exp Mar Biol Ecol 124:163–174.
- Døving KB, Stabell OB, Östlund-Nilsson S, Fisher R (2006) Site fidelity and homing in tropical coral reef cardinalfish : Are they using olfactory cues ? Chem Senses 31:265–272
- Arvedlund M, McCormick MI, Fautin DG, Bildsoe M (1999) Host recognition and possible imprinting in the anemonefish Amphiprion melanopus (Pisces : Pomacentridae) Mar Ecol Prog Ser
- Munday PL, Dixson DL, Donelson JM, Jones GP, Pratchett MS, Devitsina GV & Døving KB (2009) Ocean acidification impairs olfactory discrimination and homing ability of a marine fish. Proceedings of the National Academy of Sciences, 106(6), 1848-1852.
- TV5 Les poissons perdent leur instinct de survie quand les océans s’acidifient, brève mis en ligne le 14/4/2014 dans la rubrique "Actualités" (Coraux, Gaz à effet de serre, Océans)"
- Munday PL, Dixson DL, McCormick MI, Meekan M, Ferrari MC & Chivers DP (2010) Replenishment of fish populations is threatened by ocean acidification Proceedings of the National Academy of Sciences, 107(29), 12930-12934.
- Simpson SD & et al. Ocean acidification erodes crucial auditory behaviour in a marine fish. Biol. Lett. 7, 917-920 (2011).
- Nilsson, G. E., Dixson, D. L., Domenici, P., McCormick, M. I., Sørensen, C., Watson, S. A., & Munday, P. L. (2012) Near-future carbon dioxide levels alter fish behaviour by interfering with neurotransmitter function. Nature Climate Change, 2(3), 201-204
- Danielle L. Dixson, « Poissons sous acide », Pour la science, no 478, , p. 62-68.
- (en) Danielle L. Dixson, Ashley R. Jennings, Jelle Atema et Philip L. Munday, « Odor tracking in sharks is reduced under future ocean acidification », Global Change Biology, vol. 21, no 4, , p. 1454-1462 (DOI 10.1111/gcb.12678).
- Individual and interactive effects of ocean acidification, global warming, and UV radiation on phytoplankton, Kunshan Gao, Yong Zhang, Donat-P Hader
- Beaufort, L., et al. « Sensitivity of Coccolithophores to Carbonate Chemistry and Ocean Acidification », Nature News, Nature Publishing Group, 3 aout 2011, www.nature.com/articles/nature10295.
- Long-term dynamics of adaptive evolution in a globally important phytoplankton species to ocean acidification Lothar Schlüter, Kai T. Lohbeck, Joachim P. Gröger, Ulf Riebesell, Thorsten B. H., aquatic ecology
- (Behrenfeld et al., 2006) Behrenfeld, M. J., O'Malley, R. T., Siegel, D. A., McClain, C. R., Sarmiento, J. L., Feldman, G. C., … Boss, E. S. (2006). Climate-driven trends in contemporary ocean productivity. Nature, 444(7120), 752–755. https://doi.org/10.1038/nature05317
- Nature News, CO2 Science, « Ocean Acidification Database », 2015. http://www.co2science.org/data/acidification/results.php. See also http://www.co2science.org/ subject/o/subject_o.php.
- Living in a high CO world: impacts of global climate change on marine phytoplankton, John Beardalla, Slobodanka Stojkovica and Stuart Larsena
- (en) À propos du Programme BIOACID, sur le site ifm-geomar.de
- UK Ocean Acidification Research Programme
- Brève 60383, d'après le communiqué de presse de l'Institut Leibniz de sciences marines de Kiel du 2009/09/01
- Pörtner HO, Langenbuch M, Michaelidis B (2005) Synergistic effects of temperature extremes, hypoxia, and increases in CO2 on marine animals: From Earth history to global change. J Geophys Res 110:C09S10.
- (en) Jason M. Hall-Spencer et al, « Volcanic carbon dioxide vents show ecosystem effects of ocean acidification », Nature (revue), vol. 454, no 7200, , p. 96-99
- Danielle L. Dixson, « Poissons sous acide », Pour la Science, no 478, , p. 62-69
Voir aussi
Bibliographie
- Harley CDG & al. (2006) The impacts of climate change in coastal marine systems. Ecol Lett 9:228–241.
Filmographie
- Film pédagogique de l'INRA sur l'histoire de la prise de conscience du phénomène des pluies acides et de leurs conséquences, sur le site inra.fr
- [vidéo] Laurence Jourdan et Nicolas Koutsikas Documentaire "Tipping Point" 52 min sur l'acidification des océans, sur le site ebu.ch
Articles connexes
Liens externes
- Ressource relative à la santé :
- Notices dans des dictionnaires ou encyclopédies généralistes :
- Voir cette infographie pédagogique proposée par le CNRS-INSU : Pourquoi le changement climatique entraine l'acidification des océansRessource relative à la santé :

