Hypoxie chez les poissons
Les poissons sont exposés à de grandes variations de la concentration de l'oxygène dans leur environnement aquatique, que ce soit dans l'espace ou dans le temps. Des réponses comportementales, physiologiques et cellulaires variées leur permettent de maintenir l'homéostasie et les fonctions de leur organisme dans un environnement appauvri en oxygène (hypoxie environnementale). Le plus grand défi auquel ils sont confrontés dans ces conditions est de maintenir leur équilibre énergétique métabolique, car 95% de l'oxygène qu'ils consomment est utilisé pour la production d'ATP, l'énergie chimique de l'O2 étant libérée grâce à la chaîne de transport d'électrons à l'intérieur des mitochondries[1] - [2]. Leur survie en condition d'hypoxie nécessite donc une réponse coordonnée pour obtenir plus d'oxygène et contrer les conséquences métaboliques de la baisse de la production d'ATP au niveau des mitochondries. Cet article passe en revue les effets de l'hypoxie sur les poissons, de leur comportement jusqu'aux aspects génétiques.

Tolérance à l'hypoxie

On peut présenter de différentes manières la tolérance à l'hypoxie d'un poisson. Un paramètre couramment utilisé est la « tension critique d'O2 » (Pcrit), qui est la plus basse tension d'O2 de l'eau (PO2) à laquelle un poisson peut maintenir un taux de consommation d'O2 stable (MO2)[3]. On pense donc qu'un poisson avec une Pcrit plus faible est plus tolérant à l'hypoxie qu'un poisson avec une Pcrit plus élevée. Mais bien que Pcrit soit souvent utilisée pour représenter la tolérance à l'hypoxie, elle traduit plus rigoureusement la capacité à absorber l'O2 environnemental à des PO2 hypoxiques et n'intègre pas les contributions significatives de la glycolyse anaérobie et de la suppression métabolique à cette tolérance (voir ci-dessous). La Pcrit est néanmoins étroitement liée à la tolérance à l'hypoxie d'un poisson[4], en partie parce que certaines espèces privilégient l'utilisation du métabolisme aérobie par rapport au métabolisme anaérobie et à la suppression métabolique[5]. Elle reste donc un paramètre de tolérance à l'hypoxie largement utilisé[6].
La tolérance à l'hypoxie d'un poisson peut également être représentée par le temps qu'il peut passer à une PO2 hypoxique donnée avant de perdre son l'équilibre dorso-ventral (appelé temps avant LOE), ou par la PO2 à laquelle il perd l'équilibre lorsque la PO2 est réduite jusqu'à l'anoxie à une vitesse précise (appelée PO2-de-LOE). Une valeur supérieure du temps avant LOE ou inférieure du PO2-de-LOE impliquent donc une meilleure tolérance à l'hypoxie. Dans les deux cas, la LOE est une représentation plus holistique de la tolérance globale à l'hypoxie, car elle intègre tous les éléments de la tolérance à l'hypoxie, y compris le métabolisme aérobie, le métabolisme anaérobie et la suppression métabolique.
Détection de l'oxygène
Structures de détection de l'oxygène
Chez les mammifères, il existe plusieurs structures impliquées dans la détection de l'oxygène ; elles sont cependant, toutes conçues pour détecter l'hypoxie aortique ou interne puisque les mammifères se heurtent rarement à des hypoxies environnementales. Ces structures comprennent les cellules de type I du corpuscule carotidien[7], les corps neuroépithéliaux des poumons[8] ainsi que certains neurones centraux et périphériques et les cellules musculaires lisses des vaisseaux sanguins. Chez les poissons, les cellules neuroépithéliales (NEC) ont été identifiées comme les principales cellules de détection d'oxygène[9]. Des NEC ont été découvertes chez tous les poissons téléostéens étudiés à ce jour et elles constituent probablement une structure hautement conservée au sein de nombreux taxons de poissons. Ces NEC se trouvent dans les quatre arcs branchiaux au sein de plusieurs structures différentes, telles que le long des filaments, aux extrémités des branchiospines et entre les lamelles. Deux voies neuronales distinctes ont été identifiées dans les arcs branchiaux du poisson-zèbre, à la fois dans les voies motrices et les voies sensorielles des fibres nerveuses[10]. Étant donné que les cellules neuroépithéliales sont réparties dans les branchies, elles sont souvent idéalement situées pour détecter à la fois l'oxygène artériel et l'oxygène environnemental[11].
Mécanismes de libération des neurotransmetteurs dans les cellules neuroépithéliales
On pense que les cellules neuroépithéliales (NEC) sont des cellules chimioréceptrices de type neurone, car elles dépendent des modifications de leur potentiel membranaire pour libération de neurotransmetteurs et la transmission de signaux aux cellules voisines.
Une fois que les NEC des branchies du poisson-zèbre entrent en contact avec l'hypoxie environnementale ou aortique, un canal « de fuite » vers l'extérieur de l'ion potassium (K+) est inhibé. On ne sait pas encore comment ces canaux K+ sont inhibés par le manque d'oxygène, car on ne connait pas encore de sites de liaison directe pour le « manque d'oxygène », seulement les réponses des cellules entières et des canaux ioniques à l'hypoxie. Les canaux « de fuite » K+ sont des canaux ioniques à deux pores qui sont ouverts lorsque le potentiel de membrane de la cellule est à sa valeur de repos et qui jouent un rôle majeur dans l'établissement de l'équilibre de ce potentiel de repos[12]. Une fois ce canal « de fuite » fermé, le K+ ne peut plus s'écouler librement hors de la cellule, et le potentiel membranaire de la NEC augmente ; la cellule se dépolarise. Cette dépolarisation provoque l'ouverture des canaux Ca2+ et la concentration de Ca2+ augmente fortement dans la cellule. Une fois le Ca2+ à l'intérieur de la cellule, il se lie à la machinerie de libération des vésicules synaptiques et facilite la liaison du complexe t-snare des vésicules au complexe v-snare de la membrane cellulaire, ce qui initie la libération de neurotransmetteurs dans la fente synaptique.
Transduction du signal jusqu'aux centres supérieurs du cerveau
Si la cellule post-synaptique est un neurone sensoriel, alors un taux de décharge accru dans ce neurone transmettra le signal au système nerveux central. Si la cellule post-synaptique est au contraire une cellule pilier conjonctive ou une cellule musculaire lisse d'un vaisseau sanguin, la sérotonine provoquera la vasoconstriction de celui-ci et des lamelles branchiales jusque là inutilisées seront mobilisées par le recrutement de plus de lits capillaires, et la surface totale d'échange gazeux par lamelle sera augmentée[13].
Chez les poissons, le signal hypoxique est transporté jusqu'au cerveau par les nerfs glossopharyngien (nerf crânien IX) et vague (nerf crânien X). Le premier arc branchial est innervé par le nerf glossopharyngien (nerf crânien IX) et l'ensemble des quatre arcs par le nerf vague (nerf crânien X).
Emplacements des capteurs d'oxygène
Des études utilisant des organismes modèles mammifères ont débouché sur deux hypothèses principales pour l'emplacement de la détection de l'oxygène dans les cellules chimioréceptrices : l'hypothèse membranaire et l'hypothèse mitochondriale. L'hypothèse membranaire a été proposée pour le corpuscule carotidien chez la souris[14] ; elle prédit que la détection de l'oxygène est un processus initié par un déséquilibre ionique. L'hypothèse mitochondriale a également été proposée pour le corpuscule carotidien de la souris, mais elle repose sur les niveaux de phosphorylation oxydative et/ou de production de dérivés réactifs de l'oxygène (DRO) comme signal d'hypoxie. Plus précisément, les courants K+ sensibles à l'oxygène sont inhibés par le peroxyde d'hydrogène et l'activation de la NADPH oxydase[15].
Il existe des preuves pour ces deux hypothèses selon les espèces utilisées. Pour les cellules neuroépithéliales des branchies du poisson-zèbre, il existe des preuves solides soutenant « l'hypothèse membranaire » en raison de leur capacité à répondre à l'hypoxie après le retrait du contenu de la cellule. Cependant, il n'y a aucune preuve contre l'existence de plusieurs sites pour la détection de l'oxygène dans les organismes.
Réponses aiguës à l'hypoxie
De nombreux environnements hypoxiques n'atteignent jamais le niveau de l'anoxie et la plupart des poissons sont capables de faire face à ce stress en utilisant diverses stratégies physiologiques et comportementales. Les poissons qui utilisent des organes respiratoires aériens (ORA) ont tendance à vivre dans des environnements à teneur en oxygène très variable et dépendent de la respiration aérienne pendant les périodes où il n'y a pas assez d'oxygène pour respirer dans l'eau. Bien que tous les téléostéens aient une forme de vessie natatoire, beaucoup d'entre eux ne sont pas capables de respirer de l'air et dépendent de la respiration aquatique de surface, l'eau étant plus oxygénée près de sa surface. Cependant de nombreuses espèces de poissons téléostéens ne présentent aucun de ces comportements respiratoires de surface.
Typiquement, l'hypoxie aiguë provoque une hyperventilation, une bradycardie et une élévation de la résistance vasculaire des branchies (chez les téléostéens)[16]. Le bénéfice de ces changements de pression artérielle sur l'absorption d'oxygène n'a cependant pas été confirmé dans une étude récente sur la truite arc-en-ciel. Il est possible que la réponse d'hypoxie aiguë soit simplement une réponse au stress, et ses avantages découverts dans les études plus anciennes pourraient ne résulter que de l'acclimatation à l'environnement.
Réponses comportementales
L'hypoxie peut modifier le comportement normal[17]. Le comportement parental destiné à fournir de l'oxygène aux œufs est souvent affecté par l'hypoxie. Par exemple, le comportement de ventilation (nager sur place près des œufs pour créer un écoulement d'eau sur eux, et donc un apport constant d'oxygène) est souvent augmenté lorsque l'oxygène est moins disponible. Cela a été notamment rapporté chez les épinoches[18] - [19], les gobies[20] - [21] et les poissons-clowns[22]. Les gobies peuvent également augmenter la taille des ouvertures du nid qu'elles construisent, même si cela peut augmenter le risque de prédation sur les œufs[23] - [24]. Lors d'épisodes hypoxiques, Herotilapia multispinosa rapproche souvent ses jeunes alevins de la surface de l'eau, où l'oxygène est plus disponible[25].
Les adaptations comportementales destinées à survivre lorsque l'oxygène est rare comprennent la réduction des niveaux d'activité, la respiration aquatique de surface et la respiration aérienne.
Réduction des niveaux d'activité
À mesure que les niveaux d'oxygène diminuent, les poissons peuvent d'abord augmenter leurs mouvements pour tenter de s'échapper de la zone hypoxique, mais finalement ils réduisent considérablement leurs niveaux d'activité, réduisant ainsi leurs besoins énergétiques (et donc en oxygène). Le hareng présente exactement ce schéma[26]. Parmi les autres poissons qui réduisent leurs niveaux d'activité en cas d'hypoxie on trouve la sole commune[27], le guppy[28], la petite roussette[29] et la blennie vivipare[30]. Certains requins qui ventilent leurs branchies peuvent augmenter leur vitesse de nage en cas d'hypoxie, pour apporter plus d'eau aux branchies[31].
Respiration aquatique de surface

En réponse à la diminution du niveau d'oxygène dissous dans l'environnement, les poissons nagent jusqu'à la surface de la colonne d'eau et respirent à ce niveau, où elle contient plus d'oxygène dissous, un comportement appelé respiration aquatique de surface (RAS)[32]. L'oxygène se diffuse dans l'eau à partir de l'air et donc la couche supérieure d'eau en contact avec l'air contient plus d'oxygène. Ceci n'est vrai que dans les eaux stagnantes ; dans l'eau courante, toutes les couches sont mélangées et les niveaux d'oxygène sont les mêmes dans toute la colonne d'eau. La RAS a souvent lieu dans les mares résiduelles, en particulier la nuit[33]. Le retrait de la mer à marée basse signifie que l'eau ne s'y renouvelle pas, la concentration de poissons y épuise rapidement l'oxygène et l'absence de lumière la nuit signifie qu'il n'y a pas de photosynthèse pour reconstituer celui-ci. Les espèces de mares résiduelles qui pratiquent la RAS comprennent le chabot Oligocottus maculosus[34] - [35], l'épinoche à trois épines[36] et le choquemort[37] - [38].
Mais la respiration aquatique de surface n'est pas limitée à l'estran. La plupart des espèces de poissons tropicales et tempérées vivant dans les eaux stagnantes la pratiquent pendant l'hypoxie. Une étude a examiné 26 espèces représentant huit familles de poissons non respirants des grandes plaines d'Amérique du Nord et a constaté que toutes sauf quatre effectuaient la RAS en cas d'hypoxie[39]. Une autre étude a examiné 24 espèces de poissons tropicaux communs en aquariophilie, des tétras aux barbus en passant par les cichlidés, et a découvert que toutes effectuaient la RAS[40]. Une situation inhabituelle dans laquelle la RAS est effectuée est dans les lacs recouverts de glace en hiver, à l'interface entre l'eau et la glace ou à proximité de bulles d'air emprisonnées sous la glace[41] - [42] - [43].
Certaines espèces peuvent présenter des adaptations morphologiques, telles qu'une tête plate et une bouche tournée vers le haut, qui leur permettent d'effectuer la respiration aquatique de surface sans « casser » la surface de l'eau (ce qui les rendrait plus visibles pour les prédateurs aériens)[44]. Un exemple est le choquemort, dont la bouche tournée vers le haut suggère une alimentation en surface, mais dont les habitudes alimentaires ne se limitent pas particulièrement à la surface. Chez le tambaqui du bassin de l'Orénoque, l'exposition à l'hypoxie induit en quelques heures le développement de vaisseaux sanguins supplémentaires à l'intérieur de la lèvre inférieure, améliorant sa capacité à absorber l'oxygène pendant la RAS[45]. Nager à l'envers peut également aider les poissons à effectuer la RAS, comme chez certains poissons-chats[46].
Certaines espèces peuvent retenir une bulle d'air dans leur bouche pendant la RAS. Cela pourrait améliorer leur flottabilité et augmenter la teneur en oxygène de l'eau passant au-dessus de la bulle sur son chemin vers les branchies[47]. Une autre façon de réduire les coûts de flottabilité consiste à effectuer la RAS sur des roches ou des plantes fournissant un support près de la surface de l'eau.
La respiration aquatique de surface affecte de manière significative la survie des poissons en cas d'hypoxie sévère. Chez le molly Poecilia mexicana (en), par exemple, la survie était environ quatre fois plus élevée chez les individus capables d'effectuer la RAS que chez ceux qu'on avait empêché de le faire pendant leur exposition à une hypoxie extrême[48].
La respiration aquatique de surface peut être effectuée plus souvent lorsque le besoin en oxygène est plus élevé. Chez le molly voile, les femelles gestantes (cette espèce est vivipare) passent environ 50 % de leur temps en RAS, contre seulement 15 % chez les femelles non gestantes sous les mêmes niveaux d'oxygène faibles[49].
Respiration aérienne
La respiration aérienne consiste à « avaler » de l'air à la surface de l'eau pour extraire directement l'oxygène de l'atmosphère. La respiration aérienne a évolué chez les poissons qui ont été exposés à l'hypoxie la plus fréquente ; aussi les espèces qui s'engagent dans la respiration aérienne ont-elles tendance à être plus tolérantes à l'hypoxie que celles qui ne respirent pas pendant l'hypoxie[50].
Il existe deux principaux types de poissons à respiration aérienne : facultative et obligatoire. Dans des conditions d'oxygénation normale, les poissons à respiration aérienne facultative peuvent survivre sans avoir à respirer l'air à la surface de l'eau. Les poissons à respiration aérienne obligatoire doivent respirer à la surface même à des niveaux d'oxygène dissous normaux, car leurs branchies ne peuvent pas extraire suffisamment d'oxygène de l'eau.

De nombreux téléostéens d'eau douce respirant l'air utilisent des organes spécifiques pour extraire efficacement l'oxygène de l'air tout en maintenant les fonctions des branchies. Ces organes sont leur appareil digestif modifié, leur vessie natatoire et l'organe labyrinthique des Anabantoidei[51] ; ils sont hautement vascularisés et fournissent un moyen supplémentaire d'extraire l'oxygène de l'air[52]. Les poissons utilisent également ces organes pour stocker l'oxygène récupéré.
Risque de prédation associé à la RAS et à la respiration aérienne
La respiration aquatique de surface et la respiration aérienne nécessitent que les poissons se déplacent jusqu'au sommet de la colonne d'eau, comportement qui augmente les risques de prédation par les prédateurs aériens ou d'autres piscivores vivant près de la surface[52]. Face au risque accru de prédation lors de leur remontée à la surface, certains poissons effectuent la RAS ou la respiration aérienne en bancs[51] - [53] pour « diluer » le risque de prédation. Lorsque les poissons peuvent détecter visuellement la présence de leurs prédateurs aériens, ils s'abstiennent simplement de faire surface, ou préfèrent faire surface dans des zones où ils peuvent être détectés moins facilement (c.-à-d. zones d'eaux troubles et ombragées)[54].
Remodelage branchial en situation d'hypoxie
Le remodelage des branchies ne se produit que chez quelques espèces de poissons ; il implique l'accumulation ou l'élimination d'une masse cellulaire inter-lamellaire (MCIL). En réponse à l'hypoxie, certains poissons sont capables de remodeler leurs branchies pour augmenter leur surface respiratoire, certaines espèces comme le poisson rouge doublant leur surface lamellaire en seulement 8 heures[55]. L'augmentation de la surface respiratoire est un compromis aux coûts métaboliques accrus, car les branchies sont un site majeur pour de nombreux processus importants, notamment les échanges gazeux respiratoires, la régulation acido-basique, l'excrétion d'azote, l'osmorégulation, la régulation hormonale, le métabolisme et la détection environnementale[56].
Le carassin commun est une des espèces capables de remodeler ses filaments branchiaux en réponse à l'hypoxie. Leurs cellules interlamellaires ont des taux élevés d'activité mitotique qui sont influencés à la fois par l'hypoxie et par la température[57]. Par temps froid (15 °C) le carassin a plus de masse cellulaire inter-lamellaire, mais quand la température monte à 25 °C, cette MCIL est éliminée, tout comme elle le serait dans des conditions hypoxiques. La même transition de la morphologie des branchies se produit chez le poisson rouge lorsque la température passe de 7,5 °C à 15 °C[58]. Cette différence peut être due aux régimes de température dans lesquels ces poissons se trouvent généralement, ou il pourrait y avoir un mécanisme de protection sous-jacent pour empêcher une perte d'équilibre ionique dans des températures stressantes. La température affecte également la vitesse à laquelle les branchies peuvent être remodelées en hypoxie : par exemple, à 20 °C, le carassin peut éliminer complètement sa MCIL en 6 heures, alors qu'à 8 °C, le même processus prend 3 à 7 jours[57]. La MCIL est probablement éliminée par apoptose, mais il est possible que lorsque le poisson est confronté au double stress de l'hypoxie et de la haute température, les lamelles soient perdues par dégradation physique. En conditions d'oxygénation normale la couverture des lamelles branchiales peut protéger des espèces comme le carassin contre les parasites et les toxines environnementales en limitant leur surface de diffusion vers l'intérieur tout en maintenant le transport de l'oxygène grâce à son affinité extrêmement élevée de liaison avec l'hémoglobine[57].
La carpe Gymnocypris przewalskii (en), une espèce étroitement apparentée originaire du lac Qinghai, en haute altitude, est également capable de remodeler ses branchies en réponse à des conditions hypoxiques. En réponse à des niveaux d'oxygène 95% inférieurs aux conditions normales, l'apoptose de sa MCIL augmente la surface lamellaire jusqu'à 60% en seulement 24 heures[59]. Cela a cependant un coût important en termes d'osmorégulation, réduisant les niveaux de sodium et de chlorure dans le cytoplasme des cellules de plus de 10 %[59]. La réponse morphologique de cette carpe à l'hypoxie est le remodelage de la surface respiratoire le plus rapide rapporté chez les vertébrés à ce jour[60].
Absorption d'oxygène
Les poissons présentent un large éventail de tactiques pour contrer l'hypoxie aquatique, mais lorsqu'il ne leur est pas possible d'échapper au stress hypoxique, le maintien de l'extraction et de l'apport d'oxygène devient un élément essentiel de leur survie. À l'exception des poissons-antarctiques, la plupart d'entre eux utilisent l'hémoglobine (Hb) des globules rouges pour se lier chimiquement et fournir 95 % de l'oxygène extrait de l'environnement aux tissus fonctionnels. Le maintien de l'extraction et de l'apport d'oxygène aux tissus permet une activité continue sous stress hypoxique et est en partie déterminé par des modifications de deux paramètres sanguins différents : l'hématocrite et les propriétés de liaison de l'hémoglobine.
Hématocrite
En général, l'hématocrite est le nombre de globules rouges en circulation ; il est très variable selon les espèces de poissons. Les poissons actifs comme les marlins ont tendance à avoir des hématocrites plus élevés[61], alors que les poissons moins actifs comme la plie Platichthys stellatus présentent des hématocrites plus faibles[62].
L'hématocrite peut augmenter en réponse à une exposition à l'hypoxie à court terme (aiguë) ou à long terme (chronique), ce qui entraîne une augmentation de la quantité totale d'oxygène que le sang peut transporter, connue sous le nom de capacité de transport d'oxygène du sang[63]. Les modifications aiguës de l'hématocrite sont le résultat de la circulation des hormones de stress (catécholamines) activant les récepteurs de la rate qui provoquent la libération de globules rouges dans la circulation sanguine[64] Lors d'une exposition chronique à l'hypoxie, le mécanisme utilisé pour augmenter l'hématocrite est indépendant de la rate et résulte de la stimulation hormonale du rein par l'érythropoïétine (EPO). Une augmentation de l'hématocrite en réponse à l'érythropoïétine est observée après environ une semaine et est donc probablement sous le contrôle génétique des facteurs induits par l'hypoxie (HIF)[65].
Si l'augmentation de l'hématocrite signifie que le sang peut transporter une plus grande quantité totale d'oxygène, un avantage possible pendant l'hypoxie, l'augmentation du nombre de globules rouges dans le sang peut aussi entraîner certains inconvénients. Premièrement, un hématocrite plus élevé se traduit par un sang plus visqueux (en particulier dans l'eau froide), ce qui augmente la quantité d'énergie nécessaire au système cardiaque pour le pomper à travers le réseau vasculaire ; deuxièmement, selon temps de transit du sang à travers l'arc branchial et le taux de diffusion de l'oxygène, une augmentation de l'hématocrite peut entraîner un transfert moins efficace de l'oxygène de l'environnement vers le sang[61].
Modification de l'affinité de liaison de l'hémoglobine
Un mécanisme alternatif pour préserver l'apport d'O2 face à une faible teneur en oxygène ambiant consiste à augmenter l'affinité du sang pour celui-ci. La teneur en oxygène du sang est liée à la tension des gaz du sang (PaO2) et est illustrée à l'aide d'une courbe d'équilibre de l'oxygène (CEO). Les hémoglobines de poisson, à l'exception de celles des agnathes, sont des tétramères qui présentent une coopérativité de liaison à l'O2 et ont des CEO sigmoïdes.
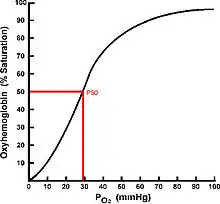
L'affinité de liaison de l'hémoglobine à l'oxygène est estimée à l'aide d'une mesure appelée P50 (la pression partielle d'oxygène à laquelle l'hémoglobine est liée à 50 % à l'oxygène) et peut être extrêmement variable[66]. Si l'hémoglobine d'un poisson a une faible affinité pour l'oxygène, elle a un P50 élevé et les environnements habitables pour celui-ci sont ceux dont la PO2 est relativement élevée. À l'inverse, les hémoglobines de poisson à faible P50 se lient fortement à l'oxygène et présentent un avantage évident dans les environnements hypoxiques ou à PO2 variable. L'utilisation d'hémoglobines de haute affinité (P50 faible) diminue les besoins ventilatoires (et donc énergétiques) face à une agression hypoxique[61]. L'affinité de liaison à l'oxygène de l'hémoglobine (Hb-O2) est régulée par une série de modulateurs allostériques (en) ; les principaux modulateurs utilisés pour contrôler l'affinité Hb-O2 en cas d'agression hypoxique sont :
- Augmentation du pH des globules rouges
- Réduction des interactions des phosphates inorganiques
pH et phosphates inorganiques (Pi)
Chez truite arc-en-ciel et divers autres téléostéens, l'augmentation du pH des globules rouges provient de l'activation de la protéine d'échange Na+/H+ (BNHE) sur la membrane des globules rouges par les catélcholamines circulantes[67]. Ce processus provoque l'augmentation du pH interne des globules rouges par la sortie des ions H+ et l'entrée des ions Na+. La conséquence nette de cette alcalinisation des globules rouges est une augmentation de l' affinité Hb-O2 par l'effet Bohr. L'afflux net d'ions Na+ et l'activation compensatoire des pompes sodium-potassium pour maintenir l'équilibre ionique à l'intérieur de ceux-ci entraîne une baisse constante de l'ATP cellulaire, qui sert également à augmenter l'affinité Hb-O2[68]. Résultat supplémentaire du mouvement des ions Na+, la concentration osmotique des globules rouges augmente, ce qui provoque un afflux osmotique d'eau et le gonflement des cellules. La dilution du contenu de la cellule provoque en outre la séparation spatiale de l'hémoglobine et des phosphates inorganiques et augmente encore l'affinité Hb-O2.[61].
Les espèces de la famille des Tripterygiidae, tolérantes à l'hypoxie intertidale, semblent tirer parti de l'acidose intracellulaire et « contourner » la phosphorylation oxydative traditionnelle ; elles pilotent directement la synthèse d'ATP mitochondrial en utilisant la réserve cytosolique de protons qui se constitue probablement en situation d'hypoxie (par acidose lactique et hydrolyse de l'ATP)[69].
Modification des isoformes de l'hémoglobine
Presque tous les animaux ont plus d'un type d'hémoglobine dans leurs globules rouges. Les isoformes multiples de l'hémoglobine sont particulièrement courantes chez les ectothermes, mais surtout chez les poissons qui doivent faire face à la fois aux fluctuations de température et de la disponibilité en oxygène. L'hémoglobine de l'anguille d'Europe peut être séparée en isoformes anodiques et cathodiques. Les isoformes anodiques ont de faibles affinités pour l'oxygène (P50 élevé) et des effets Bohr marqués, tandis que les isoformes cathodiques manquent d'effets de pH significatifs et sont donc supposées conférer une tolérance à l'hypoxie[70]. Plusieurs espèces de cichlidés africains élevés à un stade précoce de développement dans des conditions hypoxiques ou normoxiques ont été comparées du point de vue de leurs isoformes d'hémoglobines. Cette étude a démontré qu'il existait des isoformes spécifiques aux individus hypoxiques[71].
Défi métabolique
Pour faire face à la diminution de la production d'ATP par la chaîne de transport d'électrons, les poissons doivent activer des moyens anaérobies de production d'énergie (métabolisme anaérobie) tout en supprimant certaines demandes métaboliques. La capacité de diminuer la demande d'énergie par suppression métabolique est essentielle pour assurer la survie hypoxique en raison de l'efficacité réduite de la production anaérobie d'ATP.
Passage du métabolisme aérobie au métabolisme anaérobie
La respiration aérobie, dans laquelle l'oxygène est utilisé comme accepteur terminal d'électrons, est cruciale pour tous les poissons à respiration aquatique. Lorsque ces poissons sont privés d'oxygène, ils ont besoin d'autres moyens pour produire de l'ATP. Un passage du métabolisme aérobie au métabolisme anaérobie se produit donc au début de l'hypoxie. La glycolyse et la phosphorylation au niveau du substrat sont utilisées comme voies alternatives pour la production d'ATP[72].
Ces voies sont cependant beaucoup moins efficaces que le métabolisme aérobie. Pour le même substrat, le rendement total d'ATP dans le métabolisme anaérobie est 15 fois plus faible que dans le métabolisme aérobie. Ce niveau de production d'ATP n'est pas suffisant pour maintenir un taux métabolique élevé : la seule stratégie de survie pour les poissons est donc de modifier leurs demandes métaboliques.
Suppression métabolique
La suppression métabolique est la réduction régulée et réversible du taux métabolique en dessous du taux métabolique de base (appelé taux métabolique standard chez les animaux ectothermes)[1]. Cela réduit le taux d'utilisation d'ATP du poisson, ce qui prolonge sa survie à des PO2 sévèrement hypoxiques (inférieures à Pcrit) en réduisant le taux d'utilisation de ses réserves de carburant anaérobie (glycogène). La suppression métabolique réduit également le taux d'accumulation des produits finaux anaérobies délétères (acide lactique et protons), ce qui retarde leur impact négatif sur les poissons.
Les mécanismes utilisés par les poissons pour réduire leur taux métabolique sont d'ordres comportementaux, physiologiques et biochimiques. Sur le plan comportemental, le taux métabolique peut être abaissé par une réduction de la locomotion, de l'alimentation, de la parade nuptiale et de l'accouplement[73] - [74] - [75]. Physiologiquement, le taux métabolique peut être abaissé par une diminution de la croissance, de la digestion, du développement des gonades et des efforts de ventilation[76] - [77]. Biochimiquement, le taux métabolique peut être encore abaissé en dessous du taux métabolique standard en réduisant la gluconéogenèse, les taux de synthèse et de dégradation des protéines et le pompage ionique à travers les membranes cellulaires[78] - [79] - [80]. Ces réductions de processus abaissent les taux d'utilisation d'ATP, mais il reste difficile de savoir si la suppression métabolique est induite par une réduction initiale de l'utilisation d'ATP ou de l'apport d'ATP.
La prévalence de l'utilisation de la suppression métabolique chez les espèces de poissons n'a pas été explorée en profondeur. Cela s'explique en partie par le fait que les taux métaboliques des poissons exposés à l'hypoxie, y compris les taux métaboliques supprimés, ne peuvent être mesurés avec précision qu'en utilisant la calorimétrie directe, technique rarement utilisée pour les poissons[81] - [82]. Les quelques études qui ont utilisé la calorimétrie révèlent que certaines espèces de poissons utilisent la suppression métabolique dans l'hypoxie/anoxie (par exemple, le poisson rouge, le tilapia et l'anguille d'Europe) tandis que d'autres ne le font pas (par exemple, la truite arc-en-ciel et le poisson-zèbre)[83] - [84] - [85] - [86] - [1]. Les espèces qui utilisent la suppression métabolique sont plus tolérantes à l'hypoxie que les autres, ce qui suggère que cette suppression métabolique améliore la tolérance à l'hypoxie. En accord avec cela, les différences de tolérance à l'hypoxie parmi des populations isolées d'épinoches à trois épines semblent résulter de différences dans l'utilisation de la suppression métabolique, l'épinoche la plus tolérante utilisant effectivement la suppression métabolique[87].
Les poissons capables de suppression métabolique induite par l'hypoxie réduisent leurs taux métaboliques de 30 à 80 % par rapport aux taux métaboliques standard[88] - [83] - [84] - [85]. Il ne s'agit pas d'un arrêt complet du taux métabolique et la suppression métabolique ne peut donc que prolonger la survie hypoxique, pas la maintenir indéfiniment. Si l'exposition hypoxique dure trop longtemps, le poisson succombe à l'épuisement de ses réserves de glycogène et/ou à la suraccumulation de produits finaux anaérobies délétères. De plus, la portée énergétique sévèrement limitée qui accompagne un état métaboliquement supprimé signifie que le poisson est incapable d'accomplir des tâches critiques telles que l'évitement des prédateurs et la reproduction. Peut-être pour ces raisons, les poissons rouges privilégient leur utilisation du métabolisme aérobie dans la plupart des environnements hypoxiques, réservant la suppression métabolique au cas extrême de l'anoxie[85].
Conservation de l'énergie
En plus d'une réduction du taux de synthèse des protéines, il semble que certaines espèces de poissons tolérants à l'hypoxie conservent de l'énergie grâce à l'arrêt des canaux ioniques supposé par P.W. Hochachka. Cette hypothèse fait deux prédictions :
- Les animaux tolérants à l'hypoxie ont naturellement de faibles perméabilités membranaires
- La perméabilité membranaire diminue encore plus en conditions hypoxiques (arrêt des canaux ioniques)[89]
La première prédiction est vraie. Lorsqu'on a comparé la perméabilité aux ions Na+ et K+ des membranes des reptiles et des mammifères, les membranes des reptiles se sont révélées cinq fois moins perméables[90]. La deuxième prédiction a été plus difficile à prouver expérimentalement, cependant, des mesures indirectes ont montré une diminution de l'activité Na+/K+-ATPase dans les hépatocytes d'anguille et de truite en conditions hypoxiques[91] - [92]. Ces résultats semblent être spécifiques aux tissus, car les carassins exposés à l'hypoxie ne subissent pas de réduction de l'activité Na+/K+-ATPase dans leur cerveau[93]. Bien que les preuves soient limitées, l'arrêt des canaux ioniques permet aux organismes de maintenir les gradients de concentration des canaux ioniques et les potentiels membranaires sans consommer de grandes quantités d'ATP.
Augmentation des stocks de glycogène
Le facteur limitant pour les poissons souffrant d'hypoxie est la disponibilité d'un substrat fermentescible pour le métabolisme anaérobie ; une fois le substrat épuisé, la production d'ATP cesse. Le glycogène endogène est présent dans les tissus en tant que molécule de stockage d'énergie à long terme. Il peut être converti en glucose pour être utilisé comme matériau de départ dans la glycolyse. Une adaptation clé à la survie à long terme pendant l'hypoxie est la capacité d'un organisme à stocker de grandes quantités de glycogène. Les tissus de nombreuses espèces tolérantes à l'hypoxie, telles que la carpe, le poisson rouge, le killi et l'oscar, possèdent une teneur en glycogène (300-2000 μmol/g) beaucoup plus grande que ceux des poissons sensibles à l'hypoxie, comme la truite arc-en-ciel, qui n'en contiennent que 100 µmol/g[94]. L'abondance du glycogène stocké dans un tissu indique la capacité de celui-ci à subir la glycolyse et à produire de l'ATP.
Tolérance des déchets
Lorsque les voies anaérobies sont activées, les réserves de glycogène sont épuisées et une accumulation de déchets acides se produit. C'est ce qu'on appelle l'effet Pasteur. Un défi auquel sont confrontés les poissons tolérants à l'hypoxie est de produire de l'ATP de manière anaérobie sans créer un effet Pasteur significatif. Parallèlement à une réduction du métabolisme, certains poissons ont des traits adaptés pour éviter l'accumulation d'acide lactique. Le carassin, par exemple, un poisson très tolérant à l'hypoxie, a évolué pour survivre à des mois d'eaux anoxiques. Une adaptation clé est la capacité de convertir l'acide lactique en éthanol dans le muscle et de l'excréter par les branchies. Bien que ce processus soit énergétiquement coûteux, il est crucial pour leur survie dans les eaux hypoxiques.
Modifications de l'expression des gènes
Des études par puces à ADN réalisées sur différentes espèces de poissons exposées à des conditions de faible teneur en oxygène ont montré qu'au niveau génétique, les poissons réagissent à l'hypoxie en modifiant l'expression des gènes impliqués dans le transport de l'oxygène, la production d'ATP et la synthèse des protéines. Dans le foie des Gillichthys (en) exposés à l'hypoxie, il y a eu des changements dans l'expression des gènes impliqués dans le métabolisme de l'hème tels que ceux de l'hémopexine, de l'hème oxygénase 1 et de la ferritine[95]. Des changements dans la séquestration et le métabolisme du fer peuvent suggérer une érythropoïèse induite par l'hypoxie et une demande accrue de synthèse d'hémoglobine, entraînant une augmentation de l'absorption et du transport d'oxygène. Une expression accrue de la myoglobine, qui n'apparaît normalement que dans le tissu musculaire, a également été observée après une exposition à l'hypoxie dans les branchies du poisson-zèbre[96] et dans les tissus non-musculaires de la carpe commune[97], suggérant une augmentation du transport d'oxygène dans les tissus du poisson.
Les études de puces à ADN réalisées sur des espèces de poissons exposées à l'hypoxie montrent généralement un changement métabolique, c'est-à-dire une diminution de l'expression des gènes impliqués dans le métabolisme aérobie et une augmentation de l'expression des gènes impliqués dans le métabolisme anaérobie. Les embryons de poisson zèbre exposés à l'hypoxie ont diminué l'expression des gènes impliqués dans le cycle de Krebs, notamment la succinate déshydrogénase, la malate déshydrogénase et la citrate synthase, et augmenté l'expression des gènes impliqués dans la glycolyse tels que la phosphoglycérate mutase, l'énolase, l'aldolase et la lactate déshydrogénase[98]. Une diminution de la synthèse des protéines est une réponse importante à l'hypoxie pour diminuer la demande en ATP pour la suppression métabolique de l'organisme entier. Des diminutions de l'expression de gènes impliqués dans la synthèse de protéines comme le facteur d'élongation 2 (en) (EEF2) et plusieurs protéines ribosomiques, ont été mises en évidence dans les muscles des Gillichthys (en)[95] et les branchies du poisson-zèbre adulte[96] après exposition à l'hypoxie.
La recherche chez les mammifères a impliqué les facteurs induits par l'hypoxie (HIF) comme régulateurs clés des changements d'expression génique en réponse à l'hypoxie[99]. Cependant, un lien direct entre les HIF des poissons et les changements d'expression génique en réponse à l'hypoxie n'a pas encore été trouvé. L'analyse phylogénétique des séquences HIF-α et -β chez les poissons, les tétrapodes et les oiseaux, montre que les isoformes des deux sous-unités présentes chez les mammifères sont également représentées chez les poissons[1]. De plus, l'analyse des acides aminés des séquences HIF-α et -β de poissons révèle qu'elles contiennent tous les domaines fonctionnels qui se sont révélés importants pour la fonction HIF des mammifères[1], y compris le domaine basique hélice-boucle-hélice (bHLH), le domaine Per-ARNT-Sim (PAS) et le domaine de dégradation dépendant de l'oxygène (ODD), qui rendent la sous-unité HIF-α sensible aux niveaux d'oxygène[99]. La similitude évolutive entre les séquences HIF chez les poissons, les tétrapodes et les oiseaux, ainsi que la conservation de domaines fonctionnels importants, suggèrent que la fonction et la régulation de HIF sont similaires entre les poissons et de mammifères.
Il existe également des preuves de nouveaux mécanismes HIF présents chez les poissons et non pas chez les mammifères. Chez les mammifères, la protéine HIF-α est continuellement synthétisée et régulée post-traductionnellement en changeant les conditions d'oxygène[100], mais il a été démontré chez différentes espèces de poissons que les niveaux d'ARN messager de HIF-α sont également sensibles à l'hypoxie. Chez la carpe de roseau tolérante à l'hypoxie, des augmentations substantielles des ARNm de HIF-1α et HIF-3α ont été observées dans tous les tissus après exposition à l'hypoxie[101]. De même, les niveaux d'ARNm de HIF-1α et HIF-2α étaient sensibles à l'hypoxie dans les ovaires de Micropogonias undulatus pendant l'hypoxie à court et à long terme.
Références
- (en) Jeffrey G. Richards, Hypoxia, vol. 27, coll. « Fish Physiology », , 443–485 p. (ISBN 9780123746320, DOI 10.1016/S1546-5098(08)00010-1), « Chapter 10 Metabolic and Molecular Responses of Fish to Hypoxia »
- (en) Schmidt-Rohr, K. (2020). "Oxygen Is the High-Energy Molecule Powering Complex Multicellular Life: Fundamental Corrections to Traditional Bioenergetics” ACS Omega 5: 2221-2233. http://dx.doi.org/10.1021/acsomega.9b03352
- (en) Claireaux et Chabot, « Responses by fishes to environmental hypoxia: integration through Fry's concept of aerobic metabolic scope », Journal of Fish Biology, vol. 88, no 1, , p. 232–251 (PMID 26768976, DOI 10.1111/jfb.12833)
- (en) Mandic, Speers-Roesch et Richards, « Hypoxia tolerance in sculpins is associated with high anaerobic enzyme activity in brain but not in liver or muscle », Physiological and Biochemical Zoology, vol. 86, no 1, , p. 92–105 (PMID 23303324, DOI 10.1086/667938)
- (en) Regan, Gill et Richards, « Calorespirometry reveals that goldfish prioritize aerobic metabolism over metabolic rate depression in all but near-anoxic environments », Journal of Experimental Biology, vol. 220, no 4, , p. 564–572 (PMID 27913601, DOI 10.1242/jeb.145169, lire en ligne)
- (en) Rogers, Urbina, Reardon et McKenzie, « A new analysis of hypoxia tolerance in fishes using a database of critical oxygen level (P crit) », Conservation Physiology, vol. 1, no 4, , cow012 (PMID 27293760, PMCID 4849809, DOI 10.1093/conphys/cow012)
- (en) Gonzalez, Almaraz, Obeso et Rigual, « Carotid body chemoreceptors: from natural stimuli to sensory discharges », Physiol Rev, vol. 74, no 4, , p. 829–898 (PMID 7938227, DOI 10.1152/physrev.1994.74.4.829)
- (en) Fu, Nurse, Wong et Cutz, « Hypoxia-induced secretion of serotonin from intact pulmonary neuroepithelial bodies in neonatal rabbit », J Physiol, vol. 539, no Pt 2, , p. 503–510 (PMID 11882682, PMCID 2290169, DOI 10.1113/jphysiol.2001.013071)
- (en) Jonz, Fearon et Nurse, « Neuroepithelial oxygen chemoreceptors of the zebrafish gill », J Physiol, vol. 560, no Pt 3, , p. 737–752 (PMID 15331683, PMCID 1665292, DOI 10.1113/jphysiol.2004.069294)
- (en) Jonz et Nurse, « Neuroepithelial cells and associated innervation of the zebrafish gill: A confocal immunofluorescence study », J Comp Neurol, vol. 461, no 1, , p. 1–17 (PMID 12722101, DOI 10.1002/cne.10680)
- (en) Coolidge, Ciuhandu et Milsom, « A comparative analysis of putative oxygen sensing cells in the fish gill », J Exp Biol, vol. 211, no Pt 8, , p. 1231–1242 (PMID 18375847, DOI 10.1242/jeb.015248)
- (en) Lesage et Lazdunski, « Molecular and functional properties of two-pore-domain potassium channels », Am J Physiol, vol. 279, no 5, , F793–F801 (PMID 11053038, DOI 10.1152/ajprenal.2000.279.5.F793, lire en ligne)
- (en) Farrell, Daxboeck et Randall, « The effect of input pressure and flow on the pattern and resistance to flow in the isolated perfused gill of a teleost fish », J Comp Physiol, vol. 133, no 3, , p. 233–240 (DOI 10.1007/BF00691471)
- (en) Lopez-Barneo, Lopez-Lopez, Urena et Gonzalez, « Chemotransduction in the carotid body: K+ current modulated by PO2 in type I chemoreceptor cells », Science, vol. 241, no 4865, , p. 580–582 (PMID 2456613, DOI 10.1126/science.2456613, Bibcode 1988Sci...241..580L)
- (en) Fu, Wang, Nurse et Dinauer, « NADPH oxidase is an O2 sensor in airway chemoreceptors: Evidence from K+ current modulation in wild-type and oxidase-deficient mice », Proc Natl Acad Sci USA, vol. 97, no 8, , p. 4374–4379 (PMID 10760304, PMCID 18249, DOI 10.1073/pnas.97.8.4374, Bibcode 2000PNAS...97.4374F)
- (en) Holeton et Randall, « Changes in blood pressure in the rainbow trout during hypoxia », J Exp Biol, vol. 46, no 2, , p. 297–305 (PMID 6033996, DOI 10.1242/jeb.46.2.297)
- (en) Reebs, S.G. (2009) Oxygen and fish behaviour
- (en) Iersel, J.J.A. van. 1953. An analysis of the parental behaviour of the male three-spine stickleback (Gasterosteus aculeatus L.). Behaviour Supplement 3: 1-159.
- Sevenster, P. 1961. A causal analysis of a displacement activity (fanning in Gasterosteus aculeatus L.). Behaviour Supplement 9: 1-170.
- (en) Torricelli, Lugli et Gandolfi, « A quantitative analysis of the fanning activity in the male Padogobius martensi (Pisces: Gobiidae) », Behaviour, vol. 92, nos 3/4, , p. 288–301 (JSTOR 4534416)
- (en) Takegaki et Nakazono, « Responses of the egg-tending gobiid fish Valenciennea longipinnis to the fluctuation of dissolved oxygen in the burrow », Bulletin of Marine Science, vol. 65, , p. 815–823
- (en) Green et McCormick, « O2 replenishment to fish nests: males adjust brood care to ambient conditions and brood development », Behavioral Ecology, vol. 16, no 2, , p. 389–397 (DOI 10.1093/beheco/ari007)
- (en) Jones et Reynolds, « Oxygen and the trade-off between egg ventilation and brood protection in the common goby », Behaviour, vol. 136, no 7, , p. 819–832 (DOI 10.1163/156853999501586)
- (en) Jones et Reynolds, « The influence of oxygen stress on female choice for male nest structure in the common goby », Animal Behaviour, vol. 57, no 1, , p. 189–196 (PMID 10053086, DOI 10.1006/anbe.1998.0940)
- (en) Courtenay et Keenleyside, « Wriggler-hanging: a response to hypoxia by brood-rearing Herotilapia multispinosa (Teleostei, Cichlidae) », Behaviour, vol. 85, no 3, , p. 183–197 (DOI 10.1163/156853983x00219)
- (en) Domenici, Steffensen et Batty, « The effect of progressive hypoxia on swimming activity and schooling in Atlantic herring », Journal of Fish Biology, vol. 57, no 6, , p. 1526–1538 (DOI 10.1006/jfbi.2000.1413)
- (en) Dalla Via, Van, den Thillart et Cattani, « Behavioural responses and biochemical correlates in Solea solea to gradual hypoxic exposure », Canadian Journal of Zoology, vol. 76, no 11, , p. 2108–2113 (DOI 10.1139/z98-141)
- (en) Kramer et Mehegan, « Aquatic surface respiration, an adaptive response to hypoxia in the guppy, Poecilia reticulata (Pisces, Poeciliidae) », Environmental Biology of Fishes, vol. 6, nos 3–4, , p. 299–313 (DOI 10.1007/bf00005759)
- (en) Metcalfe et Butler, « Changes in activity and ventilation in response to hypoxia in unrestrained, unoperated dogfish (Scyliorhinus canicula L.) », Journal of Experimental Biology, vol. 180, , p. 153–162
- (en) Fisher, Rademacher et Kils, « In situ investigations on the respiration and behaviour of the eelpout Zoarces viviparus under short-terms hypoxia », Marine Ecology Progress Series, vol. 88, , p. 181–184 (DOI 10.3354/meps088181, Bibcode 1992MEPS...88..181F)
- (en) Carlson et Parsons, « The effects of hypoxia on three sympatric shark species: physiological and behavioral responses », Environmental Biology of Fishes, vol. 61, no 4, , p. 427–433 (DOI 10.1023/a:1011641302048)
- (en) Kramer, « Dissolved oxygen and fish behavior », Environmental Biology of Fishes, vol. 18, no 2, , p. 81–92 (DOI 10.1007/bf00002597)
- (en) Congleton, « Observations of the responses of some southern California tidepool fishes to nocturnal hypoxic stress », Comparative Biochemistry and Physiology A, vol. 66, no 4, , p. 719–722 (DOI 10.1016/0300-9629(80)90026-2)
- (en) Sloman, Mandic, Todgham et al., « The response of the tidepool sculpin, Oligocottus maculosus, to hypoxia in laboratory, mecocosm and field environments », Comparative Biochemistry and Physiology A, vol. 149, no 3, , p. 284–292 (PMID 18276177, DOI 10.1016/j.cbpa.2008.01.004)
- (en) Mandic et Sloman, « Escaping to the surface: a phylogenetically independent analysis of hypoxia-induced respiratory behaviors in sculpins », Physiol Biochem Zool, vol. 82, no 6, , p. 703–738 (PMID 19799503, DOI 10.1086/605932)
- (en) Reebs, Whoriskey et FitzGerald, « Diel patterns of fanning activity, egg respiration, and the nocturnal behavior of male three spined sticklebacks, Gasterosteus aculeatus L. (f. trachurus) », Canadian Journal of Zoology, vol. 62, no 329, , p. 334 (DOI 10.1139/z84-051)
- (en) Wannamaker et Rice, « Effects of hypoxia on movements and behavior of selected estuarine organisms from the southeastern United States », Journal of Experimental Marine Biology and Ecology, vol. 249, no 2, , p. 145–163 (PMID 10841932, DOI 10.1016/s0022-0981(00)00160-x)
- (en) Stierhoff, Targett et Grecay, « Hypoxia tolerance of the mummichog: the role of access to the water surface », Journal of Fish Biology, vol. 63, no 3, , p. 580–592 (DOI 10.1046/j.1095-8649.2003.00172.x)
- (en) Gee, Tallman et Smart, « Reactions of some great plains fishes to progressive hypoxia », Canadian Journal of Zoology, vol. 56, no 9, , p. 1962–1966 (DOI 10.1139/z78-263)
- (en) Kramer et McClure, « Aquatic surface respiration, a widespread adaptation to hypoxia in tropical freshwater fishes », Environmental Biology of Fishes, vol. 7, , p. 47–55 (DOI 10.1007/bf00011822)
- (en) Klinger, Magnuson et Gallepp, « Survival mechanisms of the central mudminnow (Umbra limi), fathead minnow (Pimephales promelas) and brook stickleback (Culaea inconstans) for low oxygen in winter », Environmental Biology of Fishes, vol. 7, no 2, , p. 113–120 (DOI 10.1007/bf00001781)
- (en) Magnuson, Beckel, Mills et Brandt, « Surviving winter hypoxia: behavioral adaptations of fishes in a northern Wisconsin winterkill lake », Environmental Biology of Fishes, vol. 14, no 4, , p. 241–250 (DOI 10.1007/bf00002627)
- (en) Petrosky et Magnuson, « Behavioral responses of Northern pike, yellow perch and bluegill to oxygen concentrations under simulated winterkill conditions », Copeia, vol. 1973, no 1, , p. 124–133 (DOI 10.2307/1442367, JSTOR 1442367)
- (en) Lewis, « Morphological adaptations of cyprinodontoids for inhabiting oxygen deficient waters », Copeia, vol. 1970, no 2, , p. 319–326 (DOI 10.2307/1441653, JSTOR 1441653)
- (en) Sundin, Reid, Rantin et Milson, « Branchial receptors and cardiorespiratory reflexes in a neotropical fish, the tambaqui (Colossoma macropomum) », Journal of Experimental Biology, vol. 203, no Pt 7, , p. 1225–1239 (PMID 10708642, DOI 10.1242/jeb.203.7.1225)
- (en) Chapman, Kaufman et Chapman, « Why swim upside down? A comparative study of two mochokid catfishes », Copeia, vol. 1994, no 1, , p. 130–135 (DOI 10.2307/1446679, JSTOR 1446679)
- (en) Gee et Gee, « Reaction of gobioid fishes to hypoxia: buoyancy control and aquatic surface respiration », Copeia, vol. 1991, no 1, , p. 17–28 (DOI 10.2307/1446244, JSTOR 1446244)
- (en) Plath M, Tobler M, Riesch R, García de León FJ, Giere O, Schlupp I. 2007. Survival in an extreme habitat: the roles of behaviour and energy limitation. Die Naturwissenschaften 94: 991-6. PMID
- (en) Timmerman et Chapman, « The effect of gestational state on oxygen consumption and response to hypoxia in the sailfin molly, Poecilia latipinna », Environmental Biology of Fishes, vol. 68, no 3, , p. 293–299 (DOI 10.1023/a:1027300701599)
- (en) Richards, « Physiological, behavioral and biochemical adaptations of intertidal fishes to hypoxia », J Exp Biol, vol. 214, no Pt 2, , p. 191–199 (PMID 21177940, DOI 10.1242/jeb.047951)
- (en) Sloman, Sloman, De Boeck et Scott, « The role of size in synchronous air breathing of Hoplosternum littorale », Physiol Biochem Zool, vol. 82, no 6, , p. 625–34 (PMID 19799504, DOI 10.1086/605936, lire en ligne)
- (en) Lauren J. Chapman et David J. McKenzie, Hypoxia, vol. 27, coll. « Fish Physiology », , 25–77 p. (ISBN 9780123746320, DOI 10.1016/S1546-5098(08)00002-2), « Chapter 2 Behavioral Responses and Ecological Consequences »
- (en) Domenici, Lefrançois et Shingles, « Hypoxia and the antipredator behaviours of fishes », Philos Trans R Soc Lond B, vol. 362, no 1487, , p. 2105–2121 (PMID 17472921, PMCID 2442856, DOI 10.1098/rstb.2007.2103)
- (en) Shingles, McKenzie, Claireaux et Domenici, « Reflex cardioventilatory responses to hypoxia in the flathead grey mulet (Mugil cephalus) and their behavioural modulation by perceived threat of predation and water turbidity », Physiological and Biochemical Zoology, vol. 78, no 5, , p. 744–755 (PMID 16052452, DOI 10.1086/432143, lire en ligne)
- (en) Regan et Richards, « Rates of hypoxia induction alter mechanisms of O2 uptake and the critical O2 tension of goldfish », Journal of Experimental Biology, vol. 220, no 14, , p. 2536–2544 (PMID 28476894, DOI 10.1242/jeb.154948)
- (en) Evans, Piermarini et Choe, « The multifunctional fish gill: dominant site of gas exchange, osmoregulation, acid-base regulation, and excretion of nitrogenous waste », Physiological Reviews, vol. 85, no 1, , p. 97–177 (PMID 15618479, DOI 10.1152/physrev.00050.2003)
- (en) Sollid, De Angelis, Gundersen et Nilsson, « Hypoxia induces adaptive and reversible gross morphological changes in crucian carp gills », J Exp Biol, vol. 206, no Pt 20, , p. 3667–73 (PMID 12966058, DOI 10.1242/jeb.00594)
- (en) Sollid, Weber et Nilsson, « Temperature alters the respiratory surface area of crucian carp Carassius carassius and goldfish Carassius auratus », Journal of Experimental Biology, vol. 208, no Pt 6, , p. 1109–16 (PMID 15767311, DOI 10.1242/jeb.01505)
- (en) Matey, Richards, J. G., Wang, Y. et Wood, C. M., « The effect of hypoxia on gill morphology and ionoregulatory status in the Lake Qinghai scaleless carp, Gymnocypris przewalskii », Journal of Experimental Biology, vol. 211, no 7, , p. 1063–1074 (PMID 18344480, DOI 10.1242/jeb.010181)
- (en) Cao, Chen, Xue-Qun, Wang, Shen et Wang, Yu-Xiang, « Evolution and Regulation of the Downstream Gene of Hypoxia-Inducible Factor-1α in Naked Carp (Gymnocypris przewalskii) from Lake Qinghai, China », Journal of Molecular Evolution, vol. 67, no 5, , p. 570–580 (PMID 18941827, DOI 10.1007/s00239-008-9175-4, Bibcode 2008JMolE..67..570C)
- (en) Perry, SF, Esbaugh, A, Braun, M, and Gilmour, KM. 2009. Gas Transport and Gill Function in Water Breathing Fish. In Cardio-Respiratory Control in Vertebrates, (ed. Glass ML, Wood SC), pp. 5-35. Berlin: Springer-Verlag.
- (en) Wood, Mcdonald et Mcmahon, « The influence of experimental anemia on blood acid-base regulation in vivo and in vitro in the starry flounder (Platichthys stellatus) and rainbow trout (Salmo gairdneri) », J Exp Biol, vol. 96, , p. 221–237 (DOI 10.1242/jeb.96.1.221)
- (en) Yamamoto, Itazawa et Kobayashi, « Direct observations of fish spleen by an abdominal window method and its application to exercised and hypoxic yellowtail », Jpn J Ichthyol, vol. 31, , p. 427–433
- (en) Lai, Kakuta, Mok et Rummer, « Effects of moderate and substantial hypoxia on erythropoietin levels in rainbow trout kidney and spleen », Journal of Experimental Biology, vol. 209, no Pt 14, , p. 2734–8 (PMID 16809464, DOI 10.1242/jeb.02279)
- (en) Semenza, « O2-regulated gene expression: transcriptional control of cardiorespiratory physiology by HIF-1 », J Appl Physiol, vol. 96, no 3, , p. 1173–1177 (PMID 14766767, DOI 10.1152/japplphysiol.00770.2003)
- (en) Powers, « Molecular Ecology of Teleost Fish Hemoglobins Strategies for Adapting to Changing Environments », Integrative and Comparative Biology, vol. 20, no 1, , p. 139–162 (DOI 10.1093/icb/20.1.139)
- (en) Borgese, Garcia-Romeu et Motais, « Control of cell volume and ion transport by beta-adrenergic catecholamines in erythrocytes of rainbow trout, Salmo gairdneri », J Physiol, vol. 382, , p. 123–44 (PMID 3040965, PMCID 1183016, DOI 10.1113/jphysiol.1987.sp016359)
- (en) Nikinmaa, M et Boutilier, RG, Advances in Comparative and Environmental Physiology, vol. 21, Berlin, Springer-Verlag, , 107–133 p., « Adrenergic control of red cell pH, organic phosphate concentrations and haemoglobin function in teleost fish »
- (en) Devaux, Hedges et Hickey, « Acidosis Maintains the Function of Brain Mitochondria in Hypoxia-Tolerant Triplefin Fish: A Strategy to Survive Acute Hypoxic Exposure? », Front Physiol, vol. 9, 1914, , p. 1941 (PMID 30713504, PMCID 6346031, DOI 10.3389/fphys.2018.01941)
- (en) Tamburrini, Verde, Olianas et Giardina, « The hemoglobin system of the brown moray Gymnothorax unicolor: Structure/function relationships », Eur J Biochem, vol. 268, no 14, , p. 4104–4111 (PMID 11454005, DOI 10.1046/j.1432-1327.2001.02333.x)
- (en) Rutjes, Nieveen, Weber et Witte, « Multiple strategies of Lake Victoria cichlids to cope with lifelong hypoxia include hemoglobin switching », American Journal of Physiology. Regulatory, Integrative and Comparative Physiology, vol. 293, no 3, , R1376–83 (PMID 17626121, DOI 10.1152/ajpregu.00536.2006)
- (en) Abbaraju et Rees, « Effects of dissolved oxygen on glycolytic enzyme specific activities in liver and skeletal muscle of Fundulus heteroclitus », Fish Physiology and Biochemistry, vol. 38, no 3, , p. 615–24 (PMID 21818543, DOI 10.1007/s10695-011-9542-8)
- (en) Nilsson, Rosen et Johansson, « Anoxic depression of spontaneous locomotor activity in crucian carp quantified by a computerized imaging technique », Journal of Experimental Biology, vol. 180, , p. 153–162 (DOI 10.1242/jeb.180.1.153, lire en ligne)
- Tobias Wang, Sjannie Lefevre, Do Thi Thanh Huong, Nguyen van Cong et Bayley, Hypoxia, vol. 27, coll. « Fish Physiology », , 361–396 p. (ISBN 9780123746320, DOI 10.1016/S1546-5098(08)00008-3), « Chapter 8 the Effects of Hypoxia on Growth and Digestion »
- Rudolf S.S. Wu, Hypoxia, vol. 27, coll. « Fish Physiology », , 79–141 p. (ISBN 9780123746320, DOI 10.1016/S1546-5098(08)00003-4), « Chapter 3 Effects of Hypoxia on Fish Reproduction and Development »
- (en) Fitzgibbon, Seymour, Ellis et Buchanan, « The energetic consequence of specific dynamic action in southern bluefin tuna Thunnus maccoyii », Journal of Experimental Biology, vol. 210, no 2, , p. 290–8 (PMID 17210965, DOI 10.1242/jeb.02641)
- (en) Tobias Wang, Sjannie Lefevre, Do Thi Thanh Huong, Nguyen van Cong et Bayley, Hypoxia, vol. 27, coll. « Fish Physiology », , 361–396 p. (ISBN 9780123746320, DOI 10.1016/S1546-5098(08)00008-3), « Chapter 8 the Effects of Hypoxia on Growth and Digestion »
- (en) Jibb et Richards, « AMP-activated protein kinase activity during metabolic rate depression in the hypoxic goldfish, Carassius auratus », Journal of Experimental Biology, vol. 211, no Pt 19, , p. 3111–22 (PMID 18805810, DOI 10.1242/jeb.019117)
- (en) Lewis, Costa, Val et Almeida Val, « Responses to hypoxia recovery: Repayment of oxygen debt is not associated with compensatory protein synthesis in the Amazonian cichlid, Astronotus ocellatus », Journal of Experimental Biology, vol. 210, no Pt 11, , p. 1935–43 (PMID 17515419, DOI 10.1242/jeb.005371)
- (en) Smith, Houlihan, Nilsson et Brechin, « Tissue-specific changes in protein synthesis rates in vivo during anoxia in the crucian carp », American Journal of Physiology, vol. 271, no 4 Pt 2, , R897–904 (PMID 8897979, DOI 10.1152/ajpregu.1996.271.4.r897)
- (en) Regan, Gosline et Richards, « A simple and affordable calorespirometer for assessing the metabolic rates of fishes », Journal of Experimental Biology, vol. 216, no Pt 24, , p. 4507–13 (PMID 24072793, DOI 10.1242/jeb.093500)
- (en) Nelson, « Oxygen consumption rate v. rate of energy utilization of fishes: a comparison and brief history of the two measurements », Journal of Fish Biology, vol. 88, no 1, , p. 10–25 (PMID 26768970, DOI 10.1111/jfb.12824)
- (en) van Ginneken, Addink et van den Thillart, « Metabolic rate and level of activity determined in tilapia (Oreochromis mossambicus Peters) by direct and indirect calorimetry and videomonitoring », Thermochimica Acta, vol. 291, nos 1–2, , p. 1–13 (DOI 10.1016/S0040-6031(96)03106-1).
- (en) van Ginneken, Onderwater, Olivar et van den Thillart, « Metabolic depression and investigation of glucose/ethanol conversion in the European eel (Anguilla anguilla Linnaeus 1758) during anaerobiosis », Thermochimica Acta, vol. 373, , p. 23–30 (DOI 10.1016/S0040-6031(01)00463-4).
- (en) Regan, Gill et Richards, « Calorespirometry reveals that goldfish prioritize aerobic metabolism over metabolic rate depression in all but near-anoxic environments », Journal of Experimental Biology, vol. 220, no 4, , p. 564–572 (PMID 27913601, DOI 10.1242/jeb.145169)
- (en) Stangl et Wegener, « Calorimetric and biochemical studies on the effects of environmental hypoxia and chemicals on freshwater fish », Thermochimica Acta, vol. 271, , p. 101–113 (DOI 10.1016/0040-6031(95)02586-3)
- (en) Regan, Gill et Richards, « Metabolic depression and the evolution of hypoxia tolerance in threespine stickleback, Gasterosteus aculeatus », Biology Letters, vol. 13, no 11, , p. 20170392 (PMID 29093174, PMCID 5719371, DOI 10.1098/rsbl.2017.0392)
- (en) van Waversveld, Addink et van den Thillart, « The anaerobic energy metabolism of goldfish determined by simultaneous direct and indirect calorimetry during anoxia and hypoxia », Journal of Comparative Physiology, vol. 159, no 3, , p. 263–268 (DOI 10.1007/bf00691503)
- (en) Buck et Hochachka, « Anoxic suppression of Na+/K+-ATPase and constant membrane potential in hepatocytes: support for channel arrest », Am J Physiol, vol. 265, no 5 Pt 2, , R1020–R1025 (PMID 8238602, DOI 10.1152/ajpregu.1993.265.5.r1020)
- (en) Else et Hulbert, « Evolution of mammalian endothermic metabolism: "leaky" membranes as a source of heat », Am J Physiol, vol. 253, no 1 Pt 2, , R1–7 (PMID 3605374, DOI 10.1152/ajpregu.1987.253.1.R1)
- (en) Busk et Boutilier, « Metabolic arrest and its regulation in anoxic eel hepatocytes », Physiological and Biochemical Zoology, vol. 78, no 6, , p. 926–36 (PMID 16228932, DOI 10.1086/432857)
- (en) Bogdanova, Grenacher, Nikinmaa et Gassmann, « Hypoxic responses of Na +/K+ ATPase in trout hepatocytes », J. Exp. Biol., vol. 208, no Pt 10, , p. 1793–1801 (PMID 15879061, DOI 10.1242/jeb.01572)
- (en) Hylland, Milton, Pek et Nilsson, « Brain Na+/K+-ATPase activity in two anoxia tolerant vertebrates: Crucian carp and freshwater turtle », Neurosci Lett, vol. 235, nos 1–2, , p. 89–92 (PMID 9389603, DOI 10.1016/s0304-3940(97)00727-1)
- (en) Matti Vornanen, Jonathan A.W. Stecyk et Göran E. Nilsson, Hypoxia, vol. 27, coll. « Fish Physiology », , 397–441 p. (ISBN 9780123746320, DOI 10.1016/S1546-5098(08)00009-5), « Chapter 9 the Anoxia-Tolerant Crucian Carp (Carassius Carassius L.) »
- (en) Gracey, Troll et Somero, « Hypoxia-induced gene expression profiling in the euryoxic fish Gillichthys mirabilis », Proc Natl Acad Sci USA, vol. 98, no 4, , p. 1993–1998 (PMID 11172064, PMCID 29370, DOI 10.1073/pnas.98.4.1993, Bibcode 2001PNAS...98.1993G)
- (en) van der Meer, den Thillart, Witte et al., « Gene expression profiling of the long-term adaptive response to hypoxia in the gills of adult zebrafish », American Journal of Physiology. Regulatory, Integrative and Comparative Physiology, vol. 289, no 5, , R1512–9 (PMID 15994372, DOI 10.1152/ajpregu.00089.2005)
- (en) Fraser, de Mello, Ward et Rees, « Hypoxia-inducible myoglobin expression in non-muscle tissues », Proc Natl Acad Sci USA, vol. 103, no 8, , p. 2977–2981 (PMID 16469844, PMCID 1413783, DOI 10.1073/pnas.0508270103)
- (en) Ton, Stamatiou et Liew, « Gene expression profile of zebrafish exposed to hypoxia during development », Physiological Genomics, vol. 13, no 2, , p. 97–106 (PMID 12700360, DOI 10.1152/physiolgenomics.00128.2002, lire en ligne)
- (en) Nikinmaa et Rees, « Oxygen-dependent gene expression in fishes », American Journal of Physiology. Regulatory, Integrative and Comparative Physiology, vol. 288, no 5, , R1079–90 (PMID 15821280, DOI 10.1152/ajpregu.00626.2004, lire en ligne)
- (en) Kenneth et Rocha, « Regulation of gene expression by hypoxia », Biochem J, vol. 414, no 1, , p. 19–29 (PMID 18651837, DOI 10.1042/BJ20081055)
- (en) Law, Wu, Ng et Yu, « Cloning and expression analysis of two distinct HIF-alpha isoforms--gcHIF-1alpha and gcHIF-4alpha--from the hypoxia-tolerant grass carp, Ctenopharyngodon idellus », BMC Molecular Biology, vol. 7, no 1, , p. 15 (PMID 16623959, PMCID 1473195, DOI 10.1186/1471-2199-7-15)