Coopérativité
La coopérativité est un phénomène caractérisant des systèmes au sein desquels des éléments identiques ou quasi identiques agissent de manière dépendante les uns avec les autres, par rapport à un système standard hypothétiquement sans interaction et où les éléments individuels agiraient indépendamment les uns des autres.
Dans le domaine de la biochimie, la coopérativité est une propriété des protéines, enzymes ou des récepteurs, qui possèdent deux ou plusieurs sites permettant de fixer des substrats ou des ligands. Une protéine est dite coopérative lorsque les fixations des différents ligands ne sont pas indépendantes, mais se renforcent mutuellement : la liaison d'un premier ligand sur son site augmente l'affinité d'un autre ligand sur un autre site[1].
La protéine utilise une partie de l'enthalpie libre de liaison associée à la fixation du premier ligand pour modifier sa conformation. Cette conformation modifiée a une géométrie plus favorable à la fixation du second ligand.
Certaines protéines ont un comportement opposé et montrent une coopérativité négative ou anticoopérativité. Dans ce cas, la fixation d'un premier ligand fait baisser l'affinité et donc l'efficacité de liaisons des ligands suivants. Le cas limite de l'anticoopérativité se produit lorsque la fixation sur un premier site abolit la fixation sur un second site. On parle alors de réactivité demi-site.
Formalisme de Hill
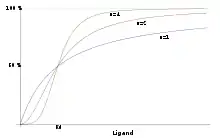
Le biochimiste britannique Archibald Vivian Hill fut l'un des premiers à proposer une formulation mathématique de la coopérativité, dans le cadre de ses travaux sur la fixation de l'oxygène par l'hémoglobine. L'équation de Hill concerne le cas particulier de la fixation d'un même ligand sur plusieurs sites d'une protéine oligomérique possédant un site de fixation sur chaque monomère. Elle est donnée par la loi empirique suivante :
où représente la fraction des sites comportant un ligand lié, [L] est la concentration de ligand et est la constante de dissociation apparente. La constante n s'appelle la constante de Hill et décrit le degré de coopérativité de la fixation du ligand :
- Si n = 1, la fixation sur les différents sites est indépendante. L'équation de Hill se réduit alors à une fixation simple, comme dans l'équation de Michaelis-Menten
- Si n > 1, la fixation est coopérative
- Si n < 1, la fixation est anticoopérative
Plus le nombre de Hill, n, est grand et plus la coopérativité est forte. En général, n est inférieur au nombre de sites, c'est-à-dire au nombre de sous-unités de la protéine. En l'absence de coopérativité (n=1), la courbe de saturation des sites par le ligand est une branche d'hyperbole (voir figure). La coopérativité (n>1) se traduit par une courbe de saturation de forme sigmoïde, d'autant plus marquée que la coopérativité est forte.
Coopérativité en chimie supramoléculaire
En chimie supramoléculaire, lors de la formation d'assemblages entre molécules ligands et récepteurs possédant plusieurs sites de liaison, on observe également parfois des processus coopératifs, où la fixation sur un site modifie l'affinité pour la fixation sur les autres sites. Trois types de coopérativité ont ainsi été décrits[2] - [3].
Allostérique
La coopérativité allostérique concerne un récepteur divalent déjà complexé avec un substrat monovalent. Il y aura coopérativité allostérique si la complexation d’un deuxième substrat est améliorée par une interaction (électrostatique, stérique ou conformationnelle) entre les deux substrats.
Chélatante
La coopérativité chélatante concerne deux entités divalentes. Lors de la complexation d’un premier ligand, la deuxième complexation va être améliorée grâce à la liaison covalente entre les deux ligands.
Interannulaire
La coopérativité Interannulaire concerne un récepteur tétravalent ayant une rotation interne libre. Lors de la complexation d’un premier ligand divalent, la rotation va être bloquée ce qui va améliorer la complexation du second ligand.
Voir aussi
Articles connexes
Bibliographie
- Chao, A. et al. (2014) Rarefaction and extrapolation with Hill numbers: a framework for sampling and estimation in species diversity studies. Ecol. Monogr. 84, 45–67
Liens externes
- Notice dans un dictionnaire ou une encyclopédie généraliste :
Notes et références
- J. Yon-Kahn et G. Hervé, Enzymologie, molécules et cellules, Les Ulis, Edp Sciences, , 361 p. (ISBN 978-2-86883-816-2)
- 2 Mulder, A. ; Huskens J. ; Reinhoudt D. N.; Org. Biomol. Chem. 2004, 2, 3409-3424
- 3 Ercolani, G.; Schiaffino, L.; Angew. Chem. Int. Ed. 2011, 50, 1762-1768
![{\displaystyle \theta ={[L]^{n} \over K_{d}+[L]^{n}}}](https://img.franco.wiki/i/538a0d39c9f0e9ca37ffa09c808c68673eccec1f.svg)

