Protéine fluorescente verte
La protéine fluorescente verte (souvent abrégé GFP, de l'anglais « Green Fluorescent Protein ») est une protéine ayant la propriété d'émettre une fluorescence de couleur verte. Issue d'une méduse (Aequorea victoria), cette protéine est intrinsèquement fluorescente sous l'action d'une enzyme, l'aequoréine, une luciférase qui agit en présence de calcium. Son gène peut être fusionné in-vitro au gène d'une protéine que l'on souhaite étudier. Le gène recombinant est ensuite réintroduit dans des cellules ou un embryon, qui va alors synthétiser la protéine de fusion, alors fluorescente. On pourra alors l'observer à l'aide d'un microscope à fluorescence, par exemple. Cette méthode permet d'étudier les protéines dans leur environnement naturel : la cellule vivante. La découverte et les applications de la GFP ont été couronnées par le prix Nobel de chimie décerné à Osamu Shimomura, Martin Chalfie et Roger Tsien le [1] - [2].
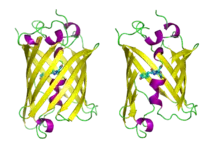
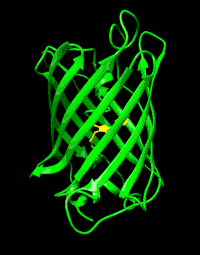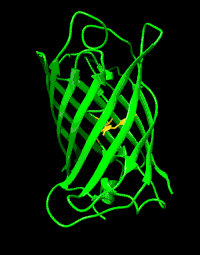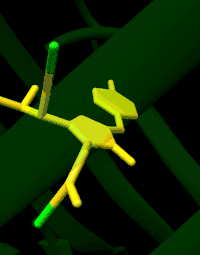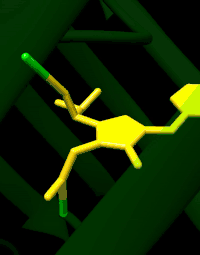
Structure
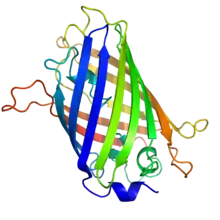
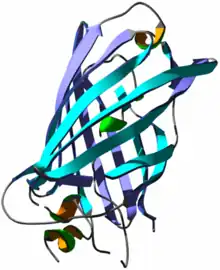
La GFP a été décrite pour la première fois en 1962. Elle est constituée de 238 acides aminés pour une masse moléculaire d'environ 27 kDa. Le chromophore (centre actif responsable de la fluorescence) est constitué par les chaînes latérales d'une glycine, une tyrosine et une sérine.
La GFP non modifiée, dite sauvage (wild type GFP, wGFP) a deux maxima d'excitation. Le premier se trouve avec une longueur d'onde de 395 nm (lumière UV), le deuxième à 475 nm (lumière bleue). La longueur d'onde d'émission maximale est à 504 nm. Elle est également photo-excitable, ce qui signifie que l'intensité de la fluorescence émise est intensifiée par une exposition à des photons ultraviolets, caractéristique perdue dans la plupart des variants produits par la suite.
Il existe maintenant différentes variantes de la GFP qui ont été obtenues en modifiant celle-ci par ingénierie génétique. Il existe également d'autre protéines fluorescentes issues d'autres organismes que A. Victoria :
- EGFP : fluorescence verte (enhanced GFP) ;
- CFP : fluorescence cyan (bleu-vert), et son variant Cerulean ;
- EYFP : fluorescence jaune (Y pour yellow), et ses variants Venus et Citrine ;
- EBFP : fluorescence bleue, et son variant l'Azurite :
- PA-GFP : GFP photo-activable à 405 nm :
- PHluorin : GFP sensible au pH, s'éteint à pH acide.
Il a été montré que la GFP fusionnée à une protéine peut aider le repliement de cette dernière lors de son expression génétique.
Autres protéines fluorescentes
- DsRed : fluorescence rouge, issue d'un corail, du genre Discosoma. Elle est à l'origine d'une seconde famille de variants dans la gamme orange-rouge.
- Keima : fluorescence rouge avec excitation dans le bleu (déplacement de Stokes important)
Utilisation en recherche en biologie
Principe
La protéine fluorescente verte peut être utilisée comme gène rapporteur. Associée avec un gène d'intérêt, elle permet l'observation directe de l'expression de ce gène dans la cellule à la microscopie à fluorescence. Le gène codant la protéine GFP est incorporé dans le génome de l'organisme, dans la région du gène qui code la protéine d'intérêt, et qui sera ainsi contrôlée par la même séquence régulatrice. Dans les cellules où le gène sera exprimé, et la protéine d'intérêt produite, la GFP sera synthétisée au même moment. Ainsi, ces cellules deviendront fluorescentes pendant que celles n'exprimant pas le gène d'intérêt resteront inertes sous la lumière de la microscopie à fluorescence.
Avantages
Observer la GFP est non invasif : on peut l'observer directement en éclairant l'échantillon avec de la lumière d'une certaine longueur d'onde. De plus, la GFP est une molécule relativement petite et inerte, qui ne semble interagir avec aucun processus biologique d'intérêt. La GFP étant un monomère, elle peut diffuser rapidement à travers les cellules[3]. Les gènes rapporteurs utilisés avant la GFP, comme la bêta-galactosidase impliquaient de « fixer » (tuer) l'organisme ou les cellules pour pouvoir les observer, alors que la GFP s'accumule dans les cellules en vie en temps réel, ce qui permet d'observer les changements d'expression au cours de l'expérience. De plus, elle permet de mesurer la variation entre les individus (cellules) d'un échantillon[4]. Pour finir, la GFP est héritable.
Microscopie à fluorescence
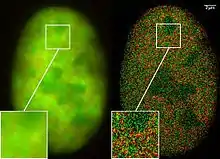
La découverte de la GFP et de ses protéines dérivées a profondément modifié la microscopie à fluorescence et son utilisation en biologie cellulaire[5]. Alors que la plupart des petites molécules fluorescentes, comme la Fluorescéine sont fortement toxiques quand elles sont utilisées dans des cellules vivantes, les protéines fluorescentes telles que la GFP sont bien moins dangereuses quand on les illumine dans l'échantillon. Ceci a déclenché le développement de systèmes automatisés permettant de suivre l'expression d'autres protéines dont le gène aura été lié avec celui de la GFP ou d'autres protéines similaires. On peut utiliser cette technique in vitro ou in vivo[6].
Applications

De nouvelles lignées de rats transgéniques à la GFP sont utilisés pour la recherche en thérapie génique, ainsi qu'en médecine régénératrice[7]. En effet, la plupart des cellules marquées avec un gène rapporteur provoquent une réponse immunitaire lorsqu'elles sont introduites dans un hôte. Les lignées de rat exprimant à haut niveau la GFP, dans toutes leurs cellules, pourraient servir de source de cellules à introduire dans un autre hôte, celles-ci risquant moins de provoquer un rejet[7]. La GFP est aussi grandement utilisée dans la recherche sur le cancer, pour marquer et suivre les cellules cancereuses. Ces cellules ont été utilisées pour modéliser la métastase, le processus par lequel les cellules cancereuses s'étendent à d'autres organes[8].
La GFP dans les Beaux-Arts
.jpg.webp)
Julian Voss-Andreae, un artiste d’origine allemande spécialisé dans les « sculptures de protéines »[9], a réalisé des sculptures s’inspirant de la structure de la GFP, notamment la sculpture de 1,70 m de hauteur intitulée Green Fluorescent Protein (2004)[10] et la sculpture Steel Jellyfish (2006) de 1,40 m de hauteur. Cette dernière est installée aux Friday Harbor Laboratories de l’université de Washington, là où a été découverte la GFP par Shimomura en 1962[11].
Eduardo Kac, un artiste utilisant la GFP pour ses œuvres de BioArt.
Voir aussi
Articles connexes
- GloFish, une marque déposée de poisson zèbre génétiquement modifié par l'introduction dans son génome d'un gène d'une protéine fluorescente conférant des couleurs rouge, vert et orange clair.
- Tulle Hazelrigg, biologiste américaine, est la première à attacher la protéine fluorescente verte à d'autres protéines.
Liens externes
Notes et références
- Chimie : Le Nobel de la méduse fluo dans Libération du 8 octobre 2008.
- Prix Nobel de Chimie 2008 : une méduse fluorescente récompensée Un article École normale supérieure - DGESCO.
- Chalfie M, « GFP: Lighting up life », Proceedings of the National Academy of Sciences of the United States of America, vol. 106, no 25, , p. 10073-10080 (PMID 19553219, DOI 10.1073/pnas.0904061106).
- Mark R. Soboleski, Jason Oaks, and William P. Halford, « Green fluorescent protein is a quantitative reporter of gene expression in individual eukaryotic cells », The FASEB Journal, vol. 19, (PMID 15640280, DOI 10.1096/fj.04-3180fje).
- Yuste R, « Fluorescence microscopy today », Nature Methods, vol. 2, no 12, , p. 902–4 (PMID 16299474, DOI 10.1038/nmeth1205-902).
- Chudakov DM, Lukyanov S, Lukyanov KA, « Fluorescent proteins as a toolkit for in vivo imaging », Trends in Biotechnology, vol. 23, no 12, , p. 605–13 (PMID 16269193, DOI 10.1016/j.tibtech.2005.10.005).
- Remy S, Tesson L, Usal C, Menoret S, Bonnamain V, Nerriere-Daguin V, Rossignol J, Boyer C, Nguyen TH, Naveilhan P, Lescaudron L, Anegon I, « New lines of GFP transgenic rats relevant for regenerative medicine and gene therapy », Transgenic Research, vol. 19, no 5, , p. 745–63 (PMID 20094912, DOI 10.1007/s11248-009-9352-2).
- Kouros-Mehr H, Bechis SK, Slorach EM, Littlepage LE, Egeblad M, Ewald AJ, Pai SY, Ho IC, Werb Z, « GATA-3 links tumor differentiation and dissemination in a luminal breast cancer model », Cancer Cell, vol. 13, no 2, , p. 141–52 (PMID 18242514, PMCID 2262951, DOI 10.1016/j.ccr.2008.01.011).
- (en) J Voss-Andreae, « Protein Sculptures: Life's Building Blocks Inspire Art », Leonardo, vol. 38, , p. 41–45 (DOI 10.1162/leon.2005.38.1.41).
- (en) Alexander Pawlak, « Inspirierende Proteine », Physik Journal, vol. 4, , p. 12.
- (en) « Julian Voss-Andreae Sculpture » (consulté le ).
- Nature Biotechnology - 24, 1569 - 1571 (2006)
- Nature Biotechnology 24, 577 - 581 (2006)
- Nature Biotechnology 22, 1524 - 1525 (2004)
