Squamata
Les squamates (Squamata, du latin squama, « écaille », par allusion à leurs petites écailles épidermiques typiques et à leurs mues complètes, par desquamation) ou saurophidiens (« lézards/serpents ») sont un vaste ordre de vertébrés tétrapodes pourvus d'écailles qui comprend tous les lézards (au sens large), serpents, amphisbènes et mosasaures. Cet ordre regroupe des espèces qui changent régulièrement de peau (mue en lambeaux ou en un seul morceau, qui intervient plusieurs fois au cours de la période d'activité de ces animaux), ce qui exclut les Crocodiliens et les Tortues. Les squamates comprennent des vertébrés au corps allongé muni d'une longue queue, revêtus d'écailles cornées. Certaines espèces hivernent ou estivent. Leur régime alimentaire est varié selon les espèces : insectivore (arthropodes), carnivore (prédateurs opportunistes consommant des mammifères, reptiles, batraciens), herbivore (plantes)[1] ou fructivore (fruits). Ils pratiquent pour la plupart, soit la locomotion quadrupède, soit la reptation (liée à la perte secondaire des membres chez les serpents, les amphisbènes et certains lézards, résultant d'une convergence évolutive)[2].

| Règne | Animalia |
|---|---|
| Embranchement | Chordata |
| Sous-embr. | Vertebrata |
| Super-classe | Tetrapoda |
| Classe | Sauropsida |
| Sous-classe | Diapsida |
| Super-ordre | Lepidosauria |
Sous-ordres de rang inférieur


Jusqu'en 2000 le plus ancien fossile de squamate connu, Tikiguania estesi, remontait au Trias supérieur, plus précisément au Carnien (entre 229 et 216 millions d'années)[3] - [4]. En 2003 est décrit une nouvelle espèce, Megachirella wachtleri, fossile découvert au nord de l'Italie et surnommé « la mère des lézards » par les paléontologues, date de 240 Ma (Trias moyen, Ladinien), suggérant que la lignée des squamates pourrait remonter à 257 Ma (au Permien, soit 100 millions d'années après la sortie des eaux des tétrapodes)[5].
Étymologie
Le terme Squamate est issu du latin squama qui veut dire « écaille (de poisson) ; pellicule ». Ce terme est peut-être dérivé du terme germanique *skalja qui désignait les écailles, via la forme *scama[6]. Dans les langues d'Europe de l'Ouest, cette racine se retrouve d'une manière évidente dans les termes pour écaille, par exemple en danois : skæl, en anglais : scale, en italien : scaglia.
Caractères dérivés propres
Caractères dérivés propres (synapomorphies) aux Squamates[7] :
- perte de la barre temporale inférieure ce qui entraine l'ouverture de la fenêtre temporale inférieure
- l'os quadratojugal est perdu
- l'os carré est mobile (on parle de streptostylie)
Classification
C'est un clade qui compte 11 549 espèces actuelles répertoriées[8]. Il comprend également des taxons éteins comme les Polyglyphanodontia (en), les Mosasauroidea (reptiles marins prédateurs comme le célèbre Mosasaurus), les Dolichosauridae (proche parent des mosasaures) ou les Simoliophiidae (groupe éteint de serpents possédant des pattes postérieures).
N.B. : la systématique des reptiles et squamates étant en pleine mutation, les classifications proposées peuvent différer selon les sources et les moments.
Liste des familles actuelles
Selon The Reptile Database ():
- Sous-ordre Lacertilia* - Lézards au sens large :
- Infra-ordre Dibamia :
- Dibamidae Boulenger, 1884 ;
- Infra-ordre Diploglossa :
- Anguidae Gray, 1825 ;
- Anniellidae Boulenger, 1885 ;
- Diploglossidae Bocourt, 1873 ;
- Xenosauridae Cope, 1866 ;
- Infra-ordre Gekkota :
- Carphodactylidae Kluge, 1967 ;
- Diplodactylidae Underwood, 1954 ;
- Eublepharidae Boulenger, 1883 ;
- Gekkonidae Oppel, 1811 ;
- Phyllodactylidae Gamble et al., 2008 ;
- Pygopodidae Boulenger, 1884 ;
- Sphaerodactylidae Underwood, 1954 ;
- Infra-ordre Iguania :
- Agamidae Spix, 1825 ;
- Chamaeleonidae Rafinesque, 1815 ;
- Super-famille Iguanidae s.l. (Pleurodonta) :
- Corytophanidae Fitzinger, 1843 ;
- Crotaphytidae Smith & Brodie, 1982 ;
- Dactyloidae Fitzinger, 1843 ;
- Hoplocercidae Frost & Etheridge, 1989;
- Iguanidae Oppel, 1811 s.str.[9] ;
- Leiocephalidae Frost & Etheridge, 1989 ;
- Leiosauridae Frost et al., 2001 ;
- Liolaemidae Frost & Etheridge, 1989 ;
- Opluridae Moody, 1983 ;
- Phrynosomatidae Fitzinger, 1843 ;
- Polychrotidae Fitzinger, 1843 ;
- Tropiduridae Bell, 1843 :
- Infra-ordre Platynota (Varanoidea) :
- Helodermatidae Gray, 1837 ;
- Lanthanotidae Steindachner, 1878 ;
- Varanidae Hardwicke & Gray, 1827 :
- Super-famille Shinisauroidea :
- Shinisauridae Ahl, 1930 ;
- Infra-ordre Scincomorpha :
- Cordylidae Mertens, 1937 ;
- Gerrhosauridae Fitzinger, 1843 ;
- Lacertidae Oppel, 1811 ;
- Scincidae Gray, 1825 :
- Xantusiidae Baird, 1858 :
- Super-famille Gymnophthalmoidea :
- Alopoglossidae Pellegrino et al., 2001 ;
- Gymnophthalmidae Merrem, 1820 ;
- Teiidae Gray, 1827 ;
- Infra-ordre Dibamia :
- Sous-ordre Amphisbaenia - Amphisbènes :
- Amphisbaenidae Gray, 1865 ;
- Bipedidae Taylor, 1951 ;
- Blanidae Kearney, 2003 ;
- Cadeidae Vidal & Hedges, 2007 ;
- Rhineuridae Vanzolini, 1951 ;
- Trogonophidae Gray, 1865 ;
- Sous-ordre Serpentes - Serpents :
- Infra-ordre Alethinophidia :
- Aniliidae Stejneger, 1907 ;
- Bolyeriidae Hoffstetter, 1946 ;
- Tropidophiidae Brongersma, 1951 ;
- Xenophidiidae Wallach & Günther, 1998 ;
- Super-famille Acrochordoidea :
- Acrochordidae Bonaparte, 1831 ;
- Super-famille Booidea :
- Boidae Gray, 1825 ;
- Super-famille Colubroidea :
- Colubridae Oppel, 1811 ;
- Dipsadidae Bonaparte, 1838 ;
- Elapidae Boie, 1827 ;
- Homalopsidae Bonaparte, 1845 ;
- Lamprophiidae Fitzinger, 1843 ;
- Natricidae Bonaparte, 1838 ;
- Pareidae Romer, 1956 ;
- Pseudoxenodontidae McDowell, 1987 ;
- Viperidae Oppel, 1811 ;
- Xenodermidae Gray, 1849 ;
- Super-famille Pythonoidea :
- Loxocemidae Cope, 1861 ;
- Pythonidae Fitzinger, 1826 ;
- Xenopeltidae Bonaparte, 1845 ;
- Super-famille Uropeltoidea :
- Anomochilidae Cundall, Wallach & Rossman, 1993 ;
- Cylindrophiidae Fitzinger, 1843 ;
- Uropeltidae Müller, 1832 ;
- Infra-ordre Scolecophidia (Typhlopoidea) :
- Anomalepididae Taylor, 1939 ;
- Gerrhopilidae Vidal et al., 2010 ;
- Leptotyphlopidae Stejneger, 1892 ;
- Typhlopidae Merrem, 1820 ;
- Xenotyphlopidae Vidal et al., 2010.
- Infra-ordre Alethinophidia :
.jpg.webp) Orvet Anguis fragilis (Diploglossa)
Orvet Anguis fragilis (Diploglossa)_Ranomafana.jpg.webp) Gecko Phelsuma quadriocellata (Gekkota)
Gecko Phelsuma quadriocellata (Gekkota)_male.JPG.webp) Iguane Cyclura lewisi (Iguania)
Iguane Cyclura lewisi (Iguania) Lézard Lacerta viridis (Scincomorpha)
Lézard Lacerta viridis (Scincomorpha) Varan Varanus komodoensis (Varanoidea)
Varan Varanus komodoensis (Varanoidea) Amphisbènes Amphisbaena alba (Amphisbaenia)
Amphisbènes Amphisbaena alba (Amphisbaenia) Serpent Ophiophagus hannah (Alethinophidia)
Serpent Ophiophagus hannah (Alethinophidia) Serpent aveugle Rhinotyphlops schinzi (Scolecophidia)
Serpent aveugle Rhinotyphlops schinzi (Scolecophidia)
Phylogénie
Phylogénie externe
 |
 | |
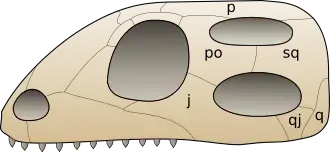
Crâne de type diapside fondamental (à gauche) et dérivé de ce type (crâne de squamate à droite). Chaque surface latérale est pourvue d'ouvertures : une fosse nasale, une grande fosse orbitaire et une paire de fosses temporales superposées[12]. Légende : j : os jugal ; p : os pariétal ; po : os postorbitaire ; sq : os temporal ; q : os carré ; qj : os quadratojugal. L'arcade ou barre temporale supérieure est formée des os po et sq. L'arcade ou barre temporale inférieure des os j et qj. | ||
Les squamates sont des reptiles diapsides particuliers (du grec δι- / di-, « double » et ἀψίς / apsis, « orbite ou arche », en référence au crâne qui possède fondamentalement deux paires de fosses temporales donc deux arcades), dans la mesure où la fosse temporale inférieure de leur crâne est ouverte ventralement par rupture de la barre temporale inférieure et perte de l'os quadratojugal (type Saurien dérivé du type diapside fondamental). Chez les serpents, le type Ophidien correspond à la rupture des deux barres supérieure et inférieure, ce qui entraîne la fusion des deux fosses, si bien qu'elles ne sont plus observables individuellement[13]. La rupture de l'arcade inférieure (arc jugalo-quadrato-jugal) a libéré l'os carré, qui est devenu mobile relativement au crâne (processus appelé streptostylie ou streptostylisme). Associé à diverses modalités du cinétisme intra-crânien (os crâniens articulés et coulissant entre eux), ce processus accroît l'angle d'ouverture de la mandibule (qui peut pivoter jusqu'à la verticale), ce qui facilite la capture et la déglutition de proies de très forte taille relativement au prédateur. Cette stratégie adaptative culmine chez les serpents macrostomates[14] (littéralement « à grande bouche », par exemple les pythons et les boas) développement lié au grand allongement du carré qui est devenu une baguette très mobile[15].
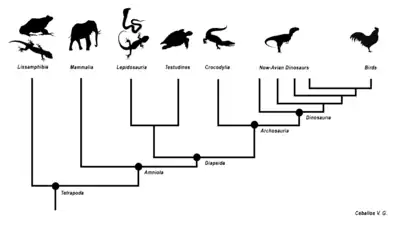
| Amniota |
| ||||||||||||||||||||||||||||||
Phylogénie interne
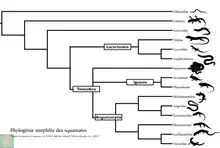
La phylogénomique a montré que le sous-ordre Lacertilia est paraphylétique. De plus les amphisbènes ne forment pas une branche totalement distincte mais sont sur la même branche que des familles comme les lacertidés ou les téidés.
Phylogénie des familles actuelles de squamates (hors serpents) d'après Wiens et al., 2012[17] et Zeng et Wiens, 2016[18] :
- Squamata
- Dibamia
- Bifurcata
- Gekkota
- Pygopodomorpha
- Gekkomorpha
- Eublepharidae
- Gekkonoidea
- Unidentata
- Scinciformata
- Scincomorpha
- Cordylomorpha
- Episquamata
- Laterata
- Teiformata
- Lacertibaenia
- Lacertiformata
- Amphisbaenia
- Toxicofera (en)
- Ophidia
-
- Anguimorpha
- Palaeoanguimorpha
- Shinisauria
- Varanoidea
- Neoanguimorpha
- Helodermatoidea
-
- Xenosauroidea
- Anguioidea
- Palaeoanguimorpha
- Iguania
- Anguimorpha
- Laterata
- Scinciformata
- Gekkota
Notes et références
- L'iguane marin des Galapagos broute des algue en plongée.
- Guillaume Lecointre, Hervé Le Guyader, Classification phylogénétique du vivant, Belin, , p. 375.
- (en) Mark N. Hutchinson, Adam Skinner et Michael S. Y. Lee1, « Tikiguania and the antiquity of squamate reptiles (lizards and snakes) » [« Tikiguania et l'antiquité des reptiles squamates (lézards et serpents) »], Biology Letters, vol. 8, no 4, , p. 665-669 (DOI 10.1098/rsbl.2011.1216, lire en ligne [PDF]).
- (en) P. M. Datta & S. Ray (2006). Earliest lizards from the Late Triassic (Carnian) of India. Journal of Vertebrate Paleontology 26 (4) : 795–800. doi:10.1671/0272-4634(2006)26[795:ELFTLT]2.0.CO;2.
- (en) Tiago R. Simões, Michael W. Caldwell, Mateusz Tałanda, Massimo Bernardi, Alessandro Palci et al., « The origin of squamates revealed by a Middle Triassic lizard from the Italian Alps », Nature, vol. 557, , p. 706-709 (DOI 10.1038/s41586-018-0093-3).
- Informations lexicographiques et étymologiques de « Squamate » dans le Trésor de la langue française informatisé, sur le site du Centre national de ressources textuelles et lexicales.
- Guillaume Lecointre et Hervé Le Guyader, Classification phylogénétique du vivant. Tome 2, Belin, dl 2017 (ISBN 978-2-410-00385-7 et 2-410-00385-0, OCLC 987914329, lire en ligne), p. 472
- (en) Peter Uetz, « Species Numbers (as of December 2022) », sur THE REPTILE DATABASE, (consulté le )
- Sensu stricto (ou stricto sensu) est une locution latine qui signifie au sens strict et dont l'abréviation est s.str.. En biologie, cette locution indique qu'un taxon doit être pris au sens strict.
- Fenestration latérale du toit dermique (bouclier osseux recouvrant le neurocrâne endochondral) par écartement des os existant. Les deux paires de fosses temporales (supérieures et inférieures) sont séparées des orbites par la barre orbitaire (post-orbitaire et jugal).
- Fenestration latérale du toit dermique (bouclier osseux recouvrant le neurocrâne endochondral) par écartement des os existant. Les deux paires de fosses temporales (supérieures et inférieures) sont séparées des orbites par la barre orbitaire (post-orbitaire et jugal).
- Fenestration latérale du toit dermique (bouclier osseux recouvrant le neurocrâne endochondral) par écartement des os existant. Les deux paires de fosses temporales (supérieures et inférieures) sont séparées des orbites par la barre orbitaire (post-orbitaire et jugal).
- André Beaumont, Pierre Cassier, Daniel Richard, Biologie animale. Les Cordés : anatomie comparée des vertébrés, Dunod, , p. 179.
- Par oppoition à une minorité de microstomates, serpents à la « bouche petite », généralement fouisseurs et insectivores (Scolecophidiens.
- (en) Michael S. Y Lee, Gorden L. Bell, Michael W. Caldwell, « The origin of snake feeding », Nature, vol. 400, no 6745, , p. 655–659 (DOI 10.1038/23236)
- (en) Peter Uetz, « Species Numbers (as of December 2022) », sur THE REPTILE DATABASE, (consulté le )
- (en) J. J. Wiens, C. R. Hutter, D. G. Mulcahy, B. P. Noonan, T. M. Townsend, J. W. Sites et T. W. Reeder, « Resolving the phylogeny of lizards and snakes (Squamata) with extensive sampling of genes and species », Biology Letters, vol. 8, no 6, , p. 1043–1046 (PMID 22993238, PMCID 3497141, DOI 10.1098/rsbl.2012.0703)
- (en) Yuchi Zheng et John J. Wiens, « Combining phylogenomic and supermatrix approaches, and a time-calibrated phylogeny for squamate reptiles (lizards and snakes) based on 52 genes and 4162 species », Molecular Phylogenetics and Evolution, vol. 94, , p. 537–547 (DOI 10.1016/j.ympev.2015.10.009, lire en ligne)Arbre sur le site RDB
Voir aussi
Articles connexes
Liens externes
- (en) Référence Animal Diversity Web : Squamata
- (en) Référence Fauna Europaea : Squamata (consulté le )
- (en) Référence Paleobiology Database : Squamata Oppel, 1811 (consulté le )
- (fr+en) Référence ITIS : Squamata Oppel, 1811
- (en) Référence NCBI : Squamata (taxons inclus)
- (en) Référence Tree of Life Web Project : Squamata
- (en) Référence World Register of Marine Species : taxon Squamata Oppel, 1811 (+ liste espèces)