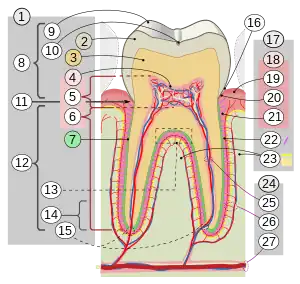
Émail dentaire
L'émail est une structure minéralisée d'origine épithéliale qui recouvre la couronne dentaire des vertébrés actuels et fossiles afin de la protéger des différentes agressions. L'amélogenèse (ou formation de l'émail) est assurée par les améloblastes (en), cellules sécrétrices qui sont détruites lors de l'éruption de la dent dans la cavité buccale. L'émail ne pouvant se régénérer en cas d'altération, est doté par compensation d'une organisation tridimensionnelle complexe et d'un fort degré de minéralisation, qui en fait la structure la plus dure et résistante de l'organisme, d'où son intérêt en médecine légale et en paléontologie. L'émail est la structure dentaire (et non le tissu car celui ci n'est pas vascularisé, ni innervé mais minéralisé, bien que très souvent même en clinique on parle de tissu amélaire)[1] normalement visible, supporté par une couche sous-jacente de dentine. Avec la dentine, le cément et la pulpe dentaire, il constitue un des quatre principaux tissus qui constituent la dent.
L'émail est composé de trois phases : la phase minérale représente 93-96 % en poids[2], la phase organique 0,4-5 %[3] et la phase aqueuse 3-7 % (le %age d'eau étant en moyenne de 12 % pour la dentine et 33 % pour l'os)[4]. Sa partie minérale est principalement composée d'un réseau de cristaux d'hydroxyapatite (Ca10(PO4)6(OH)2). Le fort pourcentage de minéraux dans l'émail est responsable non seulement de sa rigidité et de sa dureté supérieure au tissu osseux, mais aussi de sa friabilité. La dentine, qui est moins minéralisée et moins friable, est indispensable comme support et compense les faiblesses de l'émail.
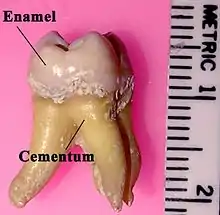
cementum = cément
La couleur de l'émail va du jaune au gris clair. Comme l'émail est semi-translucide et opalescent, la couleur jaune orangée de la dentine (ou de tout matériau de réparation dentaire) sous l'émail affecte fortement l'apparence de la dent.
L'émail varie en épaisseur sur la surface de la dent. Il est plus épais au niveau du sommet de la couronne dentaire (plus de 2,5 mm) et plus mince sur la jonction émail-cément (JEC).
Contrairement au cément et aux os, la matrice organique de l'émail ne contient pas de collagène ni de kératine ; elle possède à la place des glycoprotéines riches en tyrosine (amélogénines, énamélines (en), tuftelines (en)…) dont le rôle est, pense-t-on, d'aider à la croissance de l'émail en servant de cadre de construction, entre autres fonctions. Cette matrice organique contient aussi des polysaccharides.
L'épaisseur, la composition isotopique de l'émail[5] et l'analyse de la micro-usure dentaire observée à l'échelle microscopique sur l'émail permet aux paléontologues de détecter des différences en fonction de la composition du régime alimentaire des vertébrés[6].
Structure
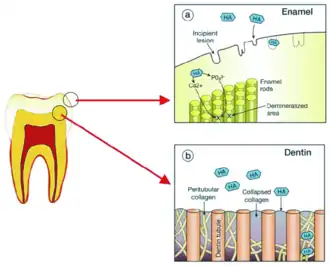
L'émail est la substance la plus dure du corps humain[7]. Surtout composé de phosphate de calcium et de carbonate de calcium, comprenant moins de 1 % de matières organiques[7], il a une organisation tridimensionnelle complexe, formée par la juxtaposition de structures élémentaires appelées cordons, bâtonnets ou prismes d'émail. Chaque prisme minéralisé de 4 à 8 µm de diamètre traverse l'émail, de la jonction émail-dentine jusqu'à la surface de la dent[8].


Ces prismes sont des cristaux d'hydroxyapatite entourés par une gaine de nature organique, imbriqués les uns dans les autres. En coupe transversale, ils ressemblent à un trou de serrure, avec la partie supérieure orientée vers la couronne de la dent et la base orientée vers la racine.
La disposition des cristaux à l'intérieur de chaque prisme est très complexe. Les améloblastes (en) (ou adamantoblastes), cellules qui initient la formation de l'émail, et les prolongements de Tomes influent tous les deux sur la forme des cristaux. Les cristaux d'émail de la tête du prisme sont orientés parallèlement au grand axe de ce dernier alors que ceux de la base divergent légèrement du grand axe.
L'arrangement dans l'espace des prismes d'émail est compris plus clairement que leur structure interne. Les prismes d'émail sont situés en rang le long de la dent, et à l'intérieur de chaque rang, le grand axe du prisme est généralement perpendiculaire à la dentine sous-jacente. Dans les dents définitives, les prismes d'émail proches de la jonction émail-cément (JEC) basculent légèrement vers la racine de la dent.
La zone située autour du prisme d'émail est constituée d'émail interprismatique. Ce dernier a la même composition que l'émail en prisme ; on fait cependant une distinction histologique entre les deux car l'orientation des cristaux est différente dans chaque cas. La limite où les cristaux d'émail prismatique et les cristaux d'émail interprismatique se touche est appelée gaine prismatique.
L'étude des caractéristiques des microstructure de l'émail dentaire (stries de Retzius, bandes de Hunter-Schreger) permet d'évaluer les modalités du développement dentaire. Les stries de Retzius (en) sont des bandes qui apparaissent sur l'émail quand il est observé en coupe transversale au microscope. Formées par la variation du diamètre des prolongements de Tomes, ces bandes attestent de la croissance de l'émail de façon similaire aux anneaux de croissance d'un arbre. Les perikymaties sont des sillons peu profonds correspondants à la ligne formée par les stries de Retzius à la surface de l'émail. Plus sombre que les autres bandes, la ligne néonatale sépare l'émail formé avant et après la naissance. Les bandes de Hunter-Schreger (en) sont marquées par la succession de bandes parallèles transversales claires (parazonies) et sombres (diazonies) dues à l'orientation des prismes dans la coupe.
Développement
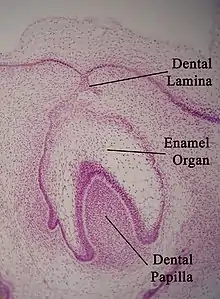
La formation de l'émail est l'une des étapes du processus global de formation d'une dent. Quand on observe les tissus de la dent en développement au microscope, on peut distinguer différents amas de cellules, comme l'organe adamantin (Enamel organ), la lame dentaire et la papille dentaire. Les étapes généralement reconnues du développement de la dent sont le stade bourgeon, le stade capuchon, le stade cloche et le stade couronne (ou de calcification). L'émail en formation n'est visible qu'à partir du stade couronne.
On sait depuis le milieu des années 1930 que La phase minérale primaire [~ 96% en poids (% en poids)] de l'émail est constituée de cristaux de carbonate d'apatite fluorés non stoechiométriques[11] - [12] dont les arrangements cristallins très particuliers assurent à la dent une grande résistance aux chocs et à l'usure [13] - [14].
L'amélogenèse (ou formation de l'émail) a lieu après le début de l'apparition de la dentine, grâce à des cellules appelées améloblastes. L'émail humain se forme à un taux d'environ 4 µm par jour, débutant au niveau de la future localisation des cupsides de la dent, au 3e ou 4e mois de grossesse environ. La création de l'émail est complexe, et se déroule en deux étapes intimement reliées : 1) le stade sécrétoire, qui implique des protéines et une matrice organique formant un émail qui se minéralise immédiatement (émail partiellement minéralisé, 30 %) ; 2) un stade de maturation, qui implique le retrait de cette matrice suivi d'une déposition minérale accrue[15].
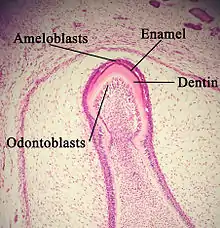
Stade sécrétoire
Les améloblastes sont des cellules polarisées en forme de colonne. Les protéines de l'émail sont produites au niveau du reticulum endoplasmique granuleux de ces cellules, puis relâchée dans le milieu extracellulaire où elles forment ce que l'on appelle la matrice de l'émail. Cette matrice sera alors partiellement minéralisée par une enzyme, la phosphatase alcaline. Quand cette première couche est formée, les améloblastes s'éloignent de la dentine, permettant le développement des prolongements de Tomes sur la partie apicale de la cellule. La formation de l'émail continue autour des améloblastes adjacents (ce qui induit la création d'une surface cloisonnée, ou « puits », qui abrite les prolongements de Tomes) et aussi autour de l'extrémité de chaque prolongement de Tomes (ce qui induit le dépôt d'une matrice de l'émail à l'intérieur de chaque puits). La matrice à l'intérieur du puits deviendra à terme le prisme d'émail, et les cloisons deviendront à terme l'émail interprismatique. Le seul facteur de distinction entre les deux est l'orientation des cristaux d'hydroxyapatite.

en=émail
d=dentine
od=odontoblates
p=papille dentaire
Stade de maturation
les améloblastes transportent des substances utilisées dans la formation de l'émail. L'aspect le plus notable de cette phase au niveau tissulaire est que ces cellules deviennent striées, ou ont une bordure ondulée. Ceci prouve que les améloblastes ont changé leur fonction : de productrice (cf la phase de sécrétion), elles deviennent transporteuses. Les protéines utilisées pour le processus final de minéralisation composent la majorité du matériel transporté. Les protéines impliquées les plus notables sont les amélogénines, améloblastines, enamélines et « tuft proteins ». Pendant ce processus, les amélogénines et améloblastines sont éliminées après usage, mais les énamélines et « tuft proteins » sont laissées dans l'émail. À la fin de cette phase, la minéralisation de l'émail est achevée.
En fin de maturation, avant que la dent apparaisse dans la bouche, les améloblastes se décomposent.
Par conséquent l'émail, contrairement à la plupart des autres tissus du corps, n'a aucun moyen de se renouveler. Après une destruction de l'émail par action des bactéries ou par blessure, ni l'organisme, ni le dentiste ne pourront réparer le tissu de l'émail. L'émail peut de plus être affecté par des processus non pathologiques. La coloration des dents avec le temps peut résulter de l'exposition à des substances telles que le tabac, le café et le thé, mais la couleur de la dent peut aussi s'assombrir graduellement avec l'âge. En effet, l'assombrissement est en partie dû aux matériaux qui s'accumulent au niveau de l'émail, mais est aussi un des effets de la sclérotisation de la dentine sous-jacente. En outre, l'émail devient avec l'âge moins perméable aux fluides, moins soluble dans l'acide, et contient moins d'eau.
| Taux d'émail formé à la naissance | Achèvement de la minéralisation de l'émail | ||
|---|---|---|---|
| Dents Maxillaires Primaires |
Incisive centrale | ⅚ | 1,5 mois après la naissance |
| Incisive latérale | ⅔ | 2,5 mois après la naissance | |
| Canine | ⅓ | 9 mois après la naissance | |
| Prémolaire | Cuspides réunies; émail occlusal complètement minéralisé ; le tissu minéralisé couvre ½ à ¾ de la hauteur de la couronne |
6 mois après la naissance | |
| Molaire | Cuspides réunies; émail occlusal incomplètement minéralisé ; le tissu minéralisé couvre ⅕ à ¼ de la hauteur de la couronne |
11 mois après la naissance | |
| Dents Mandibulaires Primaires |
Incisive centrale | ⅗ | 2,5 mois après la naissance |
| Incisive latérale | ⅗ | 3 mois après la naissance | |
| Canine | ⅓ | 9 mois après la naissance | |
| Prémolaire | Cuspides réunies; émail occlusal complètement minéralisé | 5,5 mois après la naissance | |
| Molaire | Cuspides réunies; émail occlusal incomplètement minéralisé |
10 mois après la naissance | |
Destruction
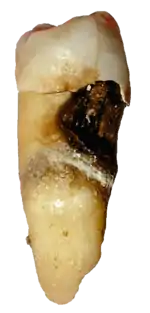
Carie dentaire
La haute teneur en minéral de l'émail, qui fait de ce tissu le plus dur de tous les tissus humains, le rend aussi susceptible de subir un processus de déminéralisation qui survient souvent sous forme de carie dentaire.
La déminéralisation peut avoir plusieurs causes. La cause principale des caries est une alimentation riche en sucres simples (bonbons, boissons sucrées et même des jus de fruits). La bouche contient un grand nombre et une grande variété de bactéries, et quand le glucose et le saccharose, les plus communs des sucres alimentaires se solubilisent dans le biofilm bactérien qui couvre la surface des gencives et des dents, certaines bactéries buccales interagissent avec lui pour former de l'acide lactique, qui diminue le pH dans la bouche. Les cristaux d'hydroxyapatite de l'émail sont alors déminéralisés, permettant une invasion bactérienne plus importante et plus en profondeur dans la dent.
La bactérie la plus impliquée dans la carie dentaire est Streptococcus mutans, mais le nombre et les espèces de bactéries varient en fonction de la progression de la destruction dentaire.
La morphologie dentaire fait que la carie dentaire apparait dans des entailles, trous et fissures de l'émail ; les endroits les plus difficiles à atteindre avec une brosse à dents, où les restes de nourriture s'accumulent plus facilement. Quand la déminéralisation de l'émail a lieu, un dentiste peut utiliser un instrument pointu, comme un crochet de dentiste, et sentir que « ça accroche » à l'emplacement de la carie. Si rien n'est fait, l'émail se déminéralise jusqu'à la dentine sous-jacente, qui est alors, elle aussi dégradée. Quand la dentine, qui supporte l'émail en temps normal, est détruite par une carie ou autre souci de santé, l'émail est incapable de suppléer à sa friabilité et se détache facilement de la dent.
La cariogénicité (capacité à provoquer des caries dentaires) d'un aliment dépend de différents facteurs, comme par exemple la durée pendant laquelle les sucres restent dans la bouche. Ce n'est pas la quantité de sucre ingéré, mais la fréquence de l'ingestion de sucre qui est le principal facteur responsable des caries. Quand le pH dans la bouche diminue par ingestion de sucre, l'émail se déminéralise et reste vulnérable pendant 30 minutes environ. Ainsi, manger une grande quantité de sucre une seule fois dans la journée est moins néfaste (pour les dents) qu'en prendre de très petite quantité à de nombreuses reprises tout au long de la journée (en matière de santé buccale, il vaut mieux manger un seul dessert au diner, avant un brossage de dents que de manger des friandises dans la journée).
Bruxisme

Outre les invasions bactériennes, l'émail est soumis à d'autres forces destructrices. Le bruxisme (grincement de dent compulsif) détruit l'émail très rapidement. Le taux d'usure de l'émail, appelé attrition, est de 8 µm par an en temps normal. C'est une erreur commune de croire que l'émail s'use principalement par mastication. En fait, les dents se touchent rarement pendant la mastication. De plus, le contact normal des dents est compensé physiologiquement par le ligament périodontal et la disposition des dents quand la bouche est fermée. Les forces réellement destructrices sont les mouvements de parafonction (tels que la succion qu'elle soit digitale (le plus souvent le pouce) ou d'un objet (tétine ou linge), ou le bruxisme), qui peuvent causer à l'émail des dommages irréversibles.
Autres causes de destruction de l'émail
Les autres processus de destruction non-bactérienne de l'émail comprennent l'abrasion (par des éléments étrangers comme les brosses à dent, ou les épingles ou tuyaux de pipe tenus entre les dents), l'érosion (par des processus chimiques faisant intervenir des acides, par exemple l'action du jus de citron ou le suc gastrique lorsqu'il remonte l'œsophage), et parfois l'abfraction (par des forces de compression ou de tension).
Hygiène buccale et fluor
Nettoyage des dents
L'émail est donc très vulnérable face à la déminéralisation, et les attaques consécutives à l'ingestion de sucre sont quotidiennes. Ainsi, la santé dentaire passe essentiellement par des méthodes préventives visant à réduire la présence de débris alimentaires et de bactéries en contact avec l'émail. On utilise pour cela dans la plupart des pays la brosse à dent, qui réduit le nombre de bactéries et de particules alimentaires sur l'émail. Quelques sociétés isolées n'ayant pas accès à ce genre de matériel utilisent d'autres objets, comme des morceaux de bois fibreux ou pointus, pour le nettoyage des dents. Pour nettoyer la surface de l'émail entre deux dents adjacentes, on peut utiliser du fil dentaire. Ni la brosse à dent, ni le fil dentaire ne peuvent atteindre les creux microscopiques de l'émail, mais de bonnes habitudes d'hygiène buccale et une alimentation pauvre en sucres rapides empêchent généralement suffisamment le développement de la population bactérienne et donc l'apparition de caries dentaires.
Email et fluor
Le fluor se trouve naturellement dans l'eau, mais à des taux très variables. Il est aussi présent dans tous les aliments d'origine marine (poissons, fruits de mer, sel de mer etc.). Le taux de fluor recommandé dans l'eau de boisson est de 1 ppm (partie par million). Le fluor aide à la prévention des caries en se liant aux cristaux d'hydroxyapatite de l'émail, ce qui rend ce dernier plus résistant à la déminéralisation, et donc plus résistant à l'apparition des caries. Cependant, un excès de fluor peut être problématique en provoquant des troubles appelés fluorose dentaire. La fluorose est donc une surexposition au fluor, surtout entre 6 mois et 5 ans, et se manifeste par l'apparition de taches sur les dents. L'aspect des dents devient alors moins esthétique, même si l'incidence des caries sur ce genre d'émail est très faible. Pour éviter ce problème, on peut utiliser des filtres dans les zones où le taux de fluor dans l'eau du robinet est trop élevé afin de le réduire. Le taux de fluor est considéré comme toxique lorsqu'il dépasse 0,05 mg de fluor par kg de masse corporelle. Le fluor ajouté dans les pâtes dentifrice ou les bains de bouche ne semble avoir qu'un effet limité aussi bien sur la fluorose que sur la prévention des caries. Il semble que seul le fluor ingéré dans l'eau ou le sel fluoré puisse avoir une action réelle, qu'elle soit positive ou négative ; seule la surface de l'émail est atteinte par le fluor des pâtes dentifrice.
Salive
La salive a un rôle protecteur sur l'émail. Elle contient plusieurs éléments protecteurs, régulateurs, agissant individuellement ou s’organisant en véritables systèmes de défense contre les bactéries, mais aussi en apportant des ions nécessaires à la re-minéralisation de la dent, lorsque celle-ci n'est pas trop abîmée.
Effet des techniques dentaires
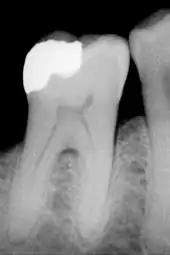
Réparation dentaire
De nombreuses réparations dentaires nécessitent d'enlever au moins une partie de l'émail. Généralement, le but de cette pratique est d'accéder aux couches sous-jacentes infectées, comme la dentine ou la pulpe dentaire, par exemple dans le cas d'une odontologie conservatrice, d'une endodontie ou de l'installation d'une couronne. L'émail peut aussi avoir disparu avant toute apparition de carie (voir #Destruction).
Mordançage à l’acide
Inventée en 1955, cette technique emploie un mordant dentaire. Elle est couramment utilisée en odontologie conservatrice. En dissolvant les minéraux de l'émail, le mordant enlève 10 µm de la surface de l'émail et implique la création d'une couche poreuse de 5 à 50 µm de profondeur. Ceci rend l'émail rugueux au niveau microscopique et augmentera l'adhérence des matériaux utilisés pour la réparation dentaire nécessitant des collages (composite dentaire).
Les effets du mordançage varient en fonction de la durée de son application, du type de mordant utilisé, et de l'état de l'émail sur lequel le mordançage est appliqué. On pense aussi que les résultats obtenus varieraient en fonction de l'orientation des cristaux de l'émail.
Blanchiment dentaire
Note : on rencontre aussi le terme « blanchissement » malgré son sens habituel passif (blanchissement des cheveux).
Maladies, polluants ou médicaments affectant la qualité de l'émail
- chez les très jeunes enfants, certains médicaments acides semblent pouvoir attaquer l'émail dentaire encore immature[17] ;
- chez les très jeunes enfants, des phénomènes de reflux gastro-œsophagien peuvent aussi dégrader l'émail[18] ;
- chez les enfants de moins de 8 ans, certains médicaments anti-acnéiques peuvent aussi poser des problèmes de dyschromie et d'hypoplasie de l'émail dentaire (résumé)[19] ;
- l'amoxicilline peut induire une dyschromie de l'émail dentaire[20] ;
- certains perturbateurs endocriniens inhibent aussi la minéralisation de l'émail dentaire (hypominéralisation), ce qui est source d'anomalies de colorations des dents (15 à 18% des enfants de 6 à 9 ans sont touchés par ce phénomène qui semble en augmentation) et d'une hypersensibilité dentaire (risque accru de caries)[21].
Parmi les hypothèses évoquées concernant les sources de perturbateurs figurent notamment un apport de Bisphénol A (BPA) à partir des résines dentaires ; des traces en sont effectivement retrouvées dans la salive, au moins pour 5 types de résines testées in vitro et in vivo (étude 2017) et avec un pic de relarguage 30 mois après la liaison avec la dent cariée, et avec des taux de relarguage variant selon la marque du composites orthodontiques. Les flux restent inférieurs à la dose de référence pour l'ingestion quotidienne[22] (mais cette dose est discutée). Des perturbateurs endocriniens peuvent aussi être présents dans les dentifrices (facilement avalés par les enfants ou mal rincés)[21].
Le BPA a une action démontrée sur l’amélogenèse (formation de l'émail) chez le rat de laboratoire qui développe des taches opaques jaunes à blanches sur l'émail dentaire lorsqu'exposé au BPA, peut être via une action hormonale sur les améloblastes (cellules qui génèrent l'émail)[21])[23] - [24].
Le BPA pourrait perturber l'élimination des protéines de la matrice dentaire (88) et il affecte les glandes salivaires en induisant une sécheresse buccale pouvant nuire à la durabilité de l'émail[21].
Prospective
L'émail mature est biogénique (produit par le vivant) mais pas vivant ; il est acellulaire et ne se répare donc pas spontanément après des dommages[25], ce qui explique que la carie dentaire est l’une des maladies chroniques les plus répandues chez l’homme[26].
Toutes les stratégies et essais de reminéralisation de l'émail ont échoué (minéralisation directe en solution, avec EDTA[27] - [28]), minéralisation induite par les protéines / peptides (15-17), minéralisation induite par un hydrogel[29],S. Busch (2004) Regeneration of human tooth enamel. Angew. Chem. Int. Ed. 43, 1428–1431) ou par autoassemblage cristallin à partir d'un précurseur plus ou moins bioinspiré[30]. La structure hiérarchique microscopique complexe de l’émail naturel ne peut pas encore être reproduite à grande échelle, même en laboratoire.
On sait produire à haute température des céramiques très dures, ayant l'apparence de l'émail, mais le phénomène de biominéralisation de l'émail dit amélogenèse, bien que très courant dans la Nature commence à peine à être compris[14]. Il l'est du point de vue physicochimique et théorique, mais la qualité des matériaux naturels peinent encore à être reproduit in vitro et encore plus in vivo. En particulier, régénérer l'apatite dans la structure complexe et bien alignée qu'elle prend dans l'émail dentaire (doté d'une dureté et de performances mécaniques exceptionnelles) est encore un défi biotechnologique qui intéresse notamment la biomimétique. On ignore encore comment les microstructures des matériaux naturels durs biogéniques (dents, griffes, corne, nacre et certaines coquilles de mollusques) sont contrôlées et dupliquées avec autant de précision[31].
Jusqu'en 2018, le motif cristallin auto-assemblé qui rend l'émail si solide n'avait jamais pu être reproduit artificiellement. Récemment un matériau composé d'agrégats d'ions phosphate de calcium a été utilisé avec succès pour produire une couche d'un élément précurseur, qui a induit une croissance cristalline épitaxiale telle qu'on la trouve dans l'apatite dentaire, imitant la frontière cristalline-amorphe de la biominéralisation de ce tissu ultra-dur, telle qu'elle se produit dans la nature[32].
De l’émail endommagé a ainsi pu être complètement réparé (avec des propriétés mécaniques a priori identiques à celles de l’émail naturel)[32].
L'hydroxyapatite (HAP) de formule Ca10(PO4)6(OH)2 est le modèle minéral simplifié le plus utilisé pour l'étude de la formation et de la reconstruction de l'émail[33] - [34] - [35] - [36].
La biominéralisation s'effectue dans un contexte cristallin-amorphe : avec une phase amorphe (précurseur) assurant une construction épitaxiale continue[37] - [38] - [39] - [40] ce processus a récemment inspiré une structure rationnelle entre l'hydroxyapatite (HAP) et le phosphate de calcium amorphe (ou « PCA », dont la formule est Ca3(PO4)2nH2O ; aussi retrouvé comme précurseur pour la formation d'os ou d'arêtes de poissons[41]), qui peut imiter la biominéralisation et induire la régénération épitaxiale de l'émail[32]. La croissance épitaxiale programmée, basée sur une transformation de phase, semble prometteuse pour la régénération de l'émail, voire au delà pour la reproduction biomimétique de matériaux à structure complexe[32]. Cependant, la croissance épitaxiale de l'émail avec une phase étrangère de phosphate de calcium amorphe étrangère n'a pas été réalisée in vitro[32] et pour une application clinique en dentisterie, il faudrait aussi développer une méthode pour l'appliquer sur les dents en place.
Émail chez les animaux
De nombreux animaux ont des dents d'une grande dureté et/ou très coupante (requin, castor). Les dents comptent parmi les restes qui se conservent le mieux dans le temps ; elles sont utilisées par les archéologues et paléontologues pour identifier et dater des restes humains et animaux parfois très anciens. On y retrouve parfois de l'ADN en assez bon état pour être analysé.
Voir aussi
Bibliographie et sources
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Tooth enamel » (voir la liste des auteurs).
- CHU-ps :Histologie : organes, systèmes et appareils
- Congrès de l'Association Dentaire Française
- Faculté de chirurgie dentaire de Toulouse
- Michael H. Ross, Gordon I. Kaye, and Wojciech Pawlina, Histology: a Text and Atlas, 4th ed. (Baltimore: Lippincott Williams & Wilkins, 2002)
- A. R. Ten Cate, Oral Histology: Development, Structure, and Function, 5th ed. (Saint Louis: Mosby-Year Book, 1998)
- Biology of the Human Dentition
- American Dental Hygienists' Association
- James B. Summitt, J. William Robbins, and Richard S. Schwartz, eds., Fundamentals of Operative Dentistry: A Contemporary Approach, 2nd ed. (Carol Stream, IL: Quintessence Publishing, 2001)
- Major M. Ash and Stanley Nelson, Wheeler’s Dental Anatomy, Physiology, and Occlusion 8th ed. (Philadelphia: W.B. Saunders Co., 2003)
- Brown, LeMay, Burslen, Chemistry The Central Science, (ISBN 0-13-048450-4)
- "Dental Health", British Nutrition Foundation website
- Definitions of Tooth Surface Loss.
- Dean, Arnold, and Elvove, « Domestic water and dental caries », Public Health Reports 52, no. 32 (1942): 1155–79.
- E. Newbrun, Fluorides and dental caries (Springfield, IL: Charles C. Thomas publisher, 1986).
- Edward F. Harris « X-Linked Inheritance », Craniofacial Growth and Development 2002
- Frandson et al., Anatomy and Physiology of Farm Animals, 5th ed. (Baltimore: Lippincott Williams & Wilkins, 1992)
- Chris C. Pinney, The Illustrated Veterinary Guide for Dogs, Cats, Birds, and Exotic Pets (Blue Ridge Summit, PA: TAB Books, 1992)
- Fejerskov : Human dentition and experimental animals
Référence
- Michel E. Chateau, Orthopédie dento-faciale, éditions CdP, , p. 87
- 87-91 % en volume
- 2 %.
- (en) Juan de Dios Teruel, Alberto Alcolea, Ana Hernández, Antonio José Ortiz Ruiz, « Comparison of chemical composition of enamel and dentine in human, bovine, porcine and ovine teeth », Arch Oral Biol, vol. 60, no 5, , p. 768-775 (DOI 10.1016/j.archoralbio.2015.01.014).
- La teneur en isotopes stables du carbone et de l'azote reflète notamment le type de plantes consommées (à photosynthèse en C3 ou en C4) et le niveau trophique. L'isotope du Zinc 66Zn est également un indicateur du régime alimentaire, permettant de distinguer les carnivores des herbivores (et encore plus finement les brouteurs des pâtureurs). cf. (en) Klervia Jaouen et al, « Zinc isotope ratios of bones and teeth as new dietary indicators: results from a modern food web (Koobi Fora, Kenya) », Scientific Reports, vol. 6, no 26281, (DOI 10.1038/srep26281).
- (en) P. S. Ungar, R. S. Scott, J. R. Scott, M. F. Teaford, « Dental microwear analysis: Historical perspectives and new approaches », In : J. D. Irish and G. C. Nelson (Eds.), Technique and application in dental anthropology, 2008, p. 389–425.
- Le Corps Humain : comprendre notre organisme et son fonctionnement, Québec Amérique, coll. « Guides de la connaissance », , 128 p. (lire en ligne), p. 107.
- (en) Guy Daculsi, Bertrand Kerebel, « High-resolution electron microscope study of human enamel crystallites: Size, shape, and growth », Journal of Ultrastructure Research, vol. 65, no 2, , p. 163-172 (DOI 10.1016/S0022-5320(78)90053-9).
- Michel Goldberg, Manuel d'histologie et de biologie buccale. La dent et ses tissus de soutien, Masson, , p. 49.
- En haut, l'émail composé principalement de la couche prismatique, et dans sa partie supérieur la couche finale sans bâtonnets. En bas, la dentine.
- A. Nanci (2012), Ten Cate’s Oral Histology: Development, Structure, and Function (C. V. Mosby, ed. 8, )
- J. H. Bowes, M. M. Murray(1935), The chemical composition of teeth: The composition of human enamel and dentine. Biochem. J. 29, 2721–2727
- B. B. An, R. R. Wang, D. S. Zhang (2012), Role of crystal arrangement on the mechanical performance of enamel. Acta Biomater. 8, 3784–3793 .
- L. H. He, M. V. Swain (2008), Understanding the mechanical behaviour of human enamel from its structural and compositional characteristics. J. Mech. Behav. Biomed. Mater. 1, 18–29
- Etienne Piette, Michel Goldberg, La dent normale et pathologique, De Boeck Université, (lire en ligne), p. 39-43
- wheeler_enamelformationchart.
- Bouferrache, K., Pop, S., Abarca, M., & Madrid, C. (2010). Le pédiatre et les dents des tout petits. Paediatrica, 21(1), 14-20.
- Madrid, C., Abarca, M., Pop, S., Korsvold, T., & Bouferrache, K. (2010). Lésions buccales du reflux gastro-œsophagien de l'enfant: des réalités et quelques mythes. Revue médicale suisse, (237), 384.
- Faure, S. (2014). Médicaments de l’acné. Actualites pharmaceutiques, 53(538), 57-61.
- Krivine, S., Nobécourt, J., Soualmia, L., Cerbah, F., & Duclos, C. (2009). Construction automatique d'ontologie à partir de bases de données relationnelles: application au médicament dans le domaine de la pharmacovigilance. In IC mai 2009 (p. pp).
- Canivenc-Lavier M-C, Jedeon K, Babajko S. Vers une dentisterie sans perturbateurs endocriniens. In Paris: Réseau Environnement Santé; 2016 [cité 21 nov2016]. http://www.reseau-environnement-sante.fr/wp-content/uploads/2016/05/dossier-de-presse-colloque-dentisterie-sans-PE.pdf.
- Moreira, M. R., Matos, L. G., de Souza, I. D., Brigante, T. A. V., Queiroz, M. E. C., Romano, F. L., ... & Matsumoto, M. A. N. (2017). Bisphenol A release from orthodontic adhesives measured in vitro and in vivo with gas chromatography. American Journal of Orthodontics and Dentofacial Orthopedics, 151(3), 477-483.
- Goldberg M (2016). Perturbateur endocrinien : le bisphénol A. Médecine Buccale. .
- Dure‐Molla M de la, Berdal A (2015) Odontogénétique : cytodifférenciation dentaire et maladies rares associées. Médecine Buccale ; 28(20):10.
- L. C. Palmer, C. J. Newcomb, S. R. Kaltz, E. D. Spoerke, S. I. Stupp, Biomimetic systems for hydroxyapatite mineralization inspired by bone and enamel. Chem. Rev. 108, 4754–4783 (2008).
- R. H. Selwitz, A. I. Ismail, N. B. Pitts (2007) Dental caries. Lancet 369, 51–59
- R. Xie, Z. Feng, S. Li, B. Xu, EDTA-assisted self-assembly of fluoride-substituted hydroxyapatite coating on enamel substrate. Cryst. Growth Des. 11, 5206–5214 (2011).
- Y. Wang, K. Lin, C. Wu, X. Liu, J. Chang (2015) Preparation of hierarchical enamel-like structures from nano- to macro-scale, regulated by inorganic templates derived from enamel. J. Mater. Chem. B 3, 65–71
- Q. Ruan, N. Siddiqah, X. Li, S. Nutt, J. Moradian-Oldak (2014) Amelogenin-chitosan matrix for human enamel regrowth: Effects of viscosity and supersaturation degree. Connect. Tissue Res. 55 ( suppl. 1), 150–154.
- L. Li, C. Y. Mao, J. M. Wang, X. R. Xu, H. H. Pan, Y. Deng, X. H. Gu, R. K. Tang, Bio-inspired enamel repair via Glu-directed assembly of apatite nanoparticles: An approach to biomaterials with optimal characteristics. Adv. Mater. 23, 4695–4701 (2011)
- B. Marie, C. Joubert, A. Tayalé, I. Zanella-Cléon, C. Belliard, D. Piquemal, N. Cochennec-Laureau, F. Marin, Y. Gueguen, C. Montagnani, Different secretory repertoires control the biomineralization processes of prism and nacre deposition of the pearl oyster shell. Proc. Natl. Acad. Sci. U.S.A. 109, 20986–20991 (2012).
- Changyu Shao & al (2019) Repair of tooth enamel by a biomimetic mineralization frontier ensuring epitaxial growth|Science Advances | 30 aout 2019:vol. 5, no. 8, eaaw9569 | DOI:10.1126/sciadv.aaw9569
- Y. Cao, M. L. Mei, Q. L. Li, E. C. M. Lo, C. H. Chu (2013) Agarose hydrogel biomimetic mineralization model for the regeneration of enamel prismlike tissue. ACS Appl. Mater. Interfaces 6, 410–420
- L. Li, H. Pan, J. Tao, X. Xu, C. Mao, X. Gu, R. Tang (2008), Repair of enamel by using hydroxyapatite nanoparticles as the building blocks. J. Mater. Chem. 18, 4079–4084
- K. Yamagishi, K. Onuma, T. Suzuki, F. Okada, J. Tagami, M. Otsuki, P. Senawangse, Materials chemistry: A synthetic enamel for rapid tooth repair. Nature 433, 819–819 (2005).CrossRefPubMed
- T. Wald, F. Spoutil, A. Osickova, M. Prochazkova, O. Benada, P. Kasparek, L. Bumba, O. D. Klein, R. Sedlacek, P. Sebo, J. Prochazka, R. Osicka, Intrinsically disordered proteins drive enamel formation via an evolutionarily conserved self-assembly motif. Proc. Natl. Acad. Sci. U.S.A. 114, E1641–E1650
- J. Mahamid, A. Sharir, L. Addadi, S. Weiner, Amorphous calcium phosphate is a major component of the forming fin bones of zebrafish: Indications for an amorphous precursor phase. Proc. Natl. Acad. Sci. U.S.A. 105, 12748–12753 (2008)
- N. Nassif, N. Pinna, N. Gehrke, M. Antonietti, C. Jäger, H. Cölfen, Amorphous layer around aragonite platelets in nacre. Proc. Natl. Acad. Sci. U.S.A. 102, 12653–12655 (2005).
- R. T. DeVol, C.-Y. Sun, M. A. Marcus, S. N. Coppersmith, S. C. B. Myneni, P. U. P. A. Gilbert, Nanoscale transforming mineral phases in fresh nacre. J. Am. Chem. Soc. 137, 13325–13333 (2015)
- T. Mass, A. J. Giuffre, C.-Y. Sun, C. A. Stifler, M. J. Frazier, M. Neder, N. Tamura, C. V. Stan, M. A. Marcus, P. U. P. A. Gilbert, Amorphous calcium carbonate particles form coral skeletons. Proc. Natl. Acad. Sci. U.S.A. 114, E7670–E7678 (2017)
- Mahamid, A. Sharir, L. Addadi, S. Weiner (2008) Amorphous calcium phosphate is a major component of the forming fin bones of zebrafish: Indications for an amorphous precursor phase. Proc. Natl. Acad. Sci. U.S.A. 105, 12748–12753