Amphibia
Amphibiens, batraciens

| Règne | Animalia |
|---|---|
| Embranchement | Chordata |
| Sous-embr. | Vertebrata |
| Infra-embr. | Gnathostomata |
| Super-classe | Tetrapoda |
Taxons de rang inférieur
- Clade Batrachomorpha
- † Temnospondyli
- Lissamphibia (amphibiens modernes)
- Clade Reptiliomorpha * (ancestral au amniotes)
Les amphibiens (Amphibia), anciennement « batraciens », forment une classe de vertébrés tétrapodes. Ils sont généralement définis comme un groupe incluant l'« ensemble des tétrapodes non amniotes ». La branche de la zoologie qui les étudie (ainsi que les « reptiles ») est l'herpétologie, plus précisément la batrachologie, du grec batrachos, grenouille, qui leur est spécialement consacrée.
Les amphibiens vivent dans une grande variété d’habitats mais la majorité des espèces affectionnent les écosystèmes terrestres, d’eau douce ou arboricoles. Les amphibiens débutent généralement leur vie sous la forme d’une larve aquatique, qui se métamorphose plus tard en forme adulte définitive, mais certaines espèces n’effectuent pas cette métamorphose, soit en restant larvaires toute leur vie et se reproduisant ainsi (néoténie), soit en prenant la forme adulte miniature avant éclosion. La larve a un mode de vie totalement aquatique et respire par le biais de branchies tandis que l’adulte est doté de poumons et respire à l’air libre. Les amphibiens utilisent leur peau comme surface respiratoire secondaire, et certaines espèces de petites salamandres et de grenouilles terrestres respirent même exclusivement par la peau, et sont dépourvues de poumons. Ils ont un certain nombre de ressemblances avec les reptiles, mais ces derniers sont des amniotes qui, comme les oiseaux et les mammifères, n’ont pas besoin d’eau pour se reproduire. Les amphibiens ont, pour leur reproduction et la santé de leur peau perméable, besoin d’eaux chimiquement non-polluées, ce qui en fait de bons indicateurs écologiques. Dans les dernières décennies, il y a eu un déclin spectaculaire de leurs populations à travers le monde, dû à la pollution et à la diffusion des mycoses.
Les premiers amphibiens sont apparus au début du Dévonien parmi des « poissons » sarcoptérygiens, munis de poumons et de nageoires osseuses, organes adaptés à l’exondation régulière et prolongée sur les estrans des estuaires, deltas et autres milieux paraliques. Ils se sont diversifiés et sont devenus le groupe prédominant parmi les vertébrés terrestres au cours du Carbonifère et du début du Permien, avant d’être supplantés par les amniotes dont l’essor a profité de la disparition, au fil des extinctions de masse, de nombreuses lignées d’amphibiens. Seuls les ancêtres de la sous-classe des Lissamphibiens, plus petits et moins diversifiés, ont survécu jusqu’à nos jours.
Les trois ordres modernes d'amphibiens sont les anoures (grenouilles et crapauds), les urodèles (tritons et salamandres), et les gymnophiones (les cécilies). Le nombre total d'espèces connues d'amphibiens est d'environ 7 000, dont près de 90 % sont des grenouilles (à comparer avec les mammifères : environ 5000 espèces). Le plus petit amphibien (et plus petit vertébré terrestre) au monde est une grenouille de Nouvelle-Guinée, Paedophryne amauensis qui mesure seulement 7,7 mm. Le plus grand amphibien vivant est la Salamandre géante de Chine (Andrias davidianus) avec 1,8 m de long, toutefois bien en deçà des 6 m de Mastodonsaurus, espèce éteinte qui vivait durant le Permien au Brésil, ou des 7 m du Brachyopoïde d'Alweynskop au Lesotho, qui vivait à la fin du Trias et au début du Jurassique[2].
Selon la liste rouge de l'UICN publiée en 2019, 40 % des 8 100 espèces amphibiennes répertoriées sont en voie d’extinction[3].
Généralités
Parmi les vertébrés, la superclasse des tétrapodes est divisée en quatre classes[4] comptant notamment les reptiles, les oiseaux et les mammifères, qui sont des amniotes, dont les œufs sont portés ou pondus par la femelle et sont protégés par plusieurs membranes, certaines imperméables[5]. Comme leurs œufs ne possèdent pas ces membranes, les amphibiens ont besoin du milieu aquatique pour pondre et mener à bien leur reproduction, même si certaines espèces ont développé diverses stratégies pour protéger leurs larves, voire se passer du stade larvaire aquatique durant lequel elles sont vulnérables[6]. Il y a accouplement en général, mais sans fécondation interne, le mâle déversant son sperme sur les œufs au moment où la femelle pond. Il existe cependant des exceptions comme la plupart des salamandres, des amphibiens de l'ordre des urodèles chez qui la femelle, après une fécondation interne, conserve les embryons et les larves dans ses voies génitales (cas de viviparité). On ne rencontre actuellement pas d'amphibiens dans les milieux marins, à l'exception de rares grenouilles vivant dans les eaux saumâtres des mangroves[7]. Sur terre, les amphibiens préfèrent les habitats humides, car ils doivent éviter que leur peau ne se dessèche[6].
Le plus petit amphibien et vertébré dans le monde est une grenouille Microhylidae de Nouvelle-Guinée, Paedophryne amauensis, découverte en 2012[8]. Elle mesure en moyenne 7,7 mm et fait partie d'un genre qui contient quatre des dix plus petites espèces de grenouilles au monde[9]. Le plus grand amphibien vivant mesure lui jusqu'à 1,8 m de long. Il s'agit de la Salamandre géante de Chine (Andrias davidianus)[10] - [11], qui demeure bien plus petite que ses parents éloignées, dont l'un plus grand connus, Mastodonsaurus, un temnospondyle ressemblant à un crocodile et vivant au Europe, mesurant 6 m de long et ayant existé durant le Trias moyen[12].
Les amphibiens sont qualifiés d'animaux « à sang froid » car ils sont poïkilothermes, c'est-à-dire qu'ils ne peuvent pas réguler la température de leur corps, et sont donc dépendants des conditions thermiques extérieures. Comme les reptiles, leur thermorégulation est assurée par héliothermie ou thigmothermie[13]. Leur métabolisme de base est faible et, par conséquent, leurs besoins alimentaires et énergétiques sont peu importants. Au stade adulte, ils ont des conduits lacrymaux et les paupières mobiles, et la plupart des espèces ont des oreilles qui peuvent détecter des vibrations dans l'air ou du sol. Ils ont une langue musculaire, qui est protruse dans de nombreuses espèces. Les amphibiens modernes ont des vertèbres complètement ossifiées et de véritables articulations. Leurs côtes sont généralement très courtes, voire fusionnées avec les vertèbres. Leur crâne est large et court, et souvent incomplètement ossifié. Leur peau contient peu de kératine et est dépourvue d'écailles, mis à part chez certaines cécilies. La peau contient de nombreuses glandes à mucus et chez certaines espèces des glandes produisant du poison. Le cœur des amphibiens a trois chambres, deux oreillettes et un ventricule. Ils ont une vessie et les déchets azotés sont excrétés principalement sous forme d'urée. La plupart des amphibiens pondent leurs œufs dans l'eau et ont des larves aquatiques qui se métamorphosent pour devenir des adultes terrestres. Les amphibiens respirent en aspirant l'air par leurs narines dans la région buccopharyngée, puis leurs narines sont obturées et l'air est envoyé dans les poumons à la suite de la contraction de la gorge[14]. Ils complètent leur respiration par des échanges gazeux à travers leur peau fine, richement vascularisée et souvent couverte de mucus, qui permet la dissolution des gaz[6].
Les trois grands groupes d'amphibiens vivant actuellement sont assez différents, tant par leur mode de vie que par leur apparence.
Les anoures

L'ordre des Anoura (du grec ancien ἀν-, « sans », et οὐρά, « queue ») comprend les grenouilles et les crapauds. Ils ont généralement de longs membres postérieurs repliés sous leur corps, des pattes antérieures plus courtes, des orteils palmés sans griffes, pas de queue, de grands yeux et une peau glandulaire humide[15]. On appelle communément grenouilles les membres de cet ordre qui ont la peau lisse, tandis que ceux avec une peau verruqueuse sont connus comme des crapauds. La différence entre grenouilles et crapauds n'est pas basée sur un caractère officiel taxonomique et il y a de nombreuses exceptions à cette règle. Les membres de la famille des Bufonidae sont connus comme les « vrais crapauds »[16]. Les grenouilles peuvent mesurer plus de 30 centimètres comme la Grenouille de Goliath (Conraua goliath) en Afrique de l'Ouest[17], mais aussi être très petites comme Paedophryne amauensis et ses 7,7 millimètres, qui a été décrite pour la première en Papouasie-Nouvelle-Guinée en 2012, et qui est aussi le plus petit vertébré connu au monde[18]. Bien que la plupart des espèces soient associées à des habitats humides, certaines se sont spécialisées pour vivre dans les arbres ou dans les déserts. Ainsi on trouve des anoures dans le monde entier à l'exception des régions polaires[19].
L'ordre des anoures est divisé en trois sous-ordres qui sont largement reconnus par la communauté scientifique, mais les relations entre certaines familles restent floues. Les futures études moléculaires devraient fournir de nouvelles informations sur leurs relations évolutives[20]. Le sous-ordre des Archaeobatrachia comprend quatre familles de grenouilles primitives : les Ascaphidae, les Bombinatoridae, les Discoglossidae et les Leiopelmatidae, qui ont quelques caractères divergents et sont probablement paraphylétique par rapport aux autres lignées de grenouilles[21]. Les six familles du sous-ordre des Mesobatrachia, plus avancé en matière d'évolution, sont les Megophryidae, les Pelobatidae, les Pelodytidae, les Scaphiopodidae, les Rhinophrynidae et les Pipidae exclusivement aquatiques. Ces familles ont des caractéristiques intermédiaires entre les deux autres sous-ordres[21]. Le sous-ordre des Neobatrachia est de loin le plus vaste et comprend les autres familles de grenouilles modernes, comprenant notamment les espèces les plus communes. 96 % des plus de 5 000 espèces actuelles de grenouilles sont des Neobatrachia[22].
Les urodèles

(Andrias japonicus), une salamandre primitive
L'ordre des Caudata (du latin cauda signifiant « queue »), également appelés Urodela[23], est composé des salamandres et des tritons, sont très dépendants du milieu aquatique, elles ont un corps allongé, une longue queue et quatre petites pattes[24]. Ces animaux ressemblent à des lézards, mais ils ne sont toutefois pas plus apparentés aux lézards qu'ils ne le sont aux mammifères[25]. Les salamandres n'ont pas de griffes, ont une peau dépourvue d'écailles, lisse ou recouverte de tubercules, et une queue aplatie verticalement. Leur taille varie entre 20 mm pour Thorius pennatulus, espèce qui vit au Mexique[26] et 1,8 m, taille de la Salamandre géante de Chine (Andrias davidianus)[27]. Les salamandres sont présentes dans tout la région Holarctique de l'hémisphère Nord. La famille des Plethodontidae peut aussi se rencontrer en Amérique centrale et en Amérique du Sud au nord du bassin de l'Amazone[19]. Les membres de plusieurs familles de salamandres sont devenus néoténique, et ne terminent jamais leur métamorphose, ou conservent des caractéristiques larvaires une fois adultes[28] - [29]. La plupart des salamandres mesurent moins de 15 cm de long. Elles peuvent être terrestres et aquatiques, et de nombreuses espèces alternent entre ces deux habitats au cours de l'année. Sur terre, elles passent la majeure partie de la journée cachées sous une pierre, une branche tombée au sol ou dans la végétation dense, et sortent la nuit pour se nourrir de vers, d'insectes et d'autres invertébrés[19].

Le sous-ordre des Cryptobranchoidea comprend les salamandres primitives. Un certain nombre de fossiles de cryptobranchides ont été trouvés, mais on ne connait que trois espèces existantes de nos jours, la Salamandre géante de Chine (Andrias davidianus), la Salamandre géante du Japon (Andrias japonicus) et le Ménopome (Cryptobranchus alleganiensis) en Amérique du Nord. Ces amphibiens de grande taille conservent plusieurs caractéristiques larvaires à leur stade adulte : les fentes des branchies sont présentes et les yeux n'ont pas de paupières. Ils se caractérisent par leur capacité à se nourrir par aspiration, en créant une dépression d'un côté ou l'autre de la mâchoire inférieure[30]. Le mâle creuse le nid, incite la femelle à pondre ses œufs à l'intérieur, et les garde. En plus de respirer par leurs poumons, ils respirent par les nombreux plis de leur peau fine, qui disposent de vaisseaux capillaires proches de la surface[31].
Le sous-ordre des Salamandroidea est composé de salamandres plus évoluées. Elles diffèrent des cryptobranchides par leur os préarticulaire fusionné à la mâchoire inférieure, et par leur pratique de la fécondation interne. Chez les Salamandroidea, le mâle dépose un paquet de sperme, le spermatophore, et la femelle le ramasse et l'insère dans son cloaque où le sperme est stocké jusqu'à ce que les œufs soient pondus[32]. La plus grande famille de ce groupe est celle des Plethodontidae, les salamandres sans poumons, qui comprend 60 % de toutes les espèces de salamandres. La famille des Salamandridae comprend les vraies salamandres et on nomme « tritons » les membres de la sous-famille Pleurodelinae[15].
Le troisième sous-ordre, celui des Sirenoidea, compte quatre espèces dans son unique famille des Sirenidae. Les membres de cet ordre sont des salamandres aquatiques ressemblant à des anguilles, dépourvues de membres postérieurs et aux membres antérieurs réduits. Certaines de leurs caractéristiques sont primitives tandis que d'autres sont plus évoluées[33]. La fertilisation semble être externe car les mâles n'ont pas les glandes cloacales utilisées par les salamandrides pour produire les spermatophores et les femelles n'ont pas de spermathèques pour le stockage du sperme. Malgré cela, les œufs sont pondus un à un, un comportement peu propice à la fécondation externe[32].
Les gymnophiones

L'ordre des Gymnophiona (du grec gymnos signifiant « nu » et ophis signifiant « serpent »), également appelés Apoda (du latin an- signifiant « sans » et du grec poda signifiant « pattes »), comprend les cécilies. Ce sont de longs animaux cylindriques dépourvus de pattes, ressemblant superficiellement aux serpents et aux vers. Les adultes mesurent entre 8 et 75 cm de long, à l'exception notable de Caecilia thompsoni qui peut atteindre une longueur de 150 centimètres. La peau des cécilies présente un grand nombre de plis transversaux, et chez certaines espèces elle est recouverte de minuscules écailles dermiques. Elles ont des yeux rudimentaires recouverts d'une peau, et dont la fonction se limite probablement à discerner les différences d'intensité lumineuse. Elles ont également une paire de petits tentacules près de l’œil, qui peuvent s'étendre et possèdent des fonctions tactiles et olfactives. La plupart des cécilies vivent sous la terre dans des galeries creusées dans le sol humide, dans du bois en décomposition ou sous des débris végétaux, mais certains sont aquatiques[34]. La plupart des espèces pondent leurs œufs sous la terre, et dès que les larves éclosent elles se dirigent vers le point d'eau le plus proche. D'autres espèces portent les œufs, et la métamorphose a lieu avant qu'ils n'éclosent. Enfin, de plus rares espèces donnent naissance à des jeunes qu'elles nourrissent avec des sécrétions glandulaires tandis qu'ils sont dans l'oviducte[35]. On rencontre les cécilies dans les régions tropicales d'Afrique, d'Asie, d'Amérique centrale et d'Amérique du Sud[36].
Anatomie et physiologie
La peau

La structure tégumentaire de la peau des amphibiens comporte certaines caractéristiques communes avec celle des autres vertébrés terrestres. Ainsi, leur peau présente des couches externes fortement kératinisées, et renouvelées périodiquement à travers un processus de mue contrôlé par l'hypophyse et la thyroïde. Les verrues sont communes, notamment chez les crapauds. Contrairement aux mammifères et aux oiseaux dont la peau est renouvelée par petites plaques, les amphibiens muent en perdant l'intégralité de la couche externe de la peau en une seule fois, à intervalles réguliers. L'intervalle entre deux mues varie suivant l'espèce. Il leur arrive fréquemment de manger ensuite cette mue[19]. Les cécilies diffèrent des autres amphibiens par leurs écailles dermiques intégrées dans le derme, entre les sillons de la peau. Ces écailles ont une vague ressemblance avec celles des poissons osseux. Les lézards et certaines grenouilles ont des plaques osseuses semblables au niveau du derme, mais il s'agit là d'un exemple de convergence évolutive, des structures similaires s'étant développées indépendamment dans diverses lignées de vertébrés[37].
La peau des amphibiens est perméable à l'eau[38]. Des échanges gazeux peuvent avoir lieu à travers la peau, ce qui permet aux adultes de respirer sans remonter à la surface de l'eau et d'hiberner au fond des étangs ou des mares[19]. Pour éviter que leur peau fine et fragile ne se dessèche, les amphibiens ont développé des glandes à mucus, principalement localisées sur la tête, le dos et la queue. Les sécrétions produites par celles-ci les aident à garder la peau humide. En outre, la plupart des espèces d'amphibiens ont des glandes qui sécrètent des substances désagréables ou toxiques. Certaines toxines produites par des amphibiens peuvent être mortelles pour les humains tandis que d'autres ont peu d'effet[39]. Les principales glandes productrices de poison, les parotides, produisent une neurotoxine, la bufotoxine. Elles sont situées derrière les oreilles des crapauds, le long du dos des grenouilles, derrière les yeux des salamandres et sur la surface supérieure des cécilies[40].
La couleur de la peau des amphibiens dépend de trois couches de cellules pigmentaires appelées chromatophores. Ces trois couches de cellules comprennent les mélanophores (occupant la couche la plus profonde), les guanophores (formant une couche intermédiaire et contenant de nombreux granules, produisant une couleur bleu-vert) et les lipophores (jaunes, la couche la plus superficielle). La plupart des espèces adoptent des couleurs leur permettant de se fondre dans leur environnement. Certaines d'entre elles sont même capables de modifier leur coloration selon le milieu dans lequel elles évoluent, à la manière des caméléons mais de façon moins marquée. Ce changement de couleur est initié par des hormones sécrétées par l'hypophyse, à partir des informations fournies par les yeux[41]. Contrairement aux poissons osseux, il n'y a pas de contrôle direct du système nerveux sur les cellules pigmentaires, et cela se traduit par un changement de couleur plus lent que chez les poissons. Une peau de couleur vive indique généralement que l'espèce est toxique et constitue un avertissement pour les prédateurs[42].
En 2017, des chercheurs de l'université de Buenos Aires ont découvert la première grenouille fluorescente (Hypsiboas punctatus), chose unique chez les amphibiens, alors qu'ils étaient en train d'étudier sa pigmentation. À la lumière du jour, cette grenouille arbore des couleurs vertes, jaunes ou rouges, mais éclairée par un faisceau ultraviolet, elle se met à briller intensément, d'une couleur bleu-vert. D'autre part, elle possède des molécules fluorescentes jamais encore observées chez des animaux. Celles-ci sont concentrées dans son tissu lymphatique, dans sa peau et dans ses sécrétions glandulaires[43].
Squelette et locomotion
Le squelette des amphibiens ressemble fortement à celui des autres tétrapodes. En effet ils ont tous quatre membres, sauf pour les cécilies et quelques espèces de salamandres aux membres réduits ou absents. Les os sont creux et légers. Le système musculo-squelettique est robuste pour lui permettre de soutenir la tête et le corps. La ceinture scapulaire est soutenue par des muscles, et la ceinture pelvienne, bien développée, est rattachée au squelette par une paire de côtes reliées au sacrum. L'ilion penche vers l'avant et le corps est maintenu près du sol, ce qui n'est pas le cas chez les mammifères[44].
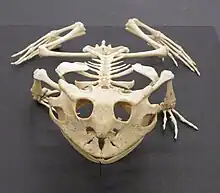
Chez la plupart des amphibiens, la patte avant comporte quatre doigts, et la patte arrière cinq, mais aucun ne présente de griffes. Certaines espèces de salamandres ont moins de doigts et les Amphiuma, ressemblant à des anguilles, ont des pattes minuscules. Les Sirenoidea, des salamandres aquatiques, ont quant à elles des membres antérieurs trapus mais pas de membres postérieurs. Les cécilies n'ont pas de pattes. Elles progressent dans leurs galeries à la manière des vers de terre, par des contractions musculaires le long de leur corps. Sur la surface du sol ou dans l'eau, elles se déplacent en ondulant[45].
Chez les grenouilles, les pattes postérieures sont plus grandes que les pattes antérieures, trait particulièrement marqué chez les espèces qui se déplacent principalement en sautant ou en nageant. Les espèces qui se déplacent en marchant ont des membres postérieurs développés, et les fouisseurs ont pour la plupart des membres courts et un corps large. Les pieds peuvent présenter diverses adaptations suivant le mode de vie, comme des orteils palmés adaptés à la natation, de larges ventouses adhésives pour l'escalade et des tubercules kératinisés sur les pattes de derrière pour creuser (les grenouilles creusent généralement dans le sol en reculant). Chez la plupart des salamandres, les membres sont courts, ont plus ou moins la même longueur et sont perpendiculaires au corps. Lorsqu'elles marchent sur terre, la queue passe d'un côté à l'autre, et peut être utilisée comme balancier, notamment pour grimper. Dans leur démarche normale, elles avancent une patte après l'autre, de la même manière que leurs ancêtres les ostéichthyens[44]. Certaines salamandres appartenant au genre Aneides et certains Plethodontidae grimpent aux arbres et ont de longs membres, de larges ventouses et une queue préhensile[32]. Chez les salamandres aquatiques et les têtards de grenouilles, la queue a les nageoires dorsales et ventrales et se déplacent de droite à gauche, permettant à l'animal de se propulser. Les grenouilles adultes n'ont pas de queue et celle des cécilies est très courte[46].
Les salamandres peuvent utiliser leur queue pour se défendre et certaines espèces l'abandonnent derrière elles pour faire diversion, la queue continuant à se contracter, et s'échapper. On appelle ce comportement autotomie. C'est le cas de certaines espèces de Plethodontidae chez lesquelles la queue se détache facilement. La queue et les membres peuvent être régénérés[47]. Par contre, les membres des grenouilles adultes ne se régénèrent pas, contrairement à ceux de leurs têtards[45].
Système circulatoire

Les amphibiens ont un stade larvaire et un stade adulte, avec des systèmes circulatoires bien distincts. Chez la larve, la circulation est similaire à celle d'un poisson, et le cœur composé de deux compartiments envoie le sang vers les branchies où il est oxygéné, avant qu'il ne traverse le reste du corps et revienne au cœur en ne formant qu'une seule boucle. Chez l'adulte, les amphibiens, et notamment les grenouilles, perdent leurs branchies et développent des poumons. Leur cœur se compose d'un ventricule unique et de deux oreillettes. Lorsque le ventricule se contracte, le sang désoxygéné est pompé à travers l'artère pulmonaire vers les poumons, puis les contractions continuent et envoie le sang oxygéné dans le reste du corps. Le mélange du sang oxygéné et du sang non oxygéné est minimisé par l'anatomie des chambres[48].
Les systèmes nerveux et sensoriel
Le système nerveux est semblable à celui des autres vertébrés, avec un cerveau central, une moelle épinière, et des nerfs dans tout le corps. Le cerveau des amphibiens est moins bien développé que celui des reptiles, des oiseaux et des mammifères, mais sa morphologie et son fonctionnement sont similaires à celui d'un poisson. Il se compose d'un télencéphale, d'un mésencéphale et d'un cervelet de tailles équivalentes. Le télencéphale reçoit les signaux sensoriels de l'odorat dans le lobe olfactif et de la vue dans le lobe optique, et il est en outre le centre de comportement et d'apprentissage. Le cervelet contrôle la coordination musculaire et le bulbe rachidien régule certaines fonctions des organes, y compris le rythme cardiaque et la respiration. Le cerveau envoie des signaux à travers la moelle épinière et les nerfs afin de réguler l'activité du reste du corps. La glande pinéale, connue chez l'Homme pour réguler le sommeil, produit les hormones impliquées dans l'hibernation et l'estivation des amphibiens[49].
Les têtards possèdent une ligne latérale, comme leurs ancêtres les poissons, mais elle a disparu chez les amphibiens terrestres adultes. Certaines cécilies possèdent des électrorécepteurs qui leur permettent de localiser les objets autour d'elles lorsqu'elles sont immergées dans l'eau. Les oreilles sont bien développées chez les grenouilles. Il n'y a pas d'oreille externe, mais un large tympan est situé juste derrière l’œil. Il vibre et le son est transmis par un seul os, l'étrier, à l'oreille interne. Seuls les sons à haute fréquence tels que les appels d'accouplement se font entendre de cette manière[44]. Les bruits de plus basse fréquence peuvent être détectés par un autre mécanisme : des cellules ciliées spécialisées, appelées papilla amphibiorum situées dans l'oreille interne sont capables de déceler ces sons. Une autre caractéristique, propre aux grenouilles et aux salamandres, est le complexe attenant columelle-opercule de la capsule auditive qui permet aux animaux de ressentir les vibrations de l'air ou du sol[50]. Les oreilles des salamandres et des cécilies sont moins développées que celles des grenouilles et ces espèces ne peuvent généralement pas communiquer par des sons[51].
Les yeux des têtards n'ont pas de paupières, mais ils subissent diverses évolutions au moment de la métamorphose : la cornée prend une forme de dôme, le cristallin s'aplatit et les paupières et les glandes et conduits associés apparaissent[44]. Les yeux des adultes sont intermédiaires entre ceux des invertébrés et ceux des autres vertébrés plus évolués. Ils permettent la vision des couleurs et de la profondeur de champ. La rétine est composée de cellules en bâtonnet, sensibles à une large gamme de longueurs d'onde[51].
Système digestif et excréteur
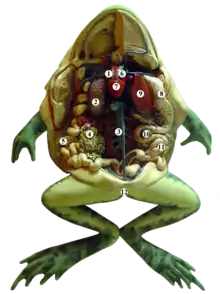
De nombreux amphibiens attrapent leurs proies en lançant sur elles leur longue langue collante, avant de les saisir avec leurs mâchoires. Certains avalent leur proie en avançant rapidement et à plusieurs reprises la tête vers l'avant, afin de faire progresser les aliments vers le fond de la bouche en se servant de leur inertie. La plupart des amphibiens avalent leur proie tout entière, sans mâcher, et ils possèdent donc un ventre volumineux pour pouvoir recevoir ces proies. L'œsophage est court, bordé de cils et couvert de mucus produit par les glandes de la bouche et du pharynx, ce qui facilite le transit de la nourriture vers l'estomac. Leur estomac produit de la chitinase, une enzyme qui permet de digérer la cuticule chitineuse des arthropodes[52].
Les amphibiens possèdent une vessie, un pancréas, un foie et une vésicule biliaire. Le foie est généralement de grande taille avec deux lobes. Comme il a pour fonction de stocker le glycogène et les graisses, sa taille varie d'une saison à l'autre selon que ces réserves sont en constitution ou utilisées. Le tissu adipeux est une autre réserve d'énergie pour les amphibiens, et on le trouve dans l'abdomen, sous la peau et, chez certaines salamandres, dans la queue[53].
Les amphibiens ont deux reins situés au niveau du dos, dans la partie supérieure de la cavité abdominale. Leur fonction est de filtrer le sang pour en extraire les déchets métaboliques et transporter l'urine par les uretères vers la vessie où elle est stockée avant d'être évacuée périodiquement par l'intermédiaire du cloaque. Les larves, tout comme les adultes des espèces les plus aquatiques excrètent l'azote sous forme d'ammoniac dans de grandes quantités d'urine diluée, tandis que les espèces terrestres, qui doivent économiser l'eau, excrètent l'azote sous forme d'urée, un produit moins toxique qui peut être concentré et stocké. Certaines grenouilles arboricoles ayant un accès limité à l'eau excrètent leurs déchets métaboliques sous forme d'acide urique[54].
Système respiratoire

Les larves se distinguent surtout par leur respiration branchiale alors que les adultes ont une respiration pulmonaire[55].
Comparés à ceux des amniotes, les poumons des amphibiens sont primitifs, avec peu de cloisons internes et de grandes alvéoles, et par conséquent le taux de diffusion de l'oxygène dans le sang est relativement lent. L'approvisionnement des poumons en air est réalisé par aspiration par voie buccale. La plupart des amphibiens, cependant, sont en mesure de réaliser des échanges gazeux dans l'eau ou dans l'air par l'intermédiaire de leur peau. Pour que cette respiration cutanée fonctionne, la surface de la peau est très vascularisée et doit rester humide pour permettre à l'oxygène de se diffuser à un taux suffisamment élevé[52]. Comme la concentration d'oxygène dans l'eau augmente à la fois lorsque la température est basse et que le débit est élevé, les amphibiens aquatiques peuvent, lorsque ces conditions sont réunies, s'appuyer principalement sur la respiration cutanée, comme le font la grenouille du lac Titicaca (Telmatobius culeus) et la salamandre Ménopome. À l'air libre, où l'oxygène est plus concentré, certaines petites espèces peuvent compter uniquement sur les échanges gazeux cutanés pour respirer, le cas le plus célèbre étant celui des salamandres de la famille des Plethodontidae, qui n'ont ni poumons, ni branchies. Les amphibiens présentent tous des branchies lors de leur stade larvaire, et certaines salamandres aquatiques les conservent sous leur forme adulte[52].
Reproduction

Pour se reproduire, les amphibiens ont besoin d'eau douce, même si certains pondent leurs œufs sur la terre, ayant développé différents moyens pour les conserver à un niveau d'humidité suffisant. Quelques-uns (par exemple Fejervarya raja) peuvent vivre en eau saumâtre, mais aucun amphibien n'est réellement marin. On a cependant observé quelques cas particuliers de populations d'amphibiens colonisant des eaux salées. Ce fut le cas en mer Noire avec l'hybride naturel Pelophylax esculentus en 2010[56].
Plusieurs centaines d'espèces de grenouille issues d'une même radiation évolutive (dont notamment les Eleutherodactylus, les Platymantines du Pacifique, les Microhylidae d'Océanie et diverses espèces de grenouilles tropicales) n'ont pas besoin d'eau pour se reproduire. La quasi-totalité de ces grenouilles vivent dans les forêts tropicales humides et elles ne possèdent pas de stade larvaire : de leurs œufs éclosent directement des versions miniatures de l'adulte, qui passent par le stade de têtard alors qu'elles sont encore dans l'œuf. La réussite de leur reproduction dépend alors de la quantité de précipitations et du fait que celles-ci coïncident avec le moment de la reproduction[57].
Dans les tropiques, de nombreux amphibiens se reproduisent tout au long de l'année. Dans les régions tempérées, la reproduction est saisonnière, et a généralement lieu au printemps, car elle est déclenchée par l'augmentation de la longueur du jour, la hausse des températures ou d'importantes précipitations. Des expériences ont montré l'importance de la température pour déclencher la reproduction, mais dans les régions arides, c'est souvent une tempête qui la provoque. Chez les anoures, les mâles arrivent généralement avant les femelles sur les sites de reproduction, et leurs chants stimulent alors l'ovulation des femelles et la production d'hormones sexuelles chez les mâles immatures[58].
Chez les cécilies, la fécondation est interne, le mâle introduisant son phallodeum, dans le cloaque de la femelle. Les glandes de Müller situées à l'intérieur du cloaque des mâles sécrètent un fluide qui ressemble à celui produit par les glandes de la prostate des mammifères et qui permet de transporter et nourrir le sperme. La fertilisation a probablement lieu dans l'oviducte[59].
La majorité des salamandres pratiquent également la fécondation interne. Pour la plupart d'entre elles, le mâle dépose un spermatophore (petit paquet de sperme) sur le dessus d'un cône gélatineux, sur le sol ou dans l'eau. La femelle saisit le paquet de sperme avec les lèvres de son cloaque et le pousse dans l'orifice. Les spermatozoïdes atteignent alors la spermathèque située au sommet du cloaque et ils y restent jusqu'à l'ovulation qui peut avoir lieu plusieurs mois plus tard. Les parades nuptiales et les méthodes de transfert du spermatophore varient selon les espèces. Dans certains cas, le spermatophore peut être placé directement dans le cloaque de la femelle alors que chez d'autres la femelle peut être guidée vers le spermatophore ou retenue par une étreinte appelée amplexus. Certaines salamandres primitives appartenant aux familles des Sirenidae, des Hynobiidae et des Cryptobranchidae pratiquent la fertilisation externe de la même manière que les grenouilles, la femelle pondant ses œufs dans l'eau et le mâle libérant son sperme sur la masse d'œufs[59].
À quelques exceptions près, les grenouilles utilisent la fécondation externe. Le mâle saisit la femelle avec ses pattes avant soit au niveau des pattes avant soit au niveau des pattes arrière, voire dans le cas de Epipedobates tricolor autour du cou. Ils restent dans cette position, leurs cloaques placés non loin l'un de l'autre, et tandis que la femelle pond les œufs, le mâle les recouvre de sa semence. Des callosités rugueuses sur les pattes du mâle permettent d'avoir plus d'adhérence pour conserver cette position suffisamment longtemps. Chez le crapaud accoucheur, Alytes obstetricans, le mâle recueille et conserve la masse d'œufs sur ses cuisses et la base de son dos, formant une sorte de panier avec ses pattes arrière. Oophaga granulifera constitue une exception, puisque le mâle et la femelle placent bien leurs cloaques à proximité, mais sont orientés vers des directions opposées, et relâchent les œufs et le sperme en même temps. Ascaphus truei utilise la fécondation interne. Seuls les mâles disposent d'une « queue » qui constitue un prolongement du cloaque et est utilisée pour fertiliser la femelle. Cette grenouille vit dans les rivières à courant rapide et la fécondation interne évite que les spermatozoïdes soient emportés par le courant avant que la fécondation n'ait lieu[60]. Le sperme peut être conservé dans des tubes de stockage connectés à l'oviducte jusqu'au printemps suivant[61].
La durée de la période de reproduction est variable suivant les espèces. En règle générale, elle est assez longue, les mâles arrivant progressivement sur les sites de reproduction, où les premiers s'installent sur un territoire et chantent, tandis que d'autres attendent qu'un territoire soit libéré. Petit à petit, les femelles arrivent, choisissent un partenaire et pondent leurs œufs. À leur départ le territoire change de mains, et ainsi de suite jusqu'à ce que plus aucune femelle ne vienne sur les sites de reproduction, marquant la fin de celle-ci. D'autres espèces ont une période de reproduction beaucoup plus courte, avec une activité plus marquée. Il s'agit notamment des espèces fouisseuses vivant dans des régions arides, qui émergent après de fortes pluies et se rassemblent sur un site de reproduction. Les animaux sont attirés par le chant du premier mâle à trouver un endroit approprié, comme une flaque qui se forme au même endroit à chaque saison des pluies. Les grenouilles assemblées peuvent appeler à l'unisson et une activité frénétique s'ensuit, les mâles se bousculant pour s'accoupler avec les femelles, généralement moins nombreuses[60].
Cycle de vie
La plupart des amphibiens se métamorphosent, un processus de changement morphologique significatif après la naissance. Au cours du développement classique des amphibiens, les œufs sont pondus dans l'eau et les larves sont adaptées à un mode de vie aquatique. Les grenouilles, les crapauds et les salamandres sortent de l'œuf sous forme de larves munies de branchies externes. La métamorphose des amphibiens est régulée par la concentration dans le sang de deux hormones antagonistes, la thyroxine, qui stimule la métamorphose, et la prolactine, qui contrecarre l'effet de la thyroxine. Les évènements de la métamorphose sont induits par le passage de la concentration de ses hormones au-delà de valeurs seuils dans les différents tissus[62]. Comme le développement embryonnaire se fait surtout en dehors du corps des parents, il est soumis à de nombreuses adaptations découlant des conditions environnementales. Ainsi, les têtards ont des crêtes cornées au lieu de dents et des extensions de la peau plutôt que des nageoires. Ils disposent aussi d'un organe sensoriel, la ligne latérale, similaire à celui des poissons. Après la métamorphose, ces organes deviennent inutiles et vont disparaître petit à petit à la suite de la dégénérescence des cellules, appelée apoptose. La variété des adaptations liées aux spécificités de l'environnement chez les amphibiens est très importantes, et de nombreuses découvertes sont encore à faire[63].
Œufs

L’œuf des amphibiens se caractérise par la présence d'une couverture gélatineuse transparente sécrétée par les oviductes et composée de mucoprotéines et des glycosaminoglycanes. Cette capsule est perméable à l'eau et aux gaz, et sa taille augmente considérablement à mesure qu'elle absorbe de l'eau. L'ovule est d'abord maintenu solidement à l'intérieur, mais dans les œufs fécondés, la couche la plus interne se liquéfie et permet à l'embryon de se déplacer librement. C'est également le cas pour les œufs de salamandre, même quand ils ne sont pas encore fécondés. Les œufs de certaines salamandres et ceux des grenouilles contiennent une algue verte unicellulaire. Celle-ci pénètre dans l'enveloppe gelée après que les œufs sont pondus et peut améliorer l'apport d'oxygène à l'embryon grâce à sa photosynthèse. Elle semble à la fois accélérer le développement des larves et réduire leur mortalité[64]. La plupart des œufs contiennent de la mélanine, un pigment qui augmente leur température grâce à l'absorption de la lumière et les protège contre le rayonnement ultraviolet. Les cécilies, certaines salamandres et les grenouilles de la famille des Plethodontidae qui pondent leurs œufs sous terre ont des œufs non pigmentés. Chez la Grenouille des bois (Rana sylvatica), l'intérieur de l'amas globulaire de l’œuf a une température supérieure de jusqu'à 6 °C à celle de son environnement, dans la partie la plus septentrionale de son aire de répartition[65].
Les œufs peuvent être déposés individuellement ou par plusieurs, voire en importants amas d'œufs sphériques, pouvant former des radeaux ou de longues chaînes. Chez les cécilies terrestres, les œufs sont pondus en grappes, dans des terriers près des ruisseaux. La salamandre amphibie Ensatina attache des grappes similaires à tiges ou des racines sous l'eau. Eleutherodactylus planirostris pond ses œufs en petits amas dans le sol où ils se développent en environ deux semaines pour donner directement des grenouilles juvéniles, qui ne passent pas par le stade de larves[66]. Physalaemus pustulosus construit un nid flottant en mousse pour protéger ses œufs. Elle commence par bâtir le radeau, puis pond ses œufs au centre et les recouvre d'un bouchon en mousse. La mousse a des propriétés anti-microbiennes. Elle est créée par émulsion de protéines et de lectines sécrétées par la femelle[67] - [68]. Le crapaud Pipa pipa incube les œufs enfoncés dans le dos de la femelle[69].
Larves

Les œufs des amphibiens sont généralement pondus dans l'eau et les larves qui en éclosent complètent leur développement dans l'eau et se transforment plus tard en adultes, aquatiques ou terrestres. Chez certaines espèces de grenouilles et la plupart des salamandres sans poumons (Pléthodontidés), il n'y a pas de stade larvaire apparent. Les larves se développent dans les œufs et émergent sous la forme d'adultes miniatures. De nombreuses cécilies et certains autres amphibiens pondent leurs œufs sur terre, et la larve nouvellement éclose se tortille jusqu'à un point d'eau ou y est transportée. Certaines cécilies, la Salamandre noire (Salamandra atra) et certaines espèces de Nectophrynoides sont vivipares. Leurs larves se nourrissent de sécrétions glandulaires et se développent dans l'oviducte de la femelle, souvent pendant de longues périodes. D'autres amphibiens, en dehors des cécilies, sont ovovivipares. Les œufs sont conservés à l'intérieur ou sur le corps de la mère, mais les larves se nourrissent du vitellus de l’œuf, sans recevoir aucune nourriture de l'adulte. Les larves émergent à différents stades de leur croissance, que ce soit avant ou après la métamorphose, selon l'espèce[70]. Les crapauds du genre Nectophrynoides présentent l'ensemble de ces modèles de développement parmi sa douzaine de représentants[71].
Anoures
Les larves des anoures sont connues sous le nom de têtards. Ceux-ci ont une forme généralement ovale et longue, une queue aplatie à la verticale et munie de nageoires. Les larves sont normalement entièrement aquatiques, mais les têtards de certaines espèces telles que Nannophrys ceylonensis sont semi-terrestres et vivent parmi les rochers humides[72]. Les têtards ont un squelette cartilagineux, des branchies pour la respiration (branchies externes, puis branchies internes au fur et à mesure de leur développement), une ligne latérale et une grande queue qu'ils utilisent pour nager[73]. À l'éclosion, les têtards développent rapidement des poches branchiales qui couvrent les branchies. Les poumons se développent tôt et sont utilisés comme organes respiratoires accessoires, les têtards remontant à la surface de l'eau pour respirer à l'air libre. Certaines espèces achèvent leur développement à l'intérieur de l'œuf et éclosent sous la forme de petites grenouilles. Dans ce cas, les animaux juste éclos ne disposent pas de branchies mais de régions de la peau très spécialisées par lesquelles la respiration a lieu. Alors que les têtards n'ont pas de véritables dents, chez la plupart des espèces les mâchoires présentent de longues rangées parallèles de petites structures kératinisées appelées keradonts, entourés d'un bec corné[74]. Les pattes avant se forment sous les sacs branchiaux et les pattes arrière deviennent visibles quelques jours plus tard. Les têtards sont généralement herbivores, se nourrissant principalement d'algues, y compris de diatomées filtrées dans l'eau par les branchies. Ils sont aussi détritivores, et ils remuent les sédiments au fond de l'eau pour en dégager de petits fragments de matières comestibles. Ils ont un intestin suffisamment long, en forme de spirale, pour digérer ces aliments[75]. Certaines espèces sont carnivores dès le stade larvaire, et le têtard mange des insectes, d'autres têtards plus petits et des poissons. Les têtards de la Rainette de Cuba (Osteopilus septentrionalis) peuvent pratiquer le cannibalisme, les jeunes têtards attaquant un têtard plus grand alors qu'il est en pleine métamorphose[76].

Lors de la métamorphose, on observe des changements rapides et radicaux dans la morphologie et le mode de vie des grenouilles. La bouche en forme de spirale avec ses dents cornées se résorbe avec l'intestin en spirale. L'animal développe une grande mâchoire, et ses branchies et leurs sacs branchiaux disparaissent. Les yeux et les pattes se développent rapidement, et une langue apparait. Le système nerveux évolue en conséquence, et on observe le développement de la vision stéréoscopique et la perte de la ligne latérale. Tout cela peut se produire en l'intervalle d'une journée environ. Quelques jours plus tard, la queue se résorbe[75].
Urodèles


À l'éclosion, la larve de salamandre présente généralement des yeux dépourvus de paupières, des dents aux mâchoires inférieure et supérieure, trois paires de branchies externes plumeuses, un corps un peu aplati latéralement et une longue queue avec des nageoires dorsales et ventrales. Les membres antérieurs peuvent être partiellement développés et les membres postérieurs sont rudimentaires chez les espèces vivant en eau stagnante, mais peuvent-être un peu plus développés chez les espèces qui se reproduisent dans de l'eau en mouvement. Les larves des espèces se reproduisant en étang ont souvent une paire d'équilibreurs, des éléments en forme de tiges placés de chaque côté de la tête qui évitent aux branchies d'être obstruées par des sédiments. Les larves de certains membres des genres des Ambystoma et des Dicamptodon ne se métamorphoses jamais complètement, et conservent des caractéristiques larvaires. La Salamandre foncée (Ambystoma gracile) est dans ce cas, et en fonction de facteurs environnementaux, elle peut rester en permanence à l'état larvaire, phénomène appelé néoténie, ou se transformer en adulte[77]. Dans les deux cas, l'espèce est en mesure de se reproduire[78]. La néoténie se produit lorsque la croissance de l'animal est très faible et est généralement liée à des conditions défavorables telles qu'une température basse de l'eau, qui peuvent altérer la réponse des tissus à la thyroxine[79]. Le manque de nourriture, le manque d'oligo-éléments et la concurrence importante des congénères peuvent également inhiber la métamorphose. La Salamandre tigrée (Ambystoma tigrinum) se comporte parfois aussi de cette façon. La Salamandre tigrée adulte est terrestre, mais la larve est aquatique et est capable de se reproduire tout en restant dans son état larvaire. Lorsque les conditions sont particulièrement inhospitalière sur terre, cette reproduction des larves peut permettre la survie d'une population qui, autrement, se serait éteinte. Il y a une quinzaine d'espèces de salamandres complètement néoténiques, dont les espèces des genres Necturus, Proteus et Amphiuma, et on compte de nombreux exemples d'espèces néoténiques facultatives qui adoptent cette stratégie dans des conditions environnementales particulières[80].
Les salamandres sans poumons de la famille des Plethodontidae sont terrestres et pondent un petit nombre d’œufs non pigmentés parmi les feuilles mortes humides. Chaque œuf possède un important vitellus et la larve s'en nourrit et se développe à l'intérieur de l'œuf, émergeant après sa métamorphose sous la forme d'une salamandre juvénile. La salamandre femelle couve souvent les œufs. Dans le genre Ensatina, la femelle a été observée appuyant sa gorge contre eux, les massant avec une sécrétion de mucus[81].
Chez les tritons et les salamandres, la métamorphose est moins spectaculaire que chez les grenouilles. En effet, les larves sont carnivores, comme les adultes, et peu de changements sont donc nécessaires pour leur système digestif. Leurs poumons sont fonctionnels dès l'éclosion, mais les larves ne les utilisent pas autant que le font les têtards. Leurs branchies ne sont jamais couvertes par de sacs branchiaux et se résorbent juste avant que les animaux ne sortent de l'eau. Lors de la métamorphose, les nageoires de leur queue se réduisent, voire disparaissent, leurs fentes branchiales se ferment, leur peau s'épaissit, des paupières apparaissent et on observe également des changements au niveau de la dentition et de la structure de la langue. Les salamandres sont très vulnérables au moment de la métamorphose car leur vitesse de nage est réduite et leur grande queue est encombrante sur terre[82]. Les salamandres adultes ont souvent une phase aquatique au printemps et en été, et une phase terrestre en hiver. Pour s'adapter successivement à ces deux modes de vie, elles subissent quelques modifications hormonales : la prolactine est produite pour se préparer à la vie aquatique quand la thyroxine est associée à la vie sur terre. Les branchies externes ne sont pas utilisées lors des phases aquatiques, car celles-ci sont complètement résorbées lorsque les animaux sortent de l'eau pour la première fois[83].
Cécilies
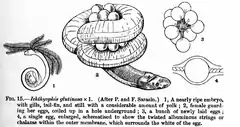
La plupart des cécilies terrestres qui pondent des œufs le font dans des terriers ou des endroits humides près de plans d'eau. Le développement du jeune Ichthyophis glutinosus, une espèce originaire du Sri Lanka, a été étudié en détail. Les larves ressemblent à des anguilles à leur éclosion et se trainent jusqu'à un point d'eau. Elles ont trois paires de branchies plumeuses rouges, une tête émoussée avec deux yeux rudimentaires, une ligne latérale et une queue courte avec des nageoires. Elles nagent en faisant onduler leur corps. Ces larves, surtout actives la nuit, perdent leurs branchies et commencent alors à sortir sur la terre ferme. La métamorphose est progressive. À l'âge d'environ dix mois, cette cécilie a une tête pointue avec des tentacules sensorielles près de la bouche et a perdu ses yeux, sa ligne latérale et sa queue. La peau s'épaissit, les écailles qui lui sont intégrées se développent et le corps se divise en segments. L'animal se construit alors un terrier et vit exclusivement sur terre[84].
La majorité des espèces de cécilies sont vivipares. Typhlonectes compressicauda, une espèce d'Amérique du Sud, en est un exemple typique. Jusqu'à neuf larves peuvent se développer dans l'oviducte simultanément. Elles sont allongées et ont des branchies en forme de sac, de petits yeux et des dents spécialisées pour racler. Dans un premier temps, ils se nourrissent à partir de leur vitellus, mais au fur et à mesure que cette source de nourriture diminue, ils commencent à râper les cellules épithéliales ciliées qui tapissent l'oviducte. Cela stimule la sécrétion de substances riches en lipides et mucoprotéines dont ils se nourrissent par la paroi de l'oviducte. Les larves peuvent voir leur longueur multipliée par six, et mesurent alors les deux cinquièmes de la longueur de leur mère. Lorsqu'elles sortent de l'oviducte, elles ont subi leur métamorphose, ont perdu leurs yeux et leurs branchies, ont développé une peau plus épaisse et des tentacules sur la bouche, et leurs dents ont disparu. Des dents permanentes vont croître peu après la naissance[85] - [86].
Siphonops annulatus a développé une adaptation unique pour se reproduire. La progéniture se nourrit d'une couche de peau spécialement développée à cette fin par l'adulte, dans un phénomène connu sous le nom de dermatophagie maternelle. Les larves se nourrissent ensemble et dévorent la couche cellulaire en approximativement sept minutes, et attendent ensuite trois jours qu'elle se régénère. Pendant ce temps ils se nourrissent de fluides produits par le cloaque maternel[87].
Les soins parentaux

Les soins parentaux chez les amphibiens sont mal connus, mais, en général, plus le nombre d'œufs pondus est important, moins il est probable que les parents se préoccupent de leur progéniture. Néanmoins, on estime que pour environ 20 % des espèces d'amphibiens, un ou les deux parents jouent un rôle dans l'élevage des jeunes[88]. Les espèces qui se reproduisent dans les petits plans d'eau ou dans des habitats spécialisés ont tendance à développer des comportements plus évolués dans les soins donnés aux jeunes[89].
La plupart des salamandres vivant dans les bois pondent leurs œufs à terre sous du bois mort ou une pierre. C'est le cas de Desmognathus welteri, une salamandre qui couve ses œufs et les protège contre les prédateurs tandis que les jeunes se nourrissent du vitellus. Lorsqu'ils sont pleinement opérationnels, les jeunes se frayent un chemin hors du nid et se dispersent[90]. Chez le Ménopome, une salamandre primitive, le mâle creuse un nid sous l'eau et encourage les femelles à y pondre. Le mâle protège ensuite le site pendant les deux ou trois mois qui précèdent l'éclosion des œufs, et assure leur approvisionnement en oxygène en agitant l'eau autour du nid[31].

Le mâle Colostethus subpunctatus, une petite grenouille, protège ses œufs qui sont cachés sous une pierre ou des feuilles mortes. Quand les œufs éclosent, le mâle transporte les têtards sur son dos, sur lequel ils tiennent grâce à une sécrétion de mucus, vers une mare où il se plonge et laisse les têtards tomber[91]. Le mâle Alyte accoucheur (Alytes obstetricans) attache des grappes d'œufs autour de ses cuisses et les porte ainsi pendant environ huit semaines. Il les garde humides, et quand ils sont prêts à éclore il se rend dans un étang ou un fossé et libère les têtards[92]. Chez les grenouilles du genre Rheobatrachus, la femelle élevait les larves dans son estomac après avoir ingurgité les œufs ou les petits juste éclos. Toutefois, on n'a jamais pu observer ce phénomène avant que ces espèces ne soient éteintes. Les têtards sécrétaient une hormone qui inhibait la digestion chez la mère pendant qu'ils se développaient en consommant leur large vitellus[93]. Assa darlingtoni pond ses œufs sur le sol. Quand ils éclosent, le mâle porte les têtards dans des sortes de poches situées au niveau de ses pattes de derrière[94]. Le Crapaud du Surinam (Pipa pipa) est une espèce aquatique qui élève ses petits dans les pores sur son dos où ils demeurent jusqu'à la métamorphose[95]. Oophaga granulifera est une espèce caractéristique des grenouilles arboricoles venimeuses de la famille des Dendrobatidae. Ses œufs sont pondus sur le sol de la forêt et quand ils éclosent, les têtards sont emportés un à un sur le dos d'un adulte vers une crevasse remplie d'eau, à la base d'une feuille ou au cœur de la rosette de broméliacées. La femelle se rend dans les sites où se développent les jeunes et y dépose régulièrement des œufs non fécondés qui sont consommés par les têtards[96].
Alimentation

À quelques exceptions près, les amphibiens adultes sont carnivores, se nourrissant de presque tout ce qui bouge qu'ils sont en mesure d'avaler. Leur régime alimentaire se compose essentiellement de petites proies peu rapides, comme les coléoptères, les chenilles, les vers de terre et les araignées. Les espèces du genre Siren ingèrent souvent des plantes aquatiques en même temps que les invertébrés dont ils se nourrissent[97] et la grenouille arboricole brésilienne Xenohyla truncata inclut une grande quantité de fruits dans son régime alimentaire[98]. Le crapaud mexicain Rhinophrynus dorsalis possède une langue spécialement adaptée pour attraper les fourmis et les termites[99].
Les amphibiens repèrent leurs proies la plupart du temps par la vue, même par faible luminosité. Ce sont notamment les mouvements de la proie qui déclenchent l'attaque de la grenouille. Ainsi, on peut capturer des grenouilles avec un morceau de tissu rouge accroché à un hameçon et on a retrouvé dans l'estomac de grenouilles vertes (Lithobates clamitans) des graines d'orme qu'elles avaient vu flotter[100]. Les crapauds, les salamandres et les cécilies peuvent également utiliser leur odorat pour détecter leurs proies. L'odorat demeure toutefois secondaire, des salamandres ont été observées immobiles près d'une proie sans la sentir, ne la repérant que lorsqu'elle bouge. Les amphibiens troglodytes chassent principalement grâce à leur odorat[101].
Les amphibiens avalent leur nourriture entière, la mâchant parfois légèrement pour l'engloutir[19]. Ils ont de petites dents articulées sur des pédicelles, une caractéristique propre aux amphibiens. La base et le sommet de ces dents sont composés de dentine, et sont séparés par une couche non calcifié. Par ailleurs ces dents sont remplacées régulièrement. Les salamandres, les grenouilles et quelques cécilies ont une ou deux rangées de dents dans les deux mâchoires, mais certaines grenouilles (les espèces du genre Rana) n'ont pas de dents à la mâchoire inférieure, et les crapauds géants (genre Bufo) sont eux dépourvus de dentition. Chez de nombreux amphibiens, on trouve aussi des dents vomériennes, attachées à un os au niveau de la voûte du palais[102].

La Salamandre tigrée (Ambystoma tigrinum) adopte un comportement typique des grenouilles et des salamandres, se cachant sous le couvert en attendant le passage d'un invertébré imprudent. D'autres amphibiens, tels que les crapauds du genre Bufo, recherchent activement leurs proies, tandis que la Grenouille cornue d'Argentine (Ceratophrys ornata) attire ses proies en levant ses pattes de derrière au-dessus de son dos et faisant vibrer ses orteils jaunes[103]. Parmi les grenouilles vivant dans les litières de feuilles au Panama, les grenouilles qui chassent activement ont une bouche étroite et sont minces, arborent souvent de couleurs vives et sont toxiques, tandis que celle qui attendent en embuscade ont une large bouche et sont plus grosses et bien camouflées[104]. Les cécilies ne peuvent pas lancer leur langue, mais attrapent leurs proies grâce à leurs dents pointues et orientées vers l'arrière. Les mouvements de la mâchoire et ceux de la proie qui se débat contribuent à diriger celle-ci petit à petit vers l'estomac de l'animal, qui se retire dans son terrier pour finir de l'avaler entière[105].
Les larves de grenouilles juste écloses se nourrissent du vitellus. Lorsque celui-ci est épuisé, elles se nourrissent de bactéries, d'algues, de détritus et de fragments de plantes submergées. L'eau est aspirée par la bouche et filtrée au niveau des branchies où les particules fines sont piégées dans le mucus. Certains ont des pièces buccales spécialisées composées d'un bec corné bordé par plusieurs rangées de dents labiales. Ils grattent et mordent la nourriture de toutes sortes et remuent les sédiments au fond de l'eau, filtrant les grosses particules avec leurs papilles situées autour de la bouche. Certains, comme ceux des crapauds de la famille des Scaphiopodidae, ont de puissantes mâchoires et sont carnivores, voire cannibales[106].
Cri
.jpg.webp)
Les cris des cécilies et des salamandres sont limités à des grincements, des grognements doux ou des sifflements et n'ont pas été beaucoup étudiés. Les cécilies émettent un cliquetis qui est peut-être utilisé pour s'orienter, à la façon des chauves-souris, ou constitue une forme de communication. La plupart des salamandres sont considérées comme n'émettant aucun bruit, mais la salamandre Dicamptodon ensatus a des cordes vocales et peut produire un cliquetis ou aboyer. Certaines espèces de salamandre poussent un petit cri aigu ou glapissent lorsqu'elles sont attaquées[107].
Les grenouilles sont beaucoup plus bruyantes, surtout pendant la saison de reproduction lorsque les mâles utilisent leur voix pour attirer les femelles. La présence d'une espèce particulière dans une région est parfois plus facilement identifiée par son cri caractéristique que par la vue de l'animal lui-même. Chez la plupart des espèces, le son est produit par expulsion de l'air des poumons à travers les cordes vocales vers un ou plusieurs sacs gulaires situés au niveau de la gorge ou dans le coin de la bouche. Ce sac peut se distendre comme un ballon et agit comme un résonateur, en aidant à transmettre le son vers l'atmosphère ou l'eau lorsque l'animal est immergé[107]. Le cri le mieux connu est le bruyant chant du mâle, qui vise à attirer les femelles mais également décourager les autres mâles de pénétrer sur son territoire. Ce chant devient plus discret lors de la séduction d'une femelle s'approchant, et plus agressif si un intrus mâle approche. Ce chant risque d'attirer les prédateurs et implique une forte dépense d'énergie[108]. La femelle chante en réponse à l'appel du mâle. Quand une grenouille est attaquée, elle émet un cri de détresse ou de peur[109]. Osteopilus septentrionalis, une rainette généralement nocturne, chante lorsqu'il pleut pendant la journée[110].
Comportement territorial
On connait mal le comportement territorial des cécilies, mais certaines grenouilles et les salamandres défendent leurs domaines vitaux, où elles s'alimentent et se reproduisent. Ce sont principalement les mâles qui présentent un tel comportement, mais chez certaines espèces les femelles et les jeunes sont impliqués. Chez de nombreuses espèces de grenouilles, les femelles sont plus grandes que les mâles, mais ce n'est pour les espèces où les mâles défendent activement leur territoire. Certains d'entre eux possèdent des adaptations spécifiques telles que des dents plus grandes ou des épines sur la poitrine, les bras ou les doigts[111].

Les salamandres défendent leur territoire en adoptant une posture agressive et en attaquant l'intrus si nécessaire, en le poursuivant, le chassant et parfois le mordant, ce qui peut parfois engendrer la perte de sa queue. Le comportement de la Salamandre cendrée (Plethodon cinereus) a été étudié tout particulièrement. Ainsi, suivant l'étude, 91 % des individus de cette espèce marqués et repris par la suite étaient situés à moins d'un mètre de leur lieu de capture initiale[112]. Une proportion semblable d'animaux, qui ont été déplacés à une distance de 30 mètres de leur lieu de capture, ont retrouvé leur chemin pour retourner à leur base[112]. Les salamandres laissent des marques odorantes autour de leurs territoires qui mesurent en moyenne de 0,16 à 0,33 mètre carré et sont habités par un couple[113]. Il s'agit de dissuader l'intrusion d'intrus et de délimiter les frontières entre territoires. Une grande partie du comportement de ces salamandres est stéréotypé et semble ne faire appel à aucun contact réel entre individus. Il lui arrive de prendre une posture agressive en soulevant son corps au-dessus du sol et regardant fixement son adversaire qui, souvent, se détourne docilement. Si l'intrus persiste, la salamandre mord l'intrus, au niveau de la queue ou à la région nasolabiale[112].
Chez les grenouilles, le mâle a un comportement territorial souvent observé dans des lieux de reproduction. Son chant est à la fois l'annonce de sa présence sur le territoire pour d'éventuels concurrents, mais aussi un appel aux femelles. En général, un chant plus grave correspond à une grenouille plus grosse, ce qui peut être suffisant pour empêcher l'intrusion de petits mâles. Ce chant demande beaucoup d'énergie, et le détenteur d'un territoire s'épuise donc, ce qui peut le handicaper en cas de lutte face à un concurrent. Généralement les mâles ont tendance à tolérer les détenteurs de territoires voisins, mais s'attaquent vigoureusement aux intrus inconnus. Les détenteurs de territoires ont l’« avantage du terrain » en cas de lutte, et remportent généralement les luttes entre des grenouilles de tailles similaires. Si les menaces sont insuffisantes, les grenouilles s'empoignent poitrine contre poitrine. Les grenouilles se battent en se bousculant, dégonflant le sac gulaire de leur adversaire, le saisissant par la tête, lui sautant sur le dos, le mordant ou l'éclaboussant[114].
Mécanismes de défense

Les amphibiens ont un corps mou et la peau fine, et comme ils sont démunis de griffes, de carapace ou d'épines, ils semblent relativement impuissants. Néanmoins, ils ont développé divers mécanismes de défense pour se protéger. La première défense des salamandres et des grenouilles est le mucus qu'elles produisent. Il maintient leur peau humide et les rend glissantes et difficiles à saisir. La sécrétion est souvent collante et peut avoir une odeur désagréable ou être toxique[115]. Des serpents ont été observés bâillant et ouvrant la gueule en tentant d'avaler des Xenopus laevis, offrant aux grenouilles une occasion de s'échapper[115] - [116]. Les cécilies ont été peu étudiées à ce sujet, mais Typhlonectes compressicauda produit un mucus toxique mortel pour les poissons prédateurs, comme l'a montré une expérimentation au Brésil[117]. Chez certaines salamandres, la peau est toxique. Le Triton rugueux (Taricha granulosa) d'Amérique du Nord et d'autres membres du même genre produisent la neurotoxine tétrodotoxine (TTX), la substance non protéique la plus toxique connue, presque identique à celle produite par le poisson-globe. La manipulation de ces tritons n'est pas dangereuse, mais l'ingestion d'une portion même infime de la peau est mortelle. Les poissons, les grenouilles, les reptiles, les oiseaux et les mammifères ont tous été révélés sensibles à ce poison[118] - [119]. Les seuls prédateurs qui tolèrent le poison sont certaines populations de Couleuvre rayée (Thamnophis sirtalis). Dans les lieux où ce serpent et le triton coexistent, les serpents ont développé une immunité génétique et ils se nourrissent des amphibiens sans risque[120]. Certaines grenouilles et les crapauds sont toxiques, les principales glandes à venin étant situées sur le côté du cou et sous les verrues du dos. Ces régions sont celles susceptibles d'être attaquées par un prédateur en priorité, et leurs sécrétions peut donner un goût désagréable ou provoquer divers symptômes physiques ou neurologiques. Au total, plus de 200 toxines ont été isolées parmi les espèces d'amphibiens qui ont été étudiées[121].


Les espèces vénéneuses revêtent souvent des couleurs vives pour avertir les prédateurs potentiels de leur toxicité. Ces couleurs sont généralement le rouge ou le jaune combiné avec le noir, la Salamandre tachetée (Salamandra salamandra) en est un exemple. Une fois qu'un prédateur a eu affaire à l'un d'eux, il lui est facile de se rappeler sa coloration et il se ravisera la prochaine fois qu'il rencontrera un animal semblable. Chez certaines espèces comme les Crapauds sonneurs (genre Bombina), la coloration d'avertissement est placée sur le ventre et ces animaux adoptent une pose défensive en cas d'attaque, présentant leurs couleurs vives au prédateur. La grenouille Allobates zaparo n'est pas toxique, mais imite l'apparence d'autres espèces toxiques partageant son aire de répartition, une stratégie qui peut tromper les prédateurs[123].
De nombreux amphibiens sont nocturnes et se cachent pendant la journée, évitant ainsi des prédateurs diurnes qui chassent à vue. D'autres amphibiens utilisent le camouflage pour éviter d'être détectés. Ils adoptent des colorations diverses comme le brun tacheté, le gris et l'olive et se fondent dans le paysage environnant. Certaines salamandres adoptent une posture défensive face à un prédateur potentiel comme la Grande musaraigne (Blarina brevicauda). Elles tordent leur corps et font fouetter leur queue, ce qui rend difficile pour le prédateur d'éviter le contact avec leurs glandes productrices de poison[124]. Quelques salamandres pratiquent l'autotomie, perdant leur queue lorsqu'elles sont attaquées, sacrifiant cette partie du corps pour leur permettre de s'échapper. La queue peut alors présenter un rétrécissement à sa base pour lui permettre d'être facilement détachée. Elle se régénère par la suite, mais au prix d'une importante dépense en énergie pour l'animal[125].
Certaines grenouilles et les crapauds se gonflent pour paraître plus imposants, et certains crapauds du genre Pelobates crient et sautent vers le prédateur pour l'impressionner et le repousser[19]. Les salamandres géantes du genre Andrias, ainsi que certaines grenouilles de la sous-famille des Ceratophryinae et du genre des Pyxicephalus possèdent des dents pointues et sont capables de mordre leur adversaire jusqu'au sang. La salamandre Desmognathus quadramaculatus peut mordre un serpent Thamnophis sirtalis deux ou trois fois plus grand qu'elle au niveau de la tête et réussit souvent à s'échapper[126].
Systématique et phylogénie

L'apparition des amphibiens
Les premiers animaux « amphibiens » apparaissent lors de la terrestrialisation des tétrapodes au cours du Dévonien, il y a environ 370 millions d'années. Les nageoires de poissons sarcoptérygiens semblables au cœlacanthe et aux dipneustes modernes[130], évoluent pour devenir semblables à des pattes, munies de doigts, leur permettant de ramper sur les fonds marins. Certains de ces poissons développent des poumons primitifs pour les aider à respirer à l'air libre dans les eaux stagnantes des marais du Dévonien, très peu pourvues en oxygène. Ils peuvent également utiliser leurs nageoires puissantes pour se hisser hors de l'eau si les circonstances l'exigeaient. Finalement, leurs nageoires osseuses finissent d'évoluer pour former de véritables pattes, que l'on retrouve par la suite chez l'ensemble des tétrapodes, dont les amphibiens modernes, les reptiles, les oiseaux et les mammifères. Même s'ils sont capables de ramper sur la terre, beaucoup de ces « poissons » préhistoriques passent le plus clair de leur temps dans l'eau ; s'ils ont commencé à développer des poumons, il respirent encore principalement par les branchies[131]. Les premiers amphibiens, au sens non-cladistique du terme, connus sont les ichthyostégidés. Leurs traces ont été découvertes sur la côte est du Groenland dans les couches fossilifères datées du Dévonien supérieur, de 367 Ma à 362 Ma[132]). Ils constituent un des plus remarquables échelons intermédiaires de l'évolution jamais découverts, car ils réunissent à la fois des caractéristiques des poissons ostéichthyens et des amphibiens. Comme les amphibiens actuels, ils possèdent quatre membres puissants et un cou, mais une queue à nageoires et un crâne très similaire à celui des poissons sarcoptérygiens comme Eusthenopteron[130]. Les ichthyostégidés ne sont probablement pas les ancêtres directs de tous les amphibiens apparus plus tard. En effet, par certains détails de leur squelette, ils étaient déjà plus spécialisés que d'autres amphibiens plus tardifs. Mais ils étaient presque certainement semblables aux animaux à partir desquels évoluèrent tous les vertébrés terrestres.

Les amphibiens ont développé peu à peu un certain nombre d'adaptations leur permettant de rester hors de l'eau pendant de longues périodes. Leurs poumons se sont améliorés et leur squelette est devenu de plus en plus robuste, pour mieux supporter la gravité lorsqu'ils étaient sur terre. Ils se sont dotés de « mains » et de « pieds » avec cinq doigts ou plus[133] ; leur peau est devenue capable de retenir les fluides corporels et de résister au dessèchement[131]. L'os hyomandibulaire des poissons, situé dans la région de l'os hyoïde, derrière les branchies, a vu sa taille se réduire et est petit à petit devenu l'étrier de l'oreille des amphibiens, une adaptation nécessaire à l'audition sur la terre ferme[134]. Les amphibiens ont par ailleurs des points communs avec les poissons téléostéens, comme la structure multi-pliée des dents et la paire d'os supra-occipital à l'arrière de la tête, ces caractéristiques n'ayant été observées chez nulle autre espèce dans le règne animal[135].
À la fin du Dévonien (il y a 360 millions d'années), les mers, les fleuves et les lacs grouillent de vie alors que la terre est le royaume des premières plantes et reste dépourvue de vertébrés[135], même si certains, comme Ichthyostega, peuvent brièvement vivre hors de l'eau. On pense qu'ils sortent de l'eau grâce à leurs membres antérieurs, traînant leurs arrière-train d'une manière similaire à l'éléphant de mer[133]. Au début du Carbonifère (il y a entre 360 et 345 millions d'années), le climat devient chaud et humide. De vastes marécages se développent avec des mousses, des fougères, des prêles et des calamites. Des arthropodes à respiration aérienne sont déjà apparus sur terre, et s'y sont fortement propagés, fournissant une source de nourriture pour les amphibiens carnivores, qui commencent alors à s'adapter à l'environnement terrestre. Il n'y a alors pas d'autres tétrapodes sur terre et les amphibiens sont au sommet de la chaîne alimentaire, détenant la niche écologique actuellement occupée par le crocodile. Pourvus de membres et capable de respirer de l'air, la plupart ont encore un long corps effilé et une queue puissante[135]. Les amphibiens sont les premiers prédateurs terrestres, atteignant parfois plusieurs mètres de longueur, se nourrissant des gros insectes et de certains poissons.

Les amphibiens développent de nouveaux moyens de locomotion. Dans l'eau, les mouvements latéraux de leur queue leur permettait de se propulser vers l'avant, mais sur la terre ferme, des mécanismes tout à fait différents sont nécessaires. Leur colonne vertébrale, leurs membres et leur musculature doivent être suffisamment robustes pour que les animaux puissent se déplacer et s'alimenter sur la terre ferme. Les adultes ont développé de nouveaux systèmes sensoriels pour recevoir les stimuli extérieurs à l'air libre, aux dépens de leur ligne latérale. Ils développent également de nouvelles méthodes pour réguler leur température corporelle malgré les fluctuations de la température ambiante. Leur peau, exposée désormais à des rayons ultraviolets nocifs qui étaient absorbés par l'eau, devient une couverture plus protectrice, capable d'éviter de trop fortes déperditions d'eau[6]. Ils ont encore besoin de retourner à l'eau pour pondre leurs œufs dépourvus de coquille, particularité qui caractérise toujours les amphibiens modernes, qui conservent un stade larvaire aquatique avec une respiration par branchies, comme leurs ancêtres poissons. C'est le développement de l'œuf amniotique, qui empêche à l'embryon en développement de se dessécher, qui a permis aux premiers reptiles de se reproduire sur la terre et qui a conduit à leur domination dans la période suivante[130].

Au cours du Trias (250 à 200 millions d'années avant notre ère), les reptiles commencent à supplanter les amphibiens, ce qui conduit à une réduction de la taille de ces derniers, et surtout à leur moindre importance dans la biosphère. Selon les fossiles, Lissamphibia, qui comprend tous les amphibiens modernes et est la seule lignée survivante, aurait dérivé des groupes disparus des Temnospondyli et Lepospondyli entre la fin du Carbonifère et le début du Trias. La relative rareté des fossiles empêche une datation plus précise[131], mais une étude moléculaire de 2010, fondée sur plusieurs gènes, suggère que les amphibiens modernes seraient apparus vers la fin du Carbonifère ou au tout début du Permien[136].
Frontières du groupe des amphibiens
Le nom de classe « Amphibia » et le terme « amphibien » sont dérivés de l'adjectif amphibie, qui provient lui-même du grec ancien ἀμφίβιος (amphíbios) signifiant « qui vit dans deux éléments ». Classiquement, cette classe regroupe tous les vertébrés tétrapodes qui ne sont pas des amniotes mais possédant un stade larvaire ; les amphibiens sont le grade évolutif des tétrapodes dont les embryons ne sont pas protégés par un amnios. En taxinomie classique, ce groupe est divisé en trois sous-classes, dont deux sont éteintes :
- † sous-classe Lepospondyli (peut-être paraphylétique) — du Carbonifère et début du Permien
- † sous-classe Labyrinthodontia (paraphylétique) — du Paléozoïque et début du Mésozoïque
- † ordre Ichthyostegalia (paraphylétique)
- † ordre Temnospondyli (peut-être paraphylétique)
- † ordre Reptiliomorpha (paraphylétique)
- sous-classe Lissamphibia
- † ordre Allocaudata Fox and Naylor, 1982 — Albanerpetontidae, famille aux espèces proches des grenouilles et salamandres
- ordre Anura Fischer von Waldheim, 1813 — du Jurassique à l'ère actuelle : 6 200 espèces actuelles de crapauds et grenouilles
- ordre Caudata Fischer von Waldheim, 1813 — du Jurassique à l'ère actuelle : près de 650 espèces actuelles de tritons et salamandres
- ordre Gymnophiona Müller, 1832 — du Jurassique à l'ère actuelle : un peu moins de 200 espèces actuelles de cécilies
La phylogénie a fait tomber en désuétude le groupe des Labyrinthodontia, qui s'est avéré paraphylétique et sans caractère commun à tous ses membres à l'exception de caractéristiques primitives. Les relations entre les différents groupes sont cependant difficiles à élucider sans fossiles clés[137]. Pour certains auteurs, les lissamphibiens sont nichés au sein des Temnospondyli. Pour d'autres, comme Laurin, ce dernier est extérieur aux tétrapodes et il faut alors définir le groupe des amphibiens comme incluant les animaux plus proches des amniotes que des autres stégocéphales, c'est-à-dire comprenant le groupe paraphylétique des Lépospondyles ainsi que les amphibiens actuels, les Lissamphibiens[138] : si l'ancêtre commun des amphibiens et des amniotes était inclus dans les Amphibia, celui-ci deviendrait un groupe paraphylétique[139].
| Phylogénie partielle des tétrapodes traditionnelle | Phylogénie partielle des tétrapodes selon Laurin et Reisz (1997)[140], controversée |
|---|---|
| Les groupes marqués d'une étoile (*) correspondent au groupe paraphylétique des Lépospondyles. | |
Origine des amphibiens actuels
Le groupe particulier comprenant l'ancêtre de tous les amphibiens actuels et ses descendants est appelé Lissamphibia. La phylogénie des amphibiens du Paléozoïque est incertaine, et les Lissamphibia pourraient possiblement être placés dans d'autres groupes, éteints, comme les Temnospondyli (classiquement placés parmi les Labyrinthodontia) ou les Lepospondyli ; certaines études les placent même aux côtés des amniotes. Tout cela fait que la classification phylogénétique a enlevé des Amphibia de la taxinomie linnéenne un certain nombre de tétrapodes aux allures d'amphibiens primitifs du Dévonien et du Carbonifère[1].
Les origines des trois principaux groupes d'amphibiens et leurs liens de parenté sont sujets à débat. Une étude sur la phylogénie de ces animaux de 2005, basée sur l'analyse moléculaire d'ADNr, suggère que les salamandres et cécilies sont plus étroitement liées entre elles qu'elles ne le sont aux grenouilles. Il apparaît également que la scission entre les trois groupes a eu lieu au cours du Mésozoïque ou à la fin du Paléozoïque (il y a environ 250 millions d'années), avant l'éclatement de la Pangée et peu de temps après leur divergence avec les poissons à nageoires lobées. La brièveté de cette période, et la rapidité avec laquelle le rayonnement des espèces a eu lieu, permettrait d'expliquer la relative rareté des fossiles d'amphibiens primitifs[141]. Il existe d'importantes lacunes dans les fossiles retrouvés, mais la découverte de Gerobatrachus, une proto-grenouille du début du Permien découverte au Texas en 1995 et décrite en 2008, présentant de nombreuses caractéristiques communes avec les grenouilles modernes a fourni un chaînon manquant. L'analyse moléculaire suggère que la divergence entre grenouilles et salamandres a eu lieu beaucoup plus tôt que les preuves paléontologiques ne l'indiquent[142]. Cependant, sa position est débattue[143].
Les travaux utilisant l'horloge moléculaire de ces groupes ont obtenu des résultats assez variés. Ils laissent à penser que la séparation entre gymnophiones et batraciens au sens strict du terme (groupe incluant urodèles et anoures) date du Dévonien supérieur[144] - [145], du Carbonifére supérieur[146], ou même du Permien inférieur[147]. Le fossile le plus ancien qui appartient peut-être à ce groupe date du Permien inférieur[142], mais sa position systématique est débattue[143]. Les plus anciens fossiles dont les affinités avec les amphibiens actuels ne sont pas contestées sont Triadobatrachus et Czatkobatrachus, qui datent du Trias inférieur (environ 250 millions d'années).
| Phylogénie partielle des Amphibia selon Cannatella (Tolweb, 2007)[148] : | |
|
La sous-classe des Lissamphibia forme probablement un clade et regroupe les trois ordres d'amphibiens actuels — les Anura (les grenouilles et crapauds), les Caudata (ou « Urodela », les salamandres et tritons) et les Gymnophiona (ou « Apoda », les cécilies)[15] — ainsi que d'autres groupes éteints qui ne font pas partie d'un ordre particulier — certains Salientia primitifs comme Triadobatrachus ou Czatkobatrachus, la famille des Albanerpetontidae qui est fortement apparentée aux Gymnophiona. Il a été suggeré que les Caudata aient émergé séparément des deux autres ordres depuis un ancêtre aux allures de Temnospondyli, ou même que les Gymnophiona soient le groupe-frère des Reptiliomorpha, et donc des amniotes[142].
Bien que l'on connaisse plusieurs anciens fossiles de proto-grenouilles arborant des caractères primitifs, le plus ancien anoure « vrai » est Prosalirus bitis, du Jurassique inférieur, trouvé dans la formation de Kayenta, en Arizona[149]. La plus ancienne cécilie connue est une autre espèce du Jurassique inférieur et également trouvée en Arizona, Eocaecilia micropodia[150]. Le plus ancien Salamandroidea connu est Beiyanerpeton jianpingensis, date du Jurassique supérieur et a été trouvée dans le nord-est de la Chine[151].
Diversité actuelle
Une étude de 2007 menée par Alford, Richards et McDonald estime le nombre total des amphibiens entre 8 000 et 10 000 espèces[152], précisant que bon nombre d'espèces ne sont pas encore découvertes. Ainsi au début les années 1990, plus de 100 espèces de grenouilles arboricoles de la famille des rhacophoridés ont été découvertes sur l'ile de Sri Lanka. Ceci est d'autant plus étonnant que bon nombre d'espèces décrites au XIXe siècle semble avoir disparu. Si l'on connaît alors 5 000 espèces de grenouilles, les estimations de ces chercheurs indiquent qu'un millier d'espèces sont encore inconnues. 80 % des espèces connues vivent dans les régions tropicales, l'Amérique du Sud étant le foyer principal de cette biodiversité[152]. Alford, Richards et McDonald soulignent également que des plus de 500 espèces de salamandres connues, un grand nombre vit en Amérique du Nord ; la famille des pléthodontidés, qui se trouve en Amérique du Nord et du Sud, rassemble plus de la moitié des salamandres connues[152].
| Ordre | Familles | Genres | Espèces |
|---|---|---|---|
| Anoures | 54 | 434 | 6 200 |
| Caudata | 9 | 65 | 652 |
| Gymnophiona | 10 | 34 | 192 |
| Total | 73 | 533 | 7 044 |
Le nombre d'espèces actuelles de chaque groupe dépend de la classification taxinomique suivie. Deux principales existent pour le groupe des amphibiens. La première est celle suivie par AmphibiaWeb, site géré par l'Université de Californie (Berkeley) et la seconde celle maintenue par l'herpétologiste Darrel Frost du muséum américain d'histoire naturelle, disponible sur la base de données en ligne Amphibian Species of the World[153]. Selon Frost on dénombre en tout plus de 7 000 espèces d'amphibiens actuels (version 5.6 de janvier 2013), dont les anoures représentent près de 90 %[154]. Les principaux groupes taxinomiques sont ainsi répartis :
Déclin

Des baisses spectaculaires des populations d'amphibiens, dont des extinctions de masse localisées, ont été enregistrées depuis la fin des années 1980 un peu partout dans le monde, et le déclin des amphibiens est perçu comme étant l'une des menaces les plus graves pour la biodiversité mondiale[155]. En 2006, on recensait 4 035 espèces d'amphibiens dépendant de l'eau à un moment donné au cours de leur cycle de vie. Parmi celles-ci, 1 356 (33,6 %) ont été considérées comme menacées, et ce chiffre est peut-être sous-estimé car il exclut 1 427 espèces pour lesquelles il n'y avait pas suffisamment de données pour évaluer leur situation[156]. Un certain nombre de causes sont impliquées, comme notamment la destruction et la modification de l'habitat de ces animaux, la pollution, les espèces introduites, le changement climatique, les polluants perturbateurs du système endocrinien, la destruction de la couche d'ozone (le rayonnement ultraviolet est particulièrement dommageable pour la peau, les yeux et les œufs d'amphibiens), et des maladies comme la chytridiomycose. Ce déclin massif est même observé dans des zones isolées (forêt tropicale) ou peu cultivées et montagneuses en Europe (par exemple Suisse où 9 espèces sont sur la Liste rouge classées comme en danger critique d'extinction[157]). Toutefois, bon nombre des causes de déclin des amphibiens sont encore mal comprises, et elles sont un sujet de débat en cours[158].

Avec leurs besoins complexes en matière de reproduction et leur peau perméable, les amphibiens sont souvent considérés comme de bons indicateurs écologiques[159]. Dans de nombreux écosystèmes terrestres, ils constituent une des plus grandes parties de la biomasse des vertébrés. Toute baisse du nombre d'amphibiens aura un impact sur les habitudes de prédation d'autres espèces qui pourraient être impactées. La perte d'espèces carnivores situées près du sommet de la chaîne alimentaire peut bouleverser l'équilibre d'un écosystème délicat et entraîner une augmentation spectaculaire des espèces opportunistes. Au Moyen-Orient, une demande croissante en cuisses de grenouilles pour la consommation humaine et la collecte conséquente de certains d'entre eux a conduit à une augmentation du nombre de moustiques[160]. Les prédateurs qui se nourrissent d'amphibiens sont affectés par ce déclin. En Californie, la Couleuvre de l'Ouest (Thamnophis elegans) est essentiellement aquatique et dépend fortement de deux espèces d'anoures qui sont en déclin, le crapaud Bufo canorus et la grenouille Rana muscosa, et l'avenir de ce serpent est donc lui aussi remis en question. Si le serpent devenait rare, cela pourrait affecter les populations d'oiseaux de proie et d'autres prédateurs qui s'en nourrissent[161]. Pendant ce temps, dans les étangs et les lacs, moins de grenouilles signifie moins de têtards. Ceux-ci jouent normalement un rôle important dans le contrôle de la croissance des algues et des détritus qui s'accumulent dans les sédiments au fond de l'eau. Une réduction du nombre de têtards peut conduire à une prolifération d'algues, ce qui entraîne l'épuisement de l'oxygène dans l'eau lorsque les algues se décomposent. Les invertébrés aquatiques et les poissons sont alors menacés et il y aurait des conséquences écologiques imprévisibles[162].
Une stratégie globale pour endiguer ce déclin a été mise en place en 2005 sous la forme d'un plan d'action pour la conservation des amphibiens. Développé par plus de quatre-vingt des plus grands experts dans le domaine, cet appel recensait des actions qui seraient nécessaires pour limiter le déclin des amphibiens et les extinctions au cours des cinq années suivantes et en estimait le coût. L'Amphibian Specialist Group de l'Union mondiale pour la nature (UICN) est le fer de lance des efforts pour mettre en œuvre une stratégie globale mondiale pour la conservation des amphibiens[163]. Amphibian Ark est un organisme qui a été créé pour mettre en œuvre les recommandations de conservation ex-situ de ce plan, et cet organisme travaille avec les zoos et les aquariums du monde entier, pour les encourager à créer des colonies d'amphibiens menacés et en assurer ainsi la préservation au moins en captivité[163]. Parmi ses projets on note aussi la tentative de sauvetage des amphibiens de Panama qui s'appuie sur les efforts de conservation en vigueur au Panama pour répondre à l'échelle nationale à la menace de la chytridiomycose[164].
Annexes
Articles connexes
Bibliographie
- (en) R. L. Dorit, W. F. Walker et R. D. Barnes, Zoology, Saunders College Publishing, , 1009 p. (ISBN 978-0-03-030504-7)
- Losange, Amphibiens & reptiles, Paris, Editions Artemis, coll. « Découverte nature », , 127 p. (ISBN 978-2-84416-650-0 et 2-84416-650-4)
- (en) Ross A. Alford (dir.), Stephen J. Richards et Keith R. McDonald, Encyclopedia of Biodiversity, (ISBN 978-0-12-226865-6 et 0-12-226865-2), « Amphibians, Biodiversity of », p. 1-12
- (en) Robert C. Stebbins et Nathan W. Cohen, A Natural History of Amphibians, Princeton University Press, , 316 p. (ISBN 978-0-691-03281-8, lire en ligne)
- (en) Kentwood David Wells, The Ecology & Behavior of Amphibians, Chicago, University of Chicago Press, , 1148 p. (ISBN 978-0-226-89335-8)
- Claude Miaud et Jean Muratet, Les amphibiens de France ; Guide d'identification des œufs et des larves, Versailles/93-La Plaine-Saint-Denis, Éditions Quæ, , 226 p. (ISBN 978-2-7592-2664-1, lire en ligne)
Références taxinomiques
- (fr+en) Référence ITIS : Amphibia (consulté le )
- (en) Référence Catalogue of Life : Amphibia (consulté le )
- (en) Référence Fauna Europaea : Amphibia (consulté le )
Liens externes
- (en) Référence Animal Diversity Web : Amphibia (consulté le )
- (en) Référence NCBI : Amphibia (taxons inclus) (consulté le )
- (en) Référence Tree of Life Web Project : Amphibia (consulté le )
- (en) Référence uBio : site déclaré ici indisponible le 7 avril 2023
- Site du Declining Amphibian Population Task Force
- Site de l'équipe de protection des Amphibiens (Species Survival Commission)
- Ressources relatives au vivant :
- Global Biodiversity Information Facility
- (en) Amphibian Species of the World
- (en) Animal Diversity Web
- (en) Australian Faunal Directory
- (sv) Dyntaxa
- (en) EPPO Global Database
- (en) EU-nomen
- (en) Fauna Europaea
- (en) Paleobiology Database
- (mul + en) iNaturalist
- (en) Interim Register of Marine and Nonmarine Genera
- (nl) Nederlands Soortenregister
- (en + en) New Zealand Organisms Register
- (en) Plazi
- (en) Système d'information taxonomique intégré
- (en) World Register of Marine Species
- (en) ZooBank
- Ressource relative à la santé :
- Notices dans des dictionnaires ou encyclopédies généralistes :
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Amphibian » (voir la liste des auteurs).
- (en) D.C. Blackburn et D.B. Wake, « Class Amphibia Gray, 1825. In: Zhang, Z.-Q. (Ed.) Animal biodiversity: An outline of higher-level classification and survey of taxonomic richness », Zootaxa, vol. 3148, , p. 39–55 (lire en ligne)
- Sébastien Steyer, La Terre avant les dinosaures, éd. Belin, 2009, p. 94-95.
- « En Colombie, un labo contre les amphibiens mal acquis », sur Libération.fr,
- (en) Michel Laurin, « Terrestrial Vertebrates », sur Tree of Life Web Project, (consulté le )
- (en) Michel Laurin et Jacques A. Gauthier, « Amniota », sur Tree of Life Web Project, (consulté le )
- Dorit 1991, p. 843-859
- (en) James L. Sumich et John F. Morrissey, Introduction to the Biology of Marine Life, Jones & Bartlett Learning, , 449 p. (ISBN 978-0-7637-3313-1, lire en ligne), p. 171
- « Le plus petit vertébré du monde est… une grenouille », Le Point.fr, (lire en ligne).
- (en) Eric N. Rittmeyer, Allen Allison, Michael C. Gründler, Derrick K. Thompson et Christopher C. Austin, « Ecological guild evolution and the discovery of the world's smallest vertebrate », PLoS ONE, vol. 7, no 1, , e29797 (PMID 22253785, PMCID 3256195, DOI 10.1371/journal.pone.0029797)
- « Quel est le plus grand amphibien actuel », sur Futura-science, (consulté le ).
- (en) Brent Nguyen et John Cavagnaro, « Amphibian Facts », AmphibiaWeb, (consulté le ).
- R.R. Schoch, « Comparative osteology of Mastodonsaurus giganteus (Jaeger, 1828) from the Middle Triassic (Lettenkeuper: Longobardian) of Germany (Baden-Württemberg, Bayern, Thüringen) », Stuttgarter Beiträge zur Naturkunde Serie B, vol. 278, , p. 1–175 (lire en ligne)
- Roland Bauchot, Cassian Bon et Patrick David, Serpents, Éditions Artemis, , p. 76.
- Stebbins 1995, p. 24-25.
- Stebbins 1995, p. 3.
- (en) David Cannatella et Anna Graybeal, « Bufonidae, True Toads », sur Tree of Life Web Project, (consulté le )
- (en) « Frog fun facts », American Museum of Natural History, (consulté le ).
- (en) David Challenger, « World's smallest frog discovered in Papua New Guinea », sur CNN.com, (consulté le ).
- (en) Nicholas Arnold et Denys Ovenden, Reptiles and Amphibians of Britain and Europe, Harper Collins Publishers, , 13–18 p. (ISBN 978-0-00-219318-4).
- (en) J. Faivovich, C.F.B. Haddad, P.C.A. Garcia, D.R. Frost, J.A. Campbell et W.C. Wheeler, « Systematic review of the frog family Hylidae, with special reference to Hylinae: Phylogenetic analysis and revision », Bulletin of the American Museum of Natural History, vol. 294, , p. 1–240 (DOI 10.1206/0003-0090(2005)294[0001:SROTFF]2.0.CO;2).
- (en) L.S. Ford et D.C. Cannatella, « The major clades of frogs », Herpetological Monographs, vol. 7, , p. 94–117 (DOI 10.2307/1466954).
- (en) Diego San Mauro, Miguel Vences, Marina Alcobendas, Rafael Zardoya et Axel Meyer, « Initial diversification of living amphibians predated the breakup of Pangaea », American Naturalist, vol. 165, no 5, , p. 590–599 (PMID 15795855, DOI 10.1086/429523).
- (en) A. Larson et W. Dimmick, « Phylogenetic relationships of the salamander families: an analysis of the congruence among morphological and molecular characters », Herpetological Monographs, vol. 7, no 7, , p. 77–93 (DOI 10.2307/1466953, JSTOR 1466953).
- Losange2008, p. 9
- (en) David Baum, « Trait Evolution on a Phylogenetic Tree: Relatedness, Similarity, and the Myth of Evolutionary Advancement », Nature Education, vol. 1, , p. 191 (lire en ligne).
- (en) David B. Wake, « Thorius pennatulus », AmphibiaWeb, (consulté le ).
- (en) Max Sparreboom, « Andrias davidianus Chinese giant salamander », AmphibiaWeb, (consulté le )
- Dorit 1991, p. 852.
- Rüdiger Wehner et Walter Gehring (trad. de l'allemand), Biologie et physiologie animales : bases moléculaires, cellulaires, anatomiques et fonctionnelles, Paris/Bruxelles/s.l., De Boeck Université, , 844 p. (ISBN 2-7445-0009-7 et 9782744500091), p. 216.
- (en) Heather Heying, « Cryptobranchidae », sur Animal Diversity Web, University of Michigan, (consulté le ).
- (en) J. Mayasich, D. Grandmaison et C. Phillips, « Eastern Hellbender Status Assessment Report », U.S. Fish and Wildlife Service, (consulté le ).
- (en) David B Wake, « Caudata », sur Encyclopædia Britannica Online, Encyclopædia Britannica (consulté le ).
- (en) H. G. Cogger et R. G Zweifel, Encyclopedia of Reptiles and Amphibians, Academic Press, , 69–70 p. (ISBN 978-0-12-178560-4).
- Stebbins 1995, p. 4.
- Dorit 1991, p. 858.
- (en) William E. Duellman, « Gymnophiona », sur Encyclopædia Britannica Online, Encyclopædia Britannica (consulté le ).
- (en) Louise Zylberberg et Marvalee H. Wake, « Structure of the scales of Dermophis and Microcaecilia (Amphibia: Gymnophiona), and a comparison to dermal ossifications of other vertebrates », Journal of Morphology, vol. 206, no 1, , p. 25–43 (DOI 10.1002/jmor.1052060104)
- Roger Eckert (trad. de l'anglais), Physiologie animale : mécanismes et adaptations, Paris/Bruxelles, De Boeck Université, , 822 p. (ISBN 2-7445-0053-4 et 9782744500534), p. 575
- (en) Paul D. N. Hebert, « Amphibian morphology and reproduction », sur Encyclopedia of Earth, Biodiversity Institute of Ontario, (consulté le )
- Stebbins 1995, p. 10-11
- Losange 2008, p. 12
- (en) R. I. C. Spearman, The Integument : A Textbook of Skin Biology, Cambridge University Press, , 208 p. (ISBN 978-0-521-20048-6, lire en ligne), p. 81
- Biodiversité : découverte de la première grenouille fluorescente, Futura-Sciences, 17 mars 2017
- Dorit 1991, p. 846
- Stebbins 1995, p. 26-36
- Stebbins 1995, p. 26-36
- (en) John T. Jr. Beneski, « Adaptive significance of tail autotomy in the salamander, Ensatina », Journal of Herpetology, vol. 23, no 3, , p. 322–324 (DOI 10.2307/1564465)
- Dorit 1991, p. 306
- Stebbins 1995, p. 100
- Stebbins 1995, p. 69
- (en) William E. Duellman et George R. Zug, « Amphibian », sur Encyclopædia Britannica Online, Encyclopædia Britannica, (consulté le )
- Dorit 1991, p. 847
- Stebbins 1995, p. 66
- Dorit 1991, p. 849
- Jacques Hourdry et André Beaumont, Les métamorphoses des amphibiens, Masson, , p. 11.
- (en) Nikolay Natchev, Nikolay Tzankov et Richard Geme, « Green frog invasion in the Black Sea: habitat ecology of the Pelophylax esculentus complex (Anura, Amphibia) population in the region of Shablenska Тuzla lagoon in Bulgaria », Herpetology Notes, vol. 4, , p. 347–351 (lire en ligne)
- (en) C. Michael Hogan, « Abiotic factor », sur Encyclopedia of Earth, National Council for Science and the Environment, (consulté le )
- Stebbins 1995, p. 140-141
- (en) Willia E. Duellman et Linda Trueb, Biology of Amphibians, JHU Press, , 77–79 p. (ISBN 978-0-8018-4780-6, lire en ligne)
- Stebbins 1995, p. 154-162
- (en) Michael J. Adams et Christopher A. Pearl, « Ascaphus truei », AmphibiaWeb, (consulté le )
- (en) Sakae Kikuyama, Kousuke Kawamura, Shigeyasu Tanaka et Kakutoshi Yamamoto, International Review of Cytology : A Survey of Cell Biology, San Diego, Academic Press, , 105–126 p. (ISBN 978-0-12-364548-7, lire en ligne), « Aspects of amphibian metamorphosis: Hormonal control »
- (en) Robert A. Newman, « Adaptive plasticity in amphibian metamorphosis », BioScience, vol. 42, no 9, , p. 671–678 (DOI 10.2307/1312173, JSTOR 1312173)
- (en) Perry W. Gilbert, « Observations on the eggs of Ambystoma maculatum with especial reference to the green algae found within the egg envelopes », Ecology, vol. 23, no 2, , p. 215–227 (DOI 10.2307/1931088, JSTOR 1931088)
- (en) Bruce Waldman et Michael J. Ryan, « Thermal advantages of communal egg mass deposition in wood frogs (Rana sylvatica) », Journal of Herpetology, vol. 17, no 1, , p. 70–72 (DOI 10.2307/1563783, JSTOR 1563783)
- (en) Walter E. Jr Meshaka, « Eleutherodactylus planirostris », AmphibiaWeb (consulté le )
- (en) Laura Dalgetty et Malcolm W. Kennedy, « Building a home from foam: túngara frog foam nest architecture and three-phase construction process », Biology Letters, vol. 6, no 3, , p. 293–296 (PMID 20106853, PMCID 2880057, DOI 10.1098/rsbl.2009.0934)
- (en) « Proteins of frog foam nests », School of Life Sciences, University of Glasgow (consulté le )
- (en) Donald W. Linzey, Vertebrate Biology : Systematics, Taxonomy, Natural History, and Conservation, JHU Press, , p. 137
- Stebbins 1995, p. 6-9
- (en) Martha L. Crump, « Amphibian diversity and life history », Amphibian Ecology and Conservation. A Handbook of Techniques, , p. 3-20 (lire en ligne)
- (en) Peter Janzen, « Nannophrys ceylonensis », AmphibiaWeb, (consulté le )
- (en) W. E. Duellman et G. R. Zug, « Anura: From tadpole to adult », sur Encyclopædia Britannica Online, Encyclopædia Britannica (consulté le )
- Stebbins 1995, p. 179-181
- (en) William E. Duellman et George R. Zug, « Anura », sur Encyclopædia Britannica Online, Encyclopædia Britannica, (consulté le )
- (en) Martha L. Crump, « Cannibalism by younger tadpoles: another hazard of metamorphosis », Copeia, vol. 4, no 4, , p. 1007–1009 (DOI 10.2307/1445301, JSTOR 1445301)
- (en) Barry D. Valentine et David M. Dennis, « A comparison of the gill-arch system and fins of three genera of larval salamanders, Rhyacotriton, Gyrinophilus, and Ambystoma », Copeia, vol. 1964, no 1, , p. 196–201 (DOI 10.2307/1440850, JSTOR 1440850)
- (en) H. Bradley Shaffer, « Ambystoma gracile », AmphibiaWeb, (consulté le )
- (en) Robin R Kiyonaga, « Metamorphosis vs. neoteny (paedomorphosis) in salamanders (Caudata) » (consulté le )
- (en) William E. Duellman et Linda Trueb, Biology of Amphibians, JHU Press, , 191–192 p. (ISBN 978-0-8018-4780-6, lire en ligne)
- Stebbins 1995, p. 196
- (en) H. Bradley Shaffer, C. C. Austin et R. B. Huey, « The consequences of metamorphosis on salamander (Ambystoma) locomotor performance », Physiological Zoology, vol. 64, no 1, , p. 212–231 (JSTOR 30158520)
- (en) David B. Wake, « Caudata », sur Encyclopædia Britannica Online, Encyclopædia Britannica, (consulté le )
- (en) W. R. Breckenridge, S. Nathanael et L. Pereira, « Some aspects of the biology and development of Ichthyophis glutinosus », Journal of Zoology, vol. 211, , p. 437–449
- (en) Marvalee H. Wake, « Fetal maintenance and its evolutionary significance in the Amphibia: Gymnophiona », Journal of Herpetology, vol. 11, no 4, , p. 379–386 (DOI 10.2307/1562719, JSTOR 1562719)
- (en) William E. Duellman, « Gymnophiona », sur Encyclopædia Britannica Online, Encyclopædia Britannica, (consulté le )
- (en) Mark Wilkinson, Alexander Kupfer, Rafael Marques-Porto, Hilary Jeffkins, Marta M. Antoniazzi et Carlos Jared, « One hundred million years of skin feeding? Extended parental care in a Neotropical caecilian (Amphibia: Gymnophiona) », Biology Letters, vol. 4, no 4, , p. 358-361 (PMID 18547909, PMCID 2610157, DOI 10.1098/rsbl.2008.0217)
- (en) Martha L. Crump, « Parental care among the Amphibia », Advances in the Study of Behavior, vol. 25, , p. 109–144 (DOI 10.1016/S0065-3454(08)60331-9)
- (en) J. L. Brown, V. Morales et K. Summers, « A key ecological trait drove the evolution of biparental care and monogamy in an amphibian », American Naturalist, vol. 175, no 4, , p. 436–446 (PMID 20180700, DOI 10.1086/650727)
- Dorit 1991, p. 853-854
- (en) María Claudia Fandiño, Horst Lüddecke et Adolfo Amézquita, « Vocalisation and larval transportation of male Colostethus subpunctatus (Anura: Dendrobatidae) », Amphibia-Reptilia, vol. 18, no 1, , p. 39–48 (DOI 10.1163/156853897X00297)
- (en) Arie van der Meijden, « Alytes obstetricans », AmphibiaWeb, (consulté le )
- (en) E. Semeyn, « Rheobatrachus silus », sur Animal Diversity Web, University of Michigan Museum of Zoology, (consulté le )
- (en) Jean-Marc Hero, John Clarke et Ed Meyer, « Assa darlingtoni », sur IUCN Red List of Threatened Species. Version 2012.2, (consulté le )
- (en) Enrique La Marca, Claudia Azevedo-Ramos, Débora Silvano, Luis A. Coloma, Santiago Ron, Jerry Hardy et Manfred Beier, « Pipa pipa (Suriname Toad) », sur IUCN Red List of Threatened Species. Version 2012.1, (consulté le )
- (en) René van Wijngaarden et Federico Bolaños, « Parental care in Dendrobates granuliferus (Anura: Dendrobatidae), with a description of the tadpole », Journal of Herpetology, vol. 26, no 1, , p. 102–105 (DOI 10.2307/1565037, JSTOR 1565037)
- (en) Jesse Gabbard, « Siren intermedia: Lesser Siren », sur Animal Diversity Web, University of Michigan Museum of Zoology, (consulté le )
- (en) H.R. Da Silva et M.C. De Britto-Pereira, « How much fruit do fruit-eating frogs eat? An investigation on the diet of Xenohyla truncata (Lissamphibia: Anura: Hylidae) », Journal of Zoology, vol. 270, no 4, , p. 692–698 (DOI 10.1111/j.1469-7998.2006.00192.x)
- (en) Linda Trueb et Carl Gans, « Feeding specializations of the Mexican burrowing toad, Rhinophrynus dorsalis (Anura: Rhinophrynidae) », Journal of Zoology, vol. 199, no 2, , p. 189–208 (DOI 10.1111/j.1469-7998.1983.tb02090.x)
- (en) W.J. Jr. Hamilton, « The food and feeding behavior of the green frog, Rana clamitans Latreille, in New York State », Copeia, American Society of Ichthyologists and Herpetologists, vol. 1948, no 3, , p. 203–207 (DOI 10.2307/1438455, JSTOR 1438455)
- Stebbins 1995, p. 56
- Stebbins 1995, p. 57-58
- (en) Charles W. Radcliffe, David Chiszar, Karen Estep et Murphy, « Observations on pedal luring and pedal movements in Leptodactylid frogs », Journal of Herpetology, vol. 20, no 3, , p. 300–306 (DOI 10.2307/1564496, JSTOR 1564496)
- (en) Catherine A. Toft, « Feeding ecology of Panamanian litter anurans: patterns in diet and foraging mode », Journal of Herpetology, vol. 15, no 2, , p. 139–144 (DOI 10.2307/1563372, JSTOR 1563372)
- (en) W.E. Bemis, K. Schwenk et M.H. Wake, « Morphology and function of the feeding apparatus in Dermophis mexicanus (Amphibia: Gymnophiona) », Zoological Journal of the Linnean Society, vol. 77, no 1, , p. 75–96 (DOI 10.1111/j.1096-3642.1983.tb01722.x)
- Stebbins 1995, p. 181-185
- Stebbins 1995, p. 76-77
- (en) Brian K. Sullivan, « Sexual selection and calling behavior in the American toad (Bufo americanus) », Copeia, vol. 1992, no 1, , p. 1–7 (DOI 10.2307/1446530, JSTOR 1446530)
- (en) L. F. Toledo et C. F. B. Haddad, When frogs scream! A review of anuran defensive vocalizations, Instituto de Biociências, São Paulo, (lire en ligne), chap. 4
- (en) Steve A. Johnson, « The Cuban Treefrog (Osteopilus septentrionalis) in Florida », sur EDIS, University of Florida, (consulté le )
- (en) Richard Shine, « Sexual selection and sexual dimorphism in the Amphibia », Copeia, vol. 1979, no 2, , p. 297–306 (DOI 10.2307/1443418, JSTOR 1443418)
- (en) W. F. Gergits et R. G. Jaeger, « Site attachment by the red-backed salamander, Plethodon cinereus », Journal of Herpetology, vol. 24, no 1, , p. 91–93 (DOI 10.2307/1564297, JSTOR 1564297)
- (en) Gary S Casper, « Plethodon cinereus », AmphibiaWeb (consulté le )
- (en) K. D. Wells, « Territoriality and male mating success in the green frog (Rana clamitans) », Ecology, vol. 58, no 4, , p. 750–762 (DOI 10.2307/1936211, JSTOR 1936211)
- (en) G. T. Barthalmus et W. J. Zielinski, « Xenopus skin mucus induces oral dyskinesias that promote escape from snakes », Pharmacology, Biochemistry Behavior, vol. 30, no 4, , p. 957–959 (PMID 3227042, DOI 10.1016/0091-3057(88)90126-8)
- (en) John J Crayon, « Xenopus laevis », AmphibiaWeb (consulté le )
- (en) G. E. E. Moodie, « Observations on the life history of the caecilian Typhlonectes compressicaudus (Dumeril and Bibron) in the Amazon basin », Canadian Journal of Zoology, vol. 56, no 4, , p. 1005–1008 (DOI 10.1139/z78-141)
- (en) Edmund D. Jr. Brodie, « Investigations on the skin toxin of the adult rough-skinned newt, Taricha granulosa », Copeia, vol. 1968, no 2, , p. 307–313 (DOI 10.2307/1441757, JSTOR 1441757)
- (en) Charles T. Hanifin, Mari Yotsu-Yamashita, Takeshi Yasumoto, Edmund D. Brodie et Edmund D. Jr. Brodie, « Toxicity of dangerous prey: variation of tetrodotoxin levels within and among populations of the newt Taricha granulosa », Journal of Chemical Ecology, vol. 25, no 9, , p. 2161–2175 (DOI 10.1023/A:1021049125805)
- (en) Shana L. Geffeney, Esther Fujimoto, Edmund D. Brodie, Edmund D. Jr. Brodie et Peter C. Ruben, « Evolutionary diversification of TTX-resistant sodium channels in a predator–prey interaction », Nature, vol. 434, no 7034, , p. 759–763 (PMID 15815629, DOI 10.1038/nature03444)
- Stebbins 1995, p. 110
- (en) Jiri Patocka, Kräuff Wulff et MaríaVictoria Palomeque, « Dart Poison Frogs and Their Toxins », ASA Newsletter, vol. 5, no 75, (ISSN 1057-9419, lire en ligne)
- (en) Catherine R. Darst et Molly E. Cummings, « Predator learning favours mimicry of a less-toxic model in poison frogs », Nature, vol. 440, no 7081, , p. 208–211 (PMID 16525472, DOI 10.1038/nature04297)
- (en) Edmund D. Jr. Brodie, Robert T. Nowak et William R. Harvey, « Antipredator secretions and behavior of selected salamanders against shrews », Copeia, vol. 1979, no 2, , p. 270–274 (DOI 10.2307/1443413, JSTOR 1443413)
- (en) John T. Jr. Beneski, « Adaptive significance of tail autotomy in the Salamander, Ensatina », Journal of Herpetology, vol. 23, no 3, , p. 322–324 (DOI 10.2307/1564465, JSTOR 156446)
- (en) E. D. Jr. Brodie, « Biting and vocalisation as antipredator mechanisms in terrestrial salamanders », Copeia, vol. 1978, no 1, , p. 127–129 (DOI 10.2307/1443832, JSTOR 1443832)
- Avec les cinq principaux clades représentés : Agnathes (lamproies), Chondrichthyens (requins, raies), Placodermes (fossiles), Acanthodiens (fossiles), Osteichthyens (poissons osseux).
- Les poissons, amphibiens et reptiles sont des groupes paraphylétiques.
- « Systématique : ordonner la diversité du vivant », Rapport sur la Science et la technologie N°11, Académie des sciences, Lavoisier, 2010, p. 65
- (en) « Evolution of amphibians », University of Waikato: Plant and animal evolution (consulté le )
- (en) Robert L. Carroll et Anthony Hallam, Patterns of Evolution, as Illustrated by the Fossil Record, Elsevier, , 405–420 p. (ISBN 978-0-444-41142-6, lire en ligne)
- L'apparition des tétrapodes aquatiques date de « la fin du Dévonien moyen, dans une fourchette étroite comprise entre 375 et 380 Ma », (en) Jennifer CLACK, paléontologue à L'université de Cambridge, Grande-Bretagne, « Le premier pied à terre », Pour la Science, .
- (en) Jennifer A. Clack, « Ichthyostega », sur Tree of Life Web Project, (consulté le )
- (en) R. E. Lombard et J. R. Bolt, « Evolution of the tetrapod ear: an analysis and reinterpretation », Biological Journal of the Linnean Society, vol. 11, no 1, , p. 19–76 (DOI 10.1111/j.1095-8312.1979.tb00027.x)
- (en) J. O. I. Spoczynska, Fossils : A Study in Evolution, Frederick Muller Ltd, , 208 p. (ISBN 978-0-584-10093-8), p. 120–125
- (en) D. San Mauro, « A multilocus timescale for the origin of extant amphibians », Molecular Phylogenetics and Evolution, vol. 56, no 2, , p. 554–561 (PMID 20399871, DOI 10.1016/j.ympev.2010.04.019)
- Wells (2007), p. 10-11
- (fr) M. Laurin, Systématique, paléontologie et biologie évolutive moderne : l’exemple de la sortie des eaux des vertébrés, Paris, Ellipses, , 176 p. (ISBN 978-2-7298-3892-8)
- (en) B. W. Waggoner Speer, « Amphibia: Systematics », University of California Museum of Paleontology, (consulté le )
- (en) Michel Laurin et Robert R. Reisz, « A new perspective on tetrapod phylogeny. », dans S. Sumida et K. Martin, Amniotes Origins: Completing the Transition to Land, Londres, Academic Press, (lire en ligne), p. 9-59
- (en) Diego San Mauro, Miguel Vences, Marina Alcobendas, Rafael Zardoya et Axel Meyer, « Initial diversification of living amphibians predated the breakup of Pangaea », The American Naturalist, vol. 165, no 5, , p. 590–599 (PMID 15795855, DOI 10.1086/429523)
- (en) J. Anderson, R. Reisz, D. Scott, N. Fröbisch et S. Sumida, « A stem batrachian from the Early Permian of Texas and the origin of frogs and salamanders », Nature, vol. 453, no 7194, , p. 515–518 (PMID 18497824, DOI 10.1038/nature06865)
- (en) D. Marjanović et M. Laurin, « The origin(s) of modern amphibians: a commentary », Evolutionary Biology, vol. 36, no 3, , p. 336–338 (DOI 10.1007/s11692-009-9065-8)
- (en) K. Roelants, D.J. Gower, M. Wilkinson, S.P. Loader, S.D. Biju, K. Guillaume, L. Moriau et F. Bossuyt, « Global patterns of diversification in the history of modern amphibians », Proceedings of the National Academy of Sciences of the United States of America, vol. 104, no 3, , p. 887–892
- (en) San Mauro, D., Vences, M., Alcobendas, M., Zardoya, R., & Meyer, A., « Initial diversification of living amphibians predated the breakup of Pangaea », American Naturalist, vol. 165, no 5, , p. 590–599.
- (en) Hugall, A. F., Foster, R., Lee, M. S. Y., « Calibration choice, rate smoothing, and the pattern of tetrapod diversification according to the long nuclear gene RAG-1 », Systematic Biology, vol. 56, no 3, , p. 543–563. (DOI 10.1080/10635150701477825)
- (en) Marjanović, D., Laurin, M., « Fossils, molecules, divergence times, and the origin of lissamphibians », Systematic Biology, vol. 56, no 3, , p. 369–388. (DOI 10.1080/10635150701397635)
- (en) David Cannatella, « Living amphibians », Tree of Life Web Project, (consulté le )
- (en) Z. Roček, « Chapter 14. Mesozoic Amphibians », dans H. Heatwole et R.L. Carroll, Amphibian Biology: Paleontology: The Evolutionary History of Amphibians, vol. 4, Surrey Beatty & Sons, (ISBN 978-0-949324-87-0, lire en ligne), p. 1295–1331
- (en) Farish A. Jenkins Jr., Denis M. Walsh et Robert L. Carroll, « Anatomy of Eocaecilia micropodia, a limbed caecilian of the Early Jurassic », Bulletin of the Museum of Comparative Zoology, vol. 158, no 6, , p. 285–365 (DOI 10.3099/0027-4100(2007)158[285:AOEMAL]2.0.CO;2)
- (en) Ke-Qin Gao et Neil H. Shubin, « Late Jurassic salamandroid from western Liaoning, China », Proceedings of the National Academy of Sciences of the United States of America, vol. 109, no 15, , p. 5767–5772 (DOI 10.1073/pnas.1009828109)
- (Alford, Richards et McDonald (2007)).
- (en) Darell Frost, « Amphibian Species of the World: an Online Reference. Version 5.6 (9 January 2013) », American Museum of Natural History, (consulté le )
- (en) Martha L. Crump, « Amphibian diversity and life history », Amphibian Ecology and Conservation. A Handbook of Techniques, , p. 3-20 (lire en ligne)
- (en) M. L. McCallum, « Amphibian decline or extinction? Current declines dwarf background extinction rate », Journal of Herpetology, vol. 41, no 3, , p. 483–491 (DOI 10.1670/0022-1511(2007)41[483:ADOECD]2.0.CO;2, lire en ligne)
- (en) J. M. Hoekstra, J. L. Molnar, M.; Revenga, C. Jennings, M. D. Spalding, T. M. Boucher, J. C. Robertson, T. J. Heibel et K. Ellison, « Number of Globally Threatened Amphibian Species by Freshwater Ecoregion », sur The Atlas of Global Conservation: Changes, Challenges, and Opportunities to Make a Difference, The Nature Conservancy, (consulté le )
- (de) « Praxismerkblätter Artenschutz », sur KARCH, Suisse, Bulletin sur les pratiques de conservation de la nature (consulté le )
- (en) « Amphibian Specialist Group », IUCN SSC Amphibian Specialist Group (consulté le )
- (en) James Hardin Waddle, Use of amphibians as ecosystem indicator species, University of Florida, (lire en ligne)
- (en) Henry A. Regier et Gordon, L. Baskerville, Sustainable redevelopment of regional ecosystems degraded by exploitive development, DIANE Publishing, , 36–38 p. (ISBN 978-0-7881-4699-2, lire en ligne), « Sustainability Issues for Resource Managers »
- (en) W. Bryan Jennings, David F. Bradford et Dale F. Johnson, « Dependence of the garter snake Thamnophis elegans on amphibians in the Sierra Nevada of California », Journal of Herpetology, vol. 26, no 4, , p. 503–505 (DOI 10.2307/1565132, JSTOR 1565132)
- Stebbins 1995, p. 249
- (en) « Amphibian Conservation Action Plan », sur IUCN (consulté le )
- (en) « Panama Amphibian Rescue and Conservation Project », Amphibian Ark (consulté le )