Hypochlorite de sodium
L’hypochlorite de sodium est un composé chimique de formule brute NaClO. C'est un solide blanc très instable couramment utilisé en solution aqueuse comme agent désinfectant et agent de blanchiment, notamment sous forme d'eau de Javel pour un usage domestique. Sous forme solide anhydre, il tend à se dismuter en oxygène O2, chlorure de sodium NaCl et chlorate de sodium NaClO3 :
| Hypochlorite de sodium | ||
| ||
 | ||
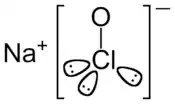
| Structure de l'hypochlorite de sodium | ||
| Identification | ||
|---|---|---|
| Nom UICPA | Hypochlorite de sodium | |
| No CAS | ||
| No ECHA | 100.028.790 | |
| No CE | 231-668-3 | |
| PubChem | 23665760 | |
| SMILES | ||
| InChI | ||
| Apparence | solide blanc | |
| Propriétés chimiques | ||
| Formule | NaClO | |
| Masse molaire[1] | 74,442 ± 0,002 g/mol Cl 47,62 %, Na 30,88 %, O 21,49 %, |
|
| Propriétés physiques | ||
| T° fusion | 18 °C | |
| Solubilité | 293 g·L-1 à 0 °C; 799 g·L-1 à 25 °C dans l'eau | |
| Précautions | ||
| SGH[2] - [3] | ||
  Danger |
||
| SIMDUT[4] | ||
   C, E, F, |
||
| Transport[3] | ||
| Inhalation | Dangereuse, peut être mortelle | |
| Peau | Irritant, provoque des brûlures, peut être mortel |
|
| Yeux | Irritant, provoque des brûlures | |
| Ingestion | Dangereuse, voire mortelle | |
| intraveineuse | Irritant, provoque des infections | |
| Unités du SI et CNTP, sauf indication contraire. | ||
Dans l'eau de Javel, l'hypochlorite de sodium est mélangé avec du chlorure de sodium résultant de sa fabrication par l'action du dichlore Cl2 sur une solution d'hydroxyde de sodium NaOH électrolysée entre deux électrodes rapprochée en dessous de 40 °C, afin d'éviter la formation de chlorate de sodium NaClO3 :
Réactions
L'hypochlorite de sodium réagit progressivement avec les métaux en donnant l'hydroxyde ou l'oxyde de ce métal, par exemple ici avec le zinc :
Il libère du dichlore gazeux Cl2 avec l'acide chlorhydrique HCl :
Avec les autres acides, il libère l'acide hypochloreux HClO, par exemple ici avec l'acide acétique CH3COOH :
Sous l'effet de la chaleur ou de la dessiccation, il se dismute en chlorure de sodium NaCl et chlorate de sodium NaClO3 ou en oxygène O2 :
La réaction — violente — avec le peroxyde d'hydrogène H2O2 libère de l'oxygène singulet 1O2, défini par une configuration électronique particulière, notée 1Δg :
Avec l'ammoniaque NH4OH, la réaction conduit à la formation d'hydroxyde de sodium NaOH et de monochloramine NH2Cl, toxique :
L'hypochlorite de sodium rend l'eau de Javel dangereuse lorsqu'elle est en contact avec d'autres produits d'entretien ou divers produits d'utilisation domestique (par exemple des tensioactifs, des parfums d'intérieur...), car c'est un réactif instable qui forme facilement des composés nocifs, notamment des composés organiques volatils chlorés, avec de nombreuses substances de la vie quotidienne.
En chimie organique, on l'utilise pour oxyder les groupements -OH secondaires en présence de groupements -OH primaires. L'oxydation vers la cétone se fait en solution aqueuse avec de l'acide acétique[5].
Références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- « Hypochlorite de sodium » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 23 avril 2009
- (en) George S Zweifel et Michael H Nantz, Modern organic synthesis : an introduction, New York, W.H. Freeman, , 477 p. (ISBN 978-0-7167-7266-8 et 0-7167-7266-3), p. 96.
