Oxygène singulet
L'oxygène singulet, de symbole 1O2 ou O=O, est un état excité — donc métastable — de la molécule de dioxygène. Il se forme notamment par réaction de l'eau oxygénée et de l'eau de Javel, par action des ions hypochlorite ClO− sur le peroxyde :

réaction qui s'accompagne d'une très faible luminescence rouge foncé[1] par relaxation des molécules d'oxygène singulet.
L'oxygène singulet se caractérise par une configuration électronique particulière, notée 1Δg, dans laquelle deux électrons de spins opposés () se trouvent sur une orbitale antiliante π*, alors que le dioxygène triplet — forme habituelle de l'oxygène — est noté 3Σg− et correspond à deux électrons de même spin () répartis entre deux orbitales π* et π*. Un second état instable existe, noté 1Σg+, qui diffère de l'état singulet 1Δg par le fait que les deux électrons de spins opposés () se répartissent sur deux orbitales π* différentes.
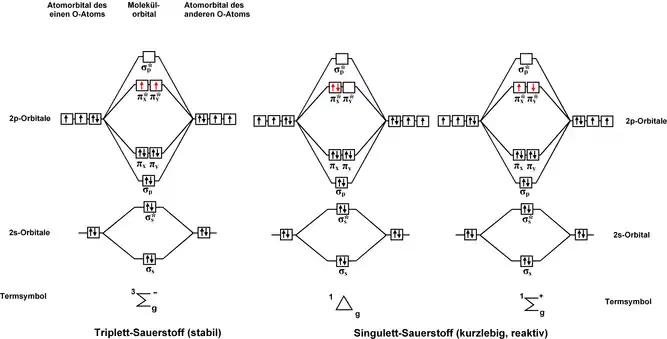
L'énergie d'excitation de l'oxygène singulet par rapport à l'oxygène triplet est de l'ordre de 94,3 kJ·mol-1, correspondant à une relaxation à 1 268 nm, dans le proche infrarouge[2]. Cette transition, dans une molécule isolée, est interdite par les règles de conservation à la fois de spin, de parité et de symétrie, ce qui en fait une transition hautement improbable : l'excitation directe par un photon d'une molécule d'oxygène triplet en oxygène singulet est par conséquent quasiment impossible, et une molécule d'oxygène singulet en phase gazeuse a une durée de vie d'environ 72 minutes ; en solution, en revanche, cette durée de vie n'excède pas quelques microsecondes, voire nanosecondes[3].
La détection de l'oxygène singulet dilué est possible à partir de sa faible phosphorescence à 1,27 μm, mais, à plus forte concentration, une fluorescence rouge à 634 nm correspondant à la collision de deux molécules d'oxygène singulet permet de l'observer directement à l'œil nu[4].
Notes et références
- Université de Liège - Centre de l'Oxygène, Recherche et Développement « L'oxygène singulet et la vie : partie A - Généralités », par C. Deby.
- (en) Ahsan U. Khan, « Myeloperoxidase singlet molecular oxygen generation detected by direct infrared electronic emission », Biochemical and Biophysical Research Communications, vol. 122, no 2, , p. 668-675 (lire en ligne) DOI 10.1016/S0006-291X(84)80085-6
- (en) Francis Wilkinson, W. Phillip Helman et Alberta B. Ross, « Rate Constants for the Decay and Reactions of the Lowest Electronically Excited Singlet State of Molecular Oxygen in Solution. An Expanded and Revised Compilation », Journal of Physical and Chemical Reference Data, vol. 24, no 2, , p. 663-679 (lire en ligne) DOI 10.1063/1.555965
- (en) R. S. Mulliken, « Interpretation of the Atmospheric Oxygen Bands; Electronic Levels of the Oxygen Molecule », Nature, vol. 122, , p. 505-505 (lire en ligne) DOI 10.1038/122505a0

