Chlorate de sodium
Le chlorate de sodium (NaClO3), aussi appelé par abus de langage chlorate de soude, est utilisé comme désherbant ainsi que dans le domaine de la pyrotechnie. Les chlorates sont des oxydants plus puissants, mais également plus sensibles, que les nitrates. Les perchlorates sont encore plus oxydants que les chlorates ; le plus connu d'entre eux, le perchlorate d'ammonium (NH4ClO4), est utilisé comme comburant de certaines fusées (militaires notamment). Le perchlorate de potassium (KClO4) est lui autorisé en pyrotechnie (dans certains pays) car bien que plus puissant que les chlorates, il est moins sensible (à la friction et aux chocs notamment). Les chlorates de sodium et de potassium sont utilisés dans la fabrication de poudres flash, à combustion très rapide. Les chlorates ont cependant un défaut majeur pour leur utilisation en pyrotechnie : ils libèrent du dichlore et du dioxyde de chlore, qui sont des gaz irritants pour les voies respiratoires. Les retombées de nuages de fumées sur les spectateurs, ou sur des forêts, sont à éviter, et en Europe, la plupart des pays ont interdit l'utilisation des chlorates en pyrotechnie du fait de leur réactivité et de leur plus grande puissance. Seuls quelques pays, tels l'Espagne, autorisent cette utilisation dans certaines pièces d'artifices.
| Chlorate de sodium | ||

| ||
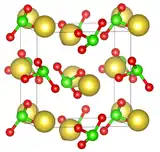 | ||
| __ Na+ __ Cl5+ __ O2− | ||
| Identification | ||
|---|---|---|
| Nom UICPA | Chlorate de sodium | |
| Synonymes |
chlorate de soude |
|
| No CAS | ||
| No ECHA | 100.028.989 | |
| No CE | 231-887-4 | |
| SMILES | ||
| InChI | ||
| Apparence | cristaux incolores ou granules blancs sans odeur[1]. | |
| Propriétés chimiques | ||
| Formule | NaClO3 | |
| Masse molaire[2] | 106,441 ± 0,003 g/mol Cl 33,31 %, Na 21,6 %, O 45,09 %, |
|
| Propriétés physiques | ||
| T° fusion | 248 °C[1] | |
| T° ébullition | ~300 °C décomposition | |
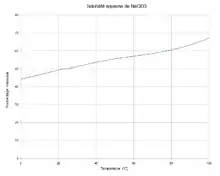
| Solubilité | dans l'eau à 20 °C : 1 000 g·L-1[1] | |
| Masse volumique | 2,5 g·cm-3[1] | |
| Précautions | ||
| SGH[3] | ||
   Danger |
||
| SIMDUT[4] | ||
 C, |
||
| Transport | ||
| Unités du SI et CNTP, sauf indication contraire. | ||
Dans l'industrie des pâtes et papiers, il est utilisé comme produit de base pour remplacer le chlore dans les divers stades de blanchiment car il se décompose en dioxyde de chlore (ClO2) et en hydroxyde de sodium (NaOH), aussi appelé soude caustique.
Procédé de fabrication
Le chlorate de sodium est produit par électrolyse d'une solution de saumure. Dans certains procédés, de l'acide chlorhydrique (HCl) est ajouté à la solution de saumure pour réguler le pH ainsi que du dichromate de sodium (Na2Cr2O7) indispensable à la réaction pour obtenir un meilleur rendement et, qui permet aussi de réduire la corrosion des cuves d'électrolyse et des électrodes. Lors de cette étape, de l'hydrogène et de l'eau de Javel (NaOCl) sont produits. Ensuite, la solution d'électrolyte est acheminée vers un cristallisoir afin de former les cristaux qui seront ensuite séchés par un séchoir à lit fluidisé. La partie liquide restante dans le cristallisoir, qui est formé d'ions et de produits n'ayant pas réagi des réactions partielles de l'électrolyse, est réacheminée vers la cuve d'électrolyse pour éviter les pertes de matière.
Équation des réactions
Réaction globale
La réaction globale est en fait une série de petites réactions, soit :
Le chlorate de sodium en France
Du fait qu'ils étaient manifestement susceptibles d’avoir des effets nocifs sur la santé humaine, les produits phytopharmaceutiques contenant du chlorate ont été retirés de la vente le [5].
Le chlorate de sodium était auparavant disponible à une concentration supérieure à 95 % de NaClO3. À cause de la fréquence des accidents dus à son utilisation en tant qu'oxydant dans des réactions explosives, ce taux fut ensuite abaissé à 60 %. Mélangé à d'autres substances, le chlorate de sodium est moins réactif ce qui évite des accidents. On trouvait aussi du chlorate de sodium à 23,7 %.
Utilisé en solution à 10 grammes par litre d'eau (2 cuillerées à soupe, à dos bien arrondi, pour un arrosoir de 10 litres) le chlorate de sodium constitue un désherbant efficace. Il agit grâce à l'oxygène qu'il contient, lequel détruit des structures cellulaires au niveau des racines. Cette action ayant eu lieu il ne reste dans le milieu que du chlore et du sodium, c'est-à-dire du sel de cuisine qui à la dose ci-dessus — correspondant à environ 6 grammes de chlorure de sodium pour un litre d'eau — est pratiquement sans dommages pour l'environnement.
Références
- CHLORATE DE SODIUM, Fiches internationales de sécurité chimique
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- « Chlorate de sodium » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- Décision de la Commission européenne no 2008/865/CE du .




