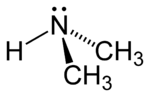
Diméthylamine
La diméthylamine, N-méthylméthanamine ou DMA est un composé organique de la famille des amines secondaires. Elle est utilisée dans le tannage des cuirs. On l'utilise aussi en fonderie industrielle sous forme gazeuse, elle sert à la réaction des résines utilisées pour la fabrication des noyaux de sable.
| Diméthylamine | |
| |
| Identification | |
|---|---|
| Nom UICPA | diméthylamine |
| Synonymes |
DMA |
| No CAS | |
| No ECHA | 100.004.272 |
| No CE | 204-697-4 |
| Apparence | gaz comprimé, liquéfié et incolore, d'odeur âcre ; ou solution dans l'eau, d'odeur âcre[1]. |
| Propriétés chimiques | |
| Formule | C2H7N [Isomères] |
| Masse molaire[2] | 45,083 7 ± 0,002 3 g/mol C 53,28 %, H 15,65 %, N 31,07 %, |
| Moment dipolaire | 1,01 ± 0,02 D [3] |
| Propriétés physiques | |
| T° fusion | −92,2 °C[1] −37 °C (solution)[1] |
| T° ébullition | 7,0 °C[1] 51 °C (solution)[1] |
| Solubilité | dans l'eau : 3 540 g·l-1[1] |
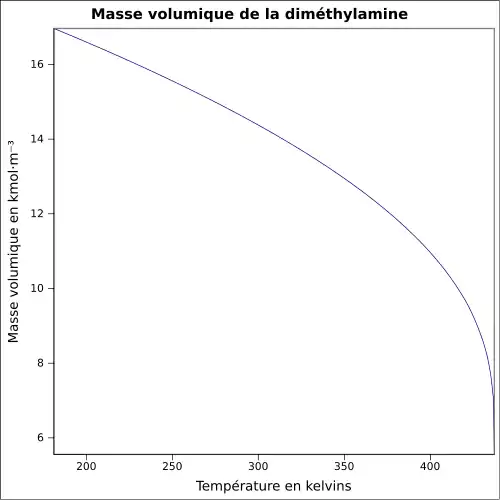
| Masse volumique | 0,9 g·cm-3 (solution), 1,5 (Air = 1) gaz[1] 0,680 4 g·cm-3 (0 °C)[4] |
| T° d'auto-inflammation | 400 °C[1] |
| Point d’éclair | −18 °C[1] |
| Limites d’explosivité dans l’air | 2,8–14,4 %vol[1] |
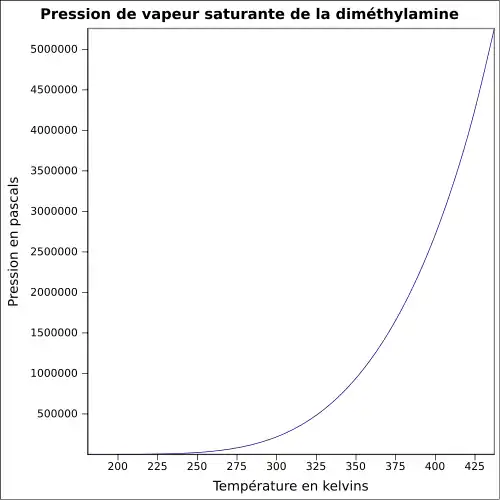
| Pression de vapeur saturante | à 25 °C : 203 kPa[1]
|
| Point critique | 53,1 bar, 164,55 °C [6] |
| Thermochimie | |
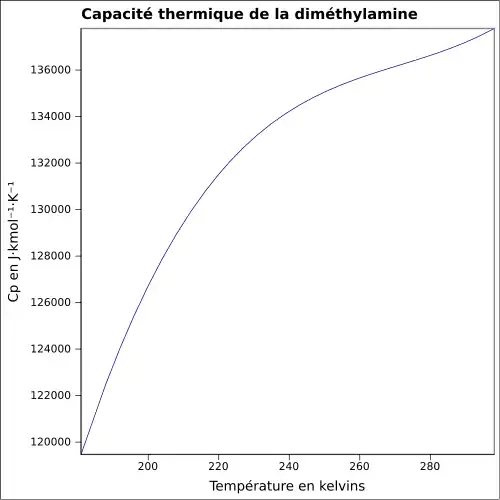
| Cp | |
| Propriétés électroniques | |
| 1re énergie d'ionisation | 8,24 ± 0,08 eV (gaz)[8] |
| Propriétés optiques | |
| Indice de réfraction | 1,350 [4] |
| Précautions | |
| SGH[9] - [10] | |
    Danger    Danger |
|
| SIMDUT[11] | |
   A, B1, E, |
|
| NFPA 704 | |
| Transport[12] | |
| Écotoxicologie | |
| DL50 | 890g |
| LogP | -0,2[1] |
| Seuil de l’odorat | bas : 0,000 76 ppm haut : 1,6 ppm[13] |
| Unités du SI et CNTP, sauf indication contraire. | |
Propriétés
La diméthylamine est une amine secondaire, un dérivé de l'ammoniac substitué par deux groupes méthyle. Elle se présente sous la forme d'un gaz inflammable, incolore, à l'odeur d'ammoniac et de poisson. La diméthylamine est en général utilisée en solution aqueuse à des concentrations allant jusqu'autour de 40 %.
La diméthylamine est une base, et le pKa du cation diméthylammonium CH3-NH2+-CH3 est 10,73, une valeur intermédiaire entre la méthylamine (10,64) et la triméthylamine (9,79).
Biochimie
La blatte germanique se sert de la diméthylamine comme d’une phéromone, pour communiquer.
Utilisations
La diméthylamine est généralement commercialisée sous forme de solution aqueuse ou de chlorhydrate, puisque sa température d'ébullition est de 7 °C. Il est cependant très facile de préparer au laboratoire de la diméthylamine pure à partir de son chlorhydrate, par réaction avec l'hydroxyde de potassium ou de sodium et un minimum d'eau. Dans ces conditions, les vapeurs de diméthylamine peuvent être aisément condensées puis séchées avant d'être utilisées dans des conditions anhydres, si nécessaire.
Références
- DIMETHYLAMINE et DIMETHYLAMINE (solution aqueuse), Fiches internationales de sécurité chimique
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) David R. Lide, Handbook of chemistry and physics, Boca Raton, CRC, , 89e éd., 2736 p. (ISBN 978-1-4200-6679-1), p. 9-50
- (en) J. G. Speight, Norbert Adolph Lange, Lange's handbook of chemistry, New York, McGraw-Hill, , 16e éd., 1623 p. (ISBN 978-0-07-143220-7, LCCN 84643191), p. 2.289
- (en) Robert H. Perry et Donald W. Green, Perry's Chemical Engineers' Handbook, USA, McGraw-Hill, , 7e éd., 2400 p. (ISBN 978-0-07-049841-9, LCCN 96051648), p. 2-50
- « Properties of Various Gases », sur flexwareinc.com (consulté le )
- (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams, vol. 1, Huston, Texas, Gulf Pub. Co., (ISBN 978-0-88415-857-8, LCCN 96036328)
- (en) David R. Lide, Handbook of chemistry and physics, Boca Raton, CRC, , 89e éd., 2736 p. (ISBN 978-1-4200-6679-1), p. 10-205
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- « Diméthylamine » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 24 avril 2009
- « Dimethylamine », sur hazmap.nlm.nih.gov (consulté le )