Polyiodure
Les polyiodures forment une classe d'anions halogénure polyatomiques entièrement constitués d'atomes d'iode de formule générique Inm−.
L'ion triiodure I3− est le polyiodure le plus simple. On en connaît de plus complexes, avec une ou plusieurs charges négatives.
Les molécules de polyiodures peuvent être vues comme formées d'unités iodure I−, iode I2 et triiodure I3− en présence de grands cations (par exemple, un cation ammonium quaternaire NR4+, où R représente un alkyle quelconque) pour les stabiliser. Avec des cations plus petits (ammonium, césium, thallium), les anions polyiodure sont asymétriques, et, quand le cation est trop petit (sodium, potassium), l'anion se dissocie sans pouvoir précipiter.
L'ion I5− adopte une conformation en V et peut être vu comme deux unités I2 liées à un ion iodure I−. La longueur des liaisons a pu être évaluée à 280 pm pour les liaisons extérieures et 317 pm pour les liaisons intérieures[1], ce qui est cohérent avec la représentation de deux unités I2 liées à un ion I−.
L'ion I42− est linéaire, et peut être vu comme quatre atomes d'iode liés linéairement de façon homogène, ou comme deux ions iodure liés à une molécule I2[2].
Ci-dessous, quelques données géométriques sur certains polyiodures en fonction de leur sel :
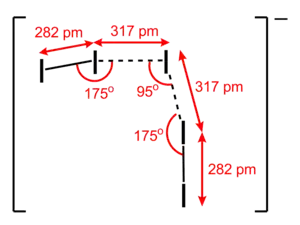 Géométrie de l'anion I5− dans (Me4N+)I5− |
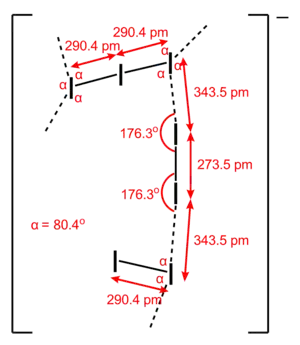 Géométrie de l'anion I7− dans (Et4N+)I7− |
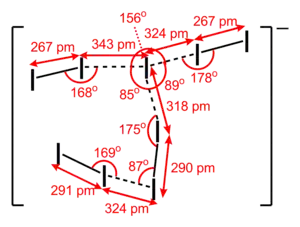 Géométrie de l'anion I9− dans (Me4N+)I9− |
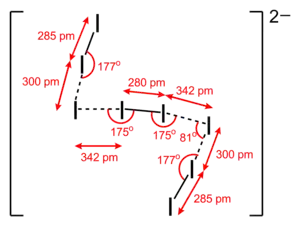 Géométrie du dianion I82− dans (Cs22+)I82− |
Notes et références
- P.W. Atkins, D.W. Shriver, Inorganic Chemistry, 3e édition, OUP, Oxford, UK (2001)
- Per H. Svensson, Lars Kloo, « Synthesis, Structure, and Bonding in Polyiodide and Metal Iodide-Iodine Systems » Chem. Rev. 2003 103(5), pp 1649-1684.