Acide periodique
L'acide periodique est la molécule HIO4 (acide métaperiodique) ou H5IO6 (acide orthoperiodique). Le nom de la molécule ne provient pas du mot « période », mais de « iode » : acide per-iodique (à comparer avec acide iodique ou acide perchlorique).
| Acide periodique | |
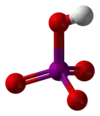 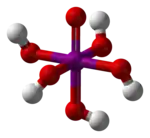 Structure des acides méta- et orthoperiodique. |
|
| Identification | |
|---|---|
| Nom UICPA | acide periodique periodate d'hydrogène |
| No CAS | |
| No ECHA | 100.030.839 |
| No CE | 233-937-0 |
| PubChem | 25289 |
| Propriétés chimiques | |
| Formule | H5IO6 [Isomères] |
| Masse molaire[1] | 227,940 6 ± 0,002 2 g/mol H 2,21 %, I 55,67 %, O 42,11 %, |
| Propriétés physiques | |
| T° fusion | 122 °C |
| Précautions | |
| SIMDUT[2] | |
 C, |
|
| Directive 67/548/EEC | |
 C  O |
|
| Unités du SI et CNTP, sauf indication contraire. | |
En solution diluée, l'acide periodique existe sous la forme d'ions H+ et IO4−. En concentration plus élevée, l'acide orthoperiodique, H5IO6, est formé. Celui-ci peut être obtenu sous forme cristalline.
Par chauffage sous pression réduite à 100 °C, l'acide orthoperiodique peut être déshydraté en acide métaperiodique, HIO4 :
- H5IO6 HIO4 + 2 H2O.
L'anhydride (heptoxyde de diiode, I2O7) ne peut être obtenu. En poursuivant le chauffage jusqu'à 150 °C environ, on obtient le pentoxyde de diiode (I2O5) :
- 2HIO4 → H2O + I2O5 + O2.
Références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- « Acide periodique » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
Cet article est issu de wikipedia. Text licence: CC BY-SA 4.0, Des conditions supplémentaires peuvent s’appliquer aux fichiers multimédias.
