Néon
Le néon est l'élément chimique de numéro atomique 10, de symbole Ne. Son nom est tiré du grec νέος / néos, « nouveau ».
| Néon | |||||||||||
 Lampe à décharge contenant du néon. | |||||||||||
| |||||||||||
| Position dans le tableau périodique | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Symbole | Ne | ||||||||||
| Nom | Néon | ||||||||||
| Numéro atomique | 10 | ||||||||||
| Groupe | 18 | ||||||||||
| Période | 2e période | ||||||||||
| Bloc | Bloc p | ||||||||||
| Famille d'éléments | Gaz noble | ||||||||||
| Configuration électronique | [He] 2s2 2p6 | ||||||||||
| Électrons par niveau d’énergie | 2, 8 | ||||||||||
| Propriétés atomiques de l'élément | |||||||||||
| Masse atomique | 20,179 7 ± 0,000 6 u[1] | ||||||||||
| Rayon atomique (calc) | (38 pm) | ||||||||||
| Rayon de covalence | 58 pm[2] | ||||||||||
| Rayon de van der Waals | 154 pm | ||||||||||
| État d’oxydation | 0 | ||||||||||
| Oxyde | inconnu | ||||||||||
| Énergies d’ionisation[3] | |||||||||||
| 1re : 21,564 54 eV | 2e : 40,962 96 eV | ||||||||||
| 3e : 63,45 eV | 4e : 97,12 eV | ||||||||||
| 5e : 126,21 eV | 6e : 157,93 eV | ||||||||||
| 7e : 207,275 9 eV | 8e : 239,098 9 eV | ||||||||||
| 9e : 1 195,828 6 eV | 10e : 1 362,199 5 eV | ||||||||||
| Isotopes les plus stables | |||||||||||
| Propriétés physiques du corps simple | |||||||||||
| État ordinaire | Gaz (non magnétique) | ||||||||||
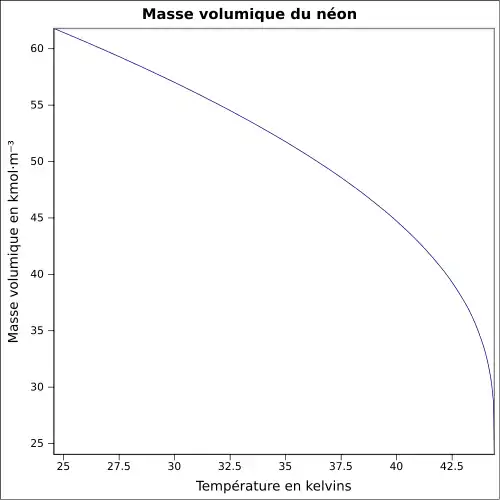
| Masse volumique | 0,900 32 g·L-1 (1 atm, 0 °C)[1]
|
||||||||||
| Système cristallin | Cubique à faces centrées | ||||||||||
| Couleur | incolore | ||||||||||
| Point d’ébullition | −246,053 °C[1] | ||||||||||
| Énergie de fusion | 0,331 7 kJ·mol-1 | ||||||||||
| Énergie de vaporisation | 1,71 kJ·mol-1 (1 atm, −246,05 °C) | ||||||||||
| Température critique | −228,7 °C[1] | ||||||||||
| Point triple | −248,593 9 °C[5] | ||||||||||
| Volume molaire | 22,414×10-3 m3·mol-1 | ||||||||||
| Pression de vapeur | |||||||||||
| Vitesse du son | 936 m·s-1 à 20 °C | ||||||||||
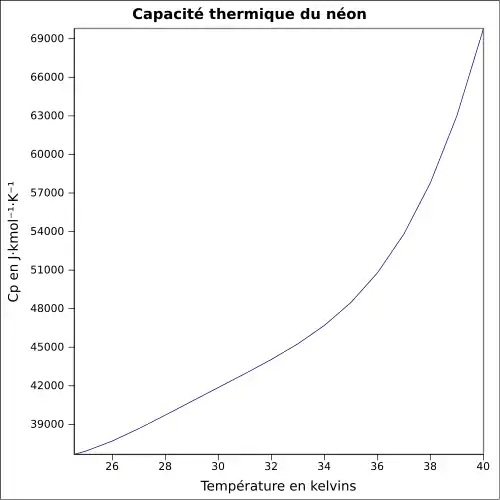
| Chaleur massique | 1 028 J·kg-1·K-1
|
||||||||||
| Conductivité thermique | 0,046 1 W·m-1·K-1 | ||||||||||
| Divers | |||||||||||
| No CAS | |||||||||||
| No ECHA | 100.028.282 | ||||||||||
| No CE | 231-110-9 | ||||||||||
| Précautions | |||||||||||
| SGH[6] | |||||||||||
 Attention |
|||||||||||
| SIMDUT[7] | |||||||||||
 A, |
|||||||||||
| Transport[6] | |||||||||||
|
|||||||||||
| Unités du SI & CNTP, sauf indication contraire. | |||||||||||
Dans le tableau périodique des éléments, il se trouve dans le 8e groupe principal, ou le 18e groupe de l'UICPA, et appartient donc aux gaz nobles. Comme les autres gaz rares, c'est un gaz incolore, extrêmement inerte et monoatomique. Pour de nombreuses propriétés telles que le point de fusion et d'ébullition ou la masse volumique, il se situe entre l'hélium, plus léger, et l'argon, plus lourd.
Le néon est l'un des éléments les plus abondants de l'univers, mais il est relativement rare sur Terre, car, comme l'hélium, une grande partie du gaz s'est échappée dans l'espace. On le trouve principalement dans l'atmosphère terrestre dont il est un des gaz à l'état de traces ; seules de petites quantités sont piégées dans les roches.
Comme le krypton et le xénon, le néon est découvert en 1898 par William Ramsay et Morris William Travers par distillation fractionnée de l'air liquide. Les applications les plus connues sont les tubes fluorescents ou les lampes néon, dans lesquels le néon est excité par des décharges électriques pour briller d'une couleur typiquement rouge-orange.
Histoire
En 1894, John William Strutt Rayleigh et William Ramsay découvrent l'argon, le premier gaz noble. En 1895, Ramsay isole également de l'hélium, auparavant connu uniquement dans le spectre solaire, à partir de minerais d'uranium. D'après les lois du tableau périodique, il reconnaît alors qu'il doit y avoir un autre élément entre l'hélium et l'argon avec une masse atomique d'environ 20 u[8].
À partir de 1896, il commence donc à étudier divers minéraux et météorites ainsi que les gaz qu'ils émettent lorsqu'ils sont chauffés ou dissous. Cependant, Ramsay et son collègue Morris William Travers ne réussissent pas avoir de résultats concluants, et ne parviennent à trouver que de l'hélium et, plus rarement, de l'argon. Ils enquêtent alors sur les gaz chauds de Cauterets en France et d'Islande, sans résultat[8].
Enfin, ils commencent à examiner 15 litres d'argon brut isolé de l'air liquide et séparé par liquéfaction et distillation fractionnée. Le premier élément à être séparé et détecté par le spectre de la flamme est le krypton. Le , ils réussissent finalement à isoler un élément plus léger de la fraction à plus bas point d'ébullition de l'argon brut. Ramsay et Travers décident de nommer cet élément Néon, d'après le grec νέος / néos, « nouveau ». Peu de temps après, ils réussissent à extraire un autre élément, le xénon, grâce au même procédé[8].
La première application du gaz nouvellement découvert est la lampe néon développée en 1910 par le français Georges Claude : le néon remplissant un tube de verre est excité par des tensions élevées et émet de la lumière[9].
Isotopes
Au total, 19 isotopes du néon sont connus, entre 15Ne et 34Ne. Parmi ceux-ci, seuls 20Ne, 21Ne et 22Ne sont stables et se trouvent également dans la nature. Le 20Ne est de loin le plus courant et représente 90,48 % des isotopes. 21Ne est le plus rare sur Terre avec une part de 0,27 % et 22Ne se produit avec une fréquence de 9,25 % dans la distribution isotopique naturelle sur Terre. Tous les autres isotopes ont une courte demi-vie, de 3,38 minutes maximum pour 24Ne[10].
Caractéristiques
Caractéristiques physiques
Dans les conditions normales de température et de pression, le néon est un gaz monoatomique, incolore et inodore. À pression normale, il se condense à 27 K (−246 °C) et se solidifie à 24,57 K (−248,59 °C) (à cette pression il est, de tous les éléments, celui dont la plage de température de l'état liquide est la plus petite). Comme les autres gaz nobles, à l'exception de l'hélium, le néon cristallise dans un système cristallin cubique avec un paramètre de maille a = 443 pm.
Avec une densité de 0,9 kg/m3 à 0 °C et 1 013 hPa, le néon est légèrement plus léger que l'air, donc il s'élève. Dans le diagramme de phase, le point triple est à 24,56 K et 43,37 kPa, le point critique est à 44,4 K, 265,4 kPa et une densité critique de 0,483 g/cm3[11].
Le néon est peu soluble dans l'eau ; un maximum de 10,5 ml de néon peut se dissoudre dans un litre d'eau à 20 °C[11].
Comme d'autres gaz nobles, le néon présente une raie spectrale caractéristique lors des décharges de gaz. Comme les raies dans le domaine spectral visible sont principalement dans la gamme rouge à jaune, le gaz apparaît dans une couleur rouge orangée lors d'une décharge.
Caractéristiques chimiques
En tant que gaz noble typique, le néon est extrêmement inerte ; comme pour l'hélium, aucun composé de l'élément n'est connu. Même les clathrates, où d'autres gaz nobles sont physiquement enfermés dans d'autres composés, sont inconnus. Selon les calculs théoriques, le néon est l'élément le moins réactif. Ainsi, l'enthalpie de dissociation calculée pour les composés de type NgBeO (Ng : gaz noble) est la plus faible pour le composé néon. Il s'est avéré que même l'analogue néon du seul composé connu de l'hélium HHeF, qui est stable selon les calculs, ne devrait pas être stable. Les explications possibles de ces résultats sont les distances fluor-hydrogène plus grandes et donc des forces d'attraction plus faibles dans l'ion HNe+ par rapport aux espèces d'hélium ou des interactions p-π répulsives dans les cations du néon[12].
Seuls quelques ions dans lesquels le néon est impliqué sont connus grâce à des études de spectrométrie de masse. Parmi ceux-ci, on trouve l'ion Ne+ et certains éléments-ions comme ArNe+, HeNe+ et HNe+[13].
Applications

La couleur orange rougeâtre que le néon émet dans les tubes néon est largement utilisée pour les signaux publicitaires. « Néon » est devenu le nom donné à ce type de lumière bien qu'en réalité de nombreux autres gaz soient utilisés. Il s'agit d'un abus de langage, en particulier pour l'éclairage domestique ; il s'agit en réalité de tubes fluorescents ou tubes luminescents (de leur nom officiel). C'est par une généralisation abusive qu'on dénomme néons tous les tubes fluorescents et notamment ceux des enseignes lumineuses. Seul le rouge est en effet possible avec le néon et les autres couleurs sont, soit obtenues avec d'autres composés (hélium : jaune ; CO2 : blanc ; argon : violet ; argon/mercure : bleu), soit produites par un revêtement fluorescent excité par un rayonnement ultraviolet.

Autres utilisations :
- lampe témoin ;
- tube Nixie ;
- parafoudres ;
- dans les écrans de télévision dits « plasma » en mélange avec le xénon ;
- le néon est utilisé dans certains lasers.
Le néon liquéfié est utilisé commercialement comme réfrigérant cryogénique.
Production
Le néon est produit à partir de l'air de l'atmosphère dans des usines utilisant le procédé cryogénique de distillation fractionnée de l'air liquide.
L'air liquide est très progressivement réchauffé. Chaque composé (oxygène, azote, néon, hélium…) change alors d'état pour redevenir gazeux, chacun à une température spécifique. La portion de l'air qui redevient gazeux à la température de −245,92 °C est le néon.
Notes et références
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, CRC Press Inc, , 90e éd., 2804 p., Relié (ISBN 978-1-420-09084-0).
- (en) Beatriz Cordero, Verónica Gómez, Ana E. Platero-Prats, Marc Revés, Jorge Echeverría, Eduard Cremades, Flavia Barragán et Santiago Alvarez, « Covalent radii revisited », Dalton Transactions, , p. 2832 - 2838 (DOI 10.1039/b801115j).
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, TF-CRC, , 87e éd. (ISBN 0849304873), p. 10-202.
- (en) Robert H. Perry et Donald W. Green, Perry’s Chemical Engineers’ Handbook, USA, McGraw-Hill, , 7e éd., 2400 p. (ISBN 0-07-049841-5), p. 2-50.
- Procès-verbaux du Comité international des poids et mesures, 78e session, 1989, p. T1-T21[PDF] (et p. T23-T42, version anglaise).
- Fiche Sigma-Aldrich du composé Neon puriss., ≥99.99%, consultée le 17 août 2018.
- « Néon » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009.
- (en) William Ramsay, « The Rare Gases of the Atmosphere », sur Prix Nobel, (consulté le ).
- (en) Georges Claude, System of illuminating by luminescent tubes : Patent application, (lire en ligne).
- (en) G. Audi, F.G. Kondev, Meng Wang, W.J. Huang et S. Naim, « The NUBASE2016 evaluation of nuclear properties », Chinese Physics C, vol. 41, no 3, , p. 138 (lire en ligne, consulté le ).
- (de) « Neon », sur Römpp Lexikon Chemie (consulté le ).
- (en) Errol G. Lewars, Modeling Marvels : Computational Anticipation of Novel Molecules, Dordrecht, Springer, , 282 p. (ISBN 978-1-4020-6972-7), p. 69-80.
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, Boca Raton, CRC Press/Taylor and Francis, , p. 4-23.
Voir aussi
Articles connexes
Liens externes
- (en) « Technical data for Neon » (consulté le ), avec en sous-pages les données connues pour chaque isotope
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||||||||||||||||
| 1 | H | He | |||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | |||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |
| 8 | 119 | 120 | * | ||||||||||||||||||||||||||||||
| * | 121 | 122 | 123 | 124 | 125 | 126 | 127 | 128 | 129 | 130 | 131 | 132 | 133 | 134 | 135 | 136 | 137 | 138 | 139 | 140 | 141 | 142 | |||||||||||