Abondance des éléments chimiques
L'abondance des éléments chimiques est la mesure de la proportion de ces éléments dans un environnement donné par rapport aux autres éléments. On peut mesurer leur abondance de plusieurs manières : par fraction de masse (ou de poids), par fraction molaire (comparaison du nombre de molécules) ou atomique (comparaison du nombre d'atomes) ou par fraction de volume. La mesure par fraction de volume est souvent utilisée lorsqu'il s'agit d'évaluer un mélange de gaz, comme une atmosphère planétaire. Ce type de mesure est proche de la fraction molaire en molécule pour des gaz parfaits (c'est-à-dire pour des gaz sous pression et température faibles).
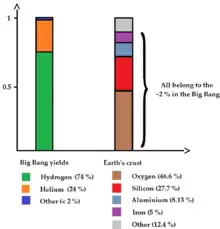
Par exemple, l'abondance massique de l'oxygène dans l'eau est d'environ 89 %, car c'est la fraction de la masse d'eau qui est composée d'oxygène. Mais l'abondance molaire de l'oxygène n'est plus que de 33 %, car un atome sur trois seulement d'une molécule d'eau est de l'oxygène. Dans l'Univers tout entier, et dans l'atmosphère des planètes géantes, comme Jupiter, les abondances massiques de l'hydrogène et de l'hélium sont respectivement de 74 % et de 23-25 %, alors que l'abondance molaire atomique de ces deux éléments est de 92 % et 8 %. Mais, comme l’hydrogène est sous forme diatomique (dihydrogène) alors que l'hélium ne l'est pas, leurs abondances molaires moléculaires sont (dans les conditions de l'atmosphère externe de Jupiter) de 86 % et 13 %.
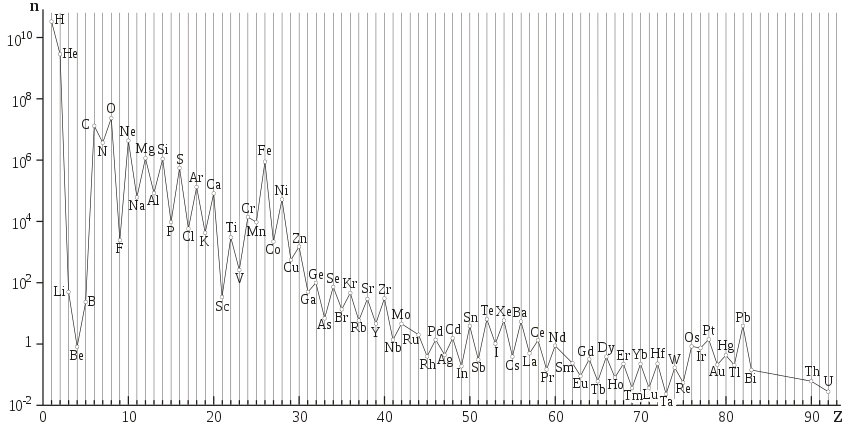
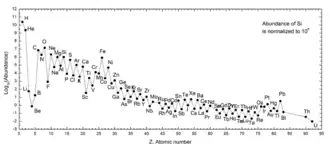
Toute la diversité chimique du monde provient de trois sources : la nucléosynthèse primordiale il y a 13,8 Ga qui explique l'abondance des éléments légers (deutérium, hélium, et 10 % de lithium). La nucléosynthèse stellaire 100 Ma plus tard qui implique plusieurs types de générations d’étoiles, différentes par leur température et leur densité, et est responsable de la synthèse de l'ensemble des éléments lourds (du carbone à l'uranium, dont l'abondance décroissante est liée à la barrière coulombienne et l'énergie de liaison nucléaire)[2]. L'abondance naturelle des éléments chimiques de numéros atomiques supérieurs à 4 est plus élevée lorsque ces numéros atomiques sont pairs que lorsqu'ils sont impairs, phénomène connu sous le nom d'effet d'Oddo-Harkins et qui rend compte de la forme en dents de scie de la courbe d'abondance. Enfin la dernière source, les réactions de spallation qui interviennent dans l'interaction des rayonnements cosmiques avec la matière et permettent la synthèse d'éléments légers (lithium, béryllium, bore) plus abondants dans ce rayonnement[3].
La plupart des abondances indiquées dans l'article sont exprimées en fraction de masse.
Dans l'Univers
« Si vous voulez faire une tarte aux pommes à partir de rien, il vous faudra d'abord créer l'Univers »
— Carl Sagan, Cosmos[4].
| Numéro atomique | Élément | Fraction massique (pourcentage) | Fraction massique (parties par million) | |
|---|---|---|---|---|
| 1 | Hydrogène | 73,9 % | 739 000 | |
| 2 | Hélium | 24 % | 240 000 | |
| 8 | Oxygène | 1 % | 10 400 | |
| 6 | Carbone | 0,5 % | 4 600 | |
| 10 | Néon | 0,1 % | 1 340 | |
| 26 | Fer | 0,1 % | 1 090 | |
| 7 | Azote | 0,1 % | 960 | |
| 14 | Silicium | 0,07 % | 650 | |
| 12 | Magnésium | 0,06 % | 580 | |
| 16 | Soufre | 0,04 % | 440 | |
Les éléments, c'est-à-dire la matière baryonique normale, constituée de protons, de neutrons et d'électrons, forment seulement une petite fraction du contenu de l'Univers. Les observations cosmologiques permettent de déduire que cette matière baryonique ne formerait que 4,6 % du contenu de l'Univers, le reste se partageant en énergie et en matière noire[6].
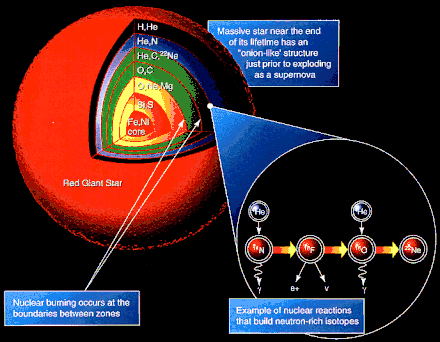
La matière baryonique standard se trouve dans les étoiles et les nuages interstellaires, sous forme d'atomes ou d'ions, ainsi que d'autres formes de matière plus exotiques dans certains lieux astrophysiques, comme les très hautes densités dans les naines blanches et les étoiles à neutrons.
L'abondance des éléments dans l'univers est établie par l'analyse directe (spectrométrie de masse appliquée aux matériaux terrestres, aux météorites et aux échantillons de roche de la lune) et par l'analyse indirecte (étude spectrophotométrique du rayonnement émis par les étoiles, notamment par le Soleil)[8]. « De la composition du Soleil on est passé à la notion d’abondance cosmique en comparant les spectres de la lumière reçue des étoiles et des galaxies. Quoique l’information obtenue soit d’autant moins précise que la distance à l’objet analysé est plus grande, on constate que la composition chimique des étoiles est identique à celle du Soleil. On peut donc considérer que, dans l’état actuel des connaissances, la composition du Soleil représente la composition de l’Univers. D’où le vocable d’abondance cosmique[9]. »
L'hydrogène est l'élément le plus abondant dans l'Univers, suivi par l'hélium. Après le carbone, l'abondances des espèces chimiques varie en fonction inverse de leurs numéros atomiques : l'oxygène vient en troisième position, avec un numéro atomique de 8. Tous les autres sont significativement moins abondants. L'abondance des éléments légers est bien prédite théoriquement par les modèles cosmologiques standards, puisque selon ceux-ci ce sont les seuls éléments existants à l'origine : ils sont produits après le Big Bang (en quelques centaines de secondes), au cours de la nucléosynthèse primordiale. Les éléments les plus lourds sont le produit de la nucléosynthèse stellaire qui se déroule surtout dans les stades avancés de l'évolution des étoiles massives[alpha 1] (au-delà du fer, le bilan énergétique n'est plus favorable et la nucléosynthèse stellaire cesse, entraînant la mort de l'étoile et son explosion en supernova, la nucléosynthèse explosive produisant les éléments plus lourds que le fer). Enfin, les éléments légers lithium, béryllium et bore, de numéros atomiques 3,4 et 5, sont principalement issus de la nucléosynthèse interstellaire[10].
L'hélium 3 est un élément rare sur Terre, et recherché pour son utilisation dans la recherche sur la fusion thermonucléaire. On suppose qu'il existe sur la Lune des grandes quantités de cet isotope de l'hélium. L'hélium est produit également (en plus de ce qui a été produit lors du Big Bang), au cœur des étoiles lors de la fusion de l'hydrogène, soit par la chaine proton-proton, soit par le cycle CNO.
L'hydrogène et l'hélium sont supposés compter respectivement pour environ 74 et 24 % de toute la matière baryonique de l'Univers. Malgré leurs très faibles quantités, dans l'Univers, les autres éléments peuvent influencer grandement les phénomènes astrophysiques. La Voie lactée n'est formée en masse que de 2 % d'éléments autres que l'hydrogène et l'hélium.
Dans la Terre
Dans la croûte terrestre
L'oxygène est l'élément le plus important de la lithosphère, sous forme d'oxydes (notamment d'oxydes de fer qui donnent la teinte aux sols bruns, rouille, ocres et rouges, et d'oxydes de silicium qui s'associent pour former des silicates, grâce à l'élément lithophile par excellence, le silicium). Les atmophiles, trop volatils pour être intégrés dans la masse terrestre, sont concentrés dans l'atmosphère et l'hydrosphère. La Terre et les autres planètes internes ont perdu en grande partie leurs gaz les plus légers tels que l'hydrogène et l'hélium, en raison de la faible gravité de ces corps célestes et de leur proximité du Soleil (échappement atmosphérique sous l'effet du vent solaire)[11].
Dans l'eau de mer
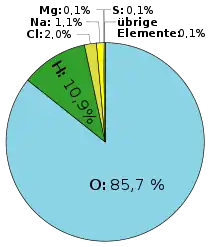
Le tableau suivant donne l'abondance des principaux éléments dans l'eau de mer, en surface.
| Z | Élément | Symbole | Abondance en surface[12] (mg/l) |
|---|---|---|---|
| 1 | Hydrogène | H | 108 000 |
| 2 | Hélium | He | 0 |
| 3 | Lithium | Li | 0,18 |
| 4 | Béryllium | Be | 0 |
| 5 | Bore | B | 4,44 |
| 6 | Carbone | C | 28 |
| 7 | Azote | N | 0,5 |
| 8 | Oxygène | O | 857 000 |
| 9 | Fluor | F | 1,3 |
| 10 | Néon | Ne | 0,00012 |
| 11 | Sodium | Na | 10 800 |
| 12 | Magnésium | Mg | 1 290 |
| 13 | Aluminium | Al | 0,002 |
| 14 | Silicium | Si | 2,2 |
| 15 | Phosphore | P | 0,06 |
| 16 | Soufre | S | 905 |
| 17 | Chlore | Cl | 19 400 |
| 18 | Argon | Ar | 0,45 |
| 19 | Potassium | K | 399 |
| 20 | Calcium | Ca | 412 |
| 21 | Scandium | Sc | 0 |
| 22 | Titane | Ti | 0,003 |
| 23 | Vanadium | V | 0,0025 |
| 24 | Chrome | Cr | 0,0003 |
| 25 | Manganèse | Mn | 0,0002 |
| 26 | Fer | Fe | 0,002 |
| 27 | Cobalt | Co | 0 |
| 28 | Nickel | Ni | 0,00056 |
| 29 | Cuivre | Cu | 0,00025 |
| 30 | Zinc | Zn | 0,0049 |
| 31 | Gallium | Ga | 0 |
| 32 | Germanium | Ge | 0 |
| 33 | Arsenic | As | 0,0037 |
| 34 | Sélénium | Se | 0,0002 |
| 35 | Brome | Br | 67,3 |
| 36 | Krypton | Kr | 0,00021 |
| 37 | Rubidium | Rb | 0,12 |
| 38 | Strontium | Sr | 7,9 |
| 39 | Yttrium | Y | 0 |
| 40 | Zirconium | Zr | 0 |
| 41 | Niobium | Nb | 0 |
| 42 | Molybdène | Mo | 0,01 |
| 44 | Ruthénium | Ru | 0 |
| 47 | Argent | Ag | 0 |
| 48 | Cadmium | Cd | 0,00011 |
| 49 | Indium | In | 0,02 |
| 50 | Étain | Sn | 0 |
| 51 | Antimoine | Sb | 0,00024 |
| 53 | Iode | I | 0,06 |
| 54 | Xénon | Xe | 0 |
| 55 | Césium | Cs | 0,0003 |
| 56 | Baryum | Ba | 0,013 |
| 57 | Lanthane | La | 0 |
| 58 | Cérium | Ce | 0 |
| 59 | Praséodyme | Pr | 0 |
| 60 | Néodyme | Nd | 0 |
| 62 | Samarium | Sm | 0 |
| 63 | Europium | Eu | 0 |
| 64 | Gadolinium | Gd | 0 |
| 65 | Terbium | Tb | 0 |
| 66 | Dysprosium | Dy | 0 |
| 67 | Holmium | Ho | 0 |
| 68 | Erbium | Er | 0 |
| 69 | Thulium | Tm | 0 |
| 70 | Ytterbium | Yb | 0 |
| 71 | Lutécium | Lu | 0 |
| 72 | Hafnium | Hf | 0 |
| 73 | Tantale | Ta | 0 |
| 74 | Tungstène | W | 0,0001 |
| 75 | Rhénium | Re | 0 |
| 79 | Or | Au | 0 |
| 80 | Mercure | Hg | 0 |
| 81 | Thallium | Tl | 0 |
| 82 | Plomb | Pb | 0 |
| 83 | Bismuth | Bi | 0 |
| 84 | Polonium | Po | 0 |
| 86 | Radon | Rn | 0 |
| 88 | Radium | Ra | 0 |
| 90 | Thorium | Th | 0 |
| 91 | Protactinium | Pa | 0 |
| 92 | Uranium | U | 0,0032 |
Dans la biosphère
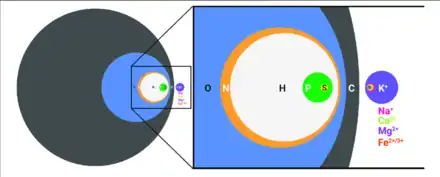
La vie a choisi parmi les 27 éléments qui y interviennent[13], principalement les CHNOPS ou CHON (le carbone C, l'hydrogène H, l'azote N, l'oxygène O, le phosphore P et le soufre S), acronyme utilisé par la communauté astrobiologique pour se rappeler des éléments fondamentaux qui composent tout organisme vivant. Les CHNOPS font partie de la famille des non-métaux correspondant aux plus petits éléments du tableau périodique qui atteignent une configuration électronique stable et qui ont tendance à former les liaisons les plus fortes[14]. L'abondance de l'oxygène et de l'hydrogène est liée à la forte proportion d'eau qui constitue les êtres vivants. Le carbone et le silicium font partie du même groupe mais leurs propriétés respectives expliquent la chimie de la vie basée sur le carbone (en) et non sur le silicium[alpha 2].
Les majorité des éléments chimiques qui composent le corps humain (à l'exception de l'hydrogène issu de la nucléosynthèse primordiale) sont créés au cœur des étoiles (nucléosynthèse stellaire engendrée par les réactions nucléaires), d'où l'expression poétique sur les hommes constitués de « poussières d'étoiles » issues des cendres des réactions nucléaires qui ont rythmé la vie d'anciennes étoiles avant leur explosion et l'ensemencement ultérieur de la nébuleuse solaire. Cette expression, introduite en 1973 par l'astronome Carl Sagan à l'occasion d'une émission de vulgarisation scientifique, est popularisée auprès du public francophone en 1984 par le livre au titre éponyme de l'astrophysicien Hubert Reeves[15] - [alpha 3].
Notes et références
Notes
- À mesure que le numéro atomique augmente, la barrière coulombienne devient plus importante. Au centre des étoiles, les réactions de fusion nucléaire requièrent des températures de plus en plus élevées, que toutes les étoiles ne sont pas capables d'atteindre. Ceci explique la décroissance de l'abondance des éléments en fonction du numéro atomique. Cf Jean Audouze, « La formation des éléments chimiques dans les étoiles », Ciel et Terre, vol. 82, nos 3-4, , p. 91.
- « Le carbone, contrairement au silicium, contracte facilement des liaisons chimiques avec de nombreux atomes, source de diversité et d'une grande adaptabilité chimique. Les groupements formés avec l'hydrogène (H), l'oxygène (O), l'azote (N), le phosphore (P), le soufre (S), capables à leur tour de lier des éléments métalliques comme le fer (Fe), le cuivre (Cu), le magnésium (Mg), le zinc (Zn), etc., assurent la diversité nécessaire aux réactions biochimiques du vivant. L'atome de silicium, plus gros que l'atome de carbone, ne peut se lier fortement qu'à un petit nombre d'éléments. Il présente une forte affinité pour l'oxygène, formant les silicates de la croûte terrestre, et pour le fluor, mais son affinité pour l'azote et son autoaffinité sont faibles, ce qui limite fortement la diversité moléculaire. De plus, les réactions des composés carbonés, au contraire des silicatés, se font aisément en solution aqueuse : les propriétés électroniques du carbone permettent la formation de doubles et triples liaisons avec d'autres atomes… Ces liaisons favorisent la délocalisation des électrons dont la capture fournit l'énergie chimique requise pour les synthèses bio-organiques. Enfin l'inertie chimique de la silice solide (SiO2) représente un handicap si on la compare à la réactivité et à la solubilité du dioxyde ». cf. Michel Cassé, Marie-Christine Maurel, Xénobiologie. Vers d'autres vies, Odile Jacob, (lire en ligne), p. 166-167.
- Cette expression apparaît déjà dans l'intuition poétique de Joni Mitchell qui chante en 1970 « Nous sommes de la poussière d'étoiles/Nous sommes de l'or/Et il nous faut retourner/Au jardin d'Eden », et de Jack London qui écrit en 1908 dans Martin Eden « Il savait parfaitement que les fibres de la beauté et de la vie sont intimement mêlées et que lui-même n'était qu'une parcelle de cet insondable, tissé de soleil, de poussière d'étoiles et d'éther ». cf. Patrick Bertrand, 100 questions pour comprendre les phénomènes de la nature, De Boeck Supérieur, , p. 285
Références
- Gilbert Burki, Panorama d'Astronomie contemporaine. Du Big Bang aux exoplanètes, Ellipses, , p. 76-80.
- (en) Hubert Reeves, « The origin of the light elements in the early Universe, », dans J.A.M. Bleeker, J. Geiss, M.C.E. Huber, The Century of Space Science, Dordrecht, Kluwer Academic Publishers, , p. 423-440.
- Michel Cassé, Généalogie de la matière, Odile Jacob, , p. 173
- « If you wish to make an apple pie from scratch, you must first invent the universe ». Tous les ingrédients de la tarte aux pommes ont en effet été créés par l'Univers. Voir (en) Carl Sagan, Cosmos, Random House, , p. 218.
- Ken Croswell, Alchemy of the Heavens, Anchor, (ISBN 0-385-47214-5, lire en ligne).
- « WMAP- Content of the Universe », sur map.gsfc.nasa.gov (consulté le ).
- Gilbert Burki, op. cit., p. 72
- Jean-Yves Daniel, Michel Hoffert, Marc Tardy, André Schaaf, André Brahic, Armelle Baldeyrou Bailly, Gilles Merzeraud, René Maury, Sciences de la Terre et de l'Univers, Vuibert, , p. 41.
- Jean-Clair Duchesne, « Introduction à la Géochimie (pour mieux comprendre comment fonctionne notre Terre) », août 2014, p. 5.
- Muriel Gargaud, Hervé Martin, Purificación López-García, Thierry Montmerle, Robert Pascal, Le Soleil, la Terre... la vie. La quête des origines, Belin, (lire en ligne), p. 30
- (en) K.A. Horvath, P.S. Bretones Jorge Ernesto Horvath, « Interdisciplinary study of the synthesis of the origin of the chemical elements and their role in the formation and structure of the Earth », Revista Brasileira de Ensino de Física, vol. 42, (DOI 10.1590/1806-9126-rbef-2020-0160).
- (en) William M. Haynes, CRC Handbook of Chemistry and Physics, vol. 97, CRC Press/Taylor and Francis, , 2652 p. (ISBN 1498754287), « Abundance of elements in the Earth's crust and in the sea », p. 2402 (14-17).
- Robert Valls, Chimie inorganique. De la classification périodique au cristal, ISTE Editions Limited, (lire en ligne), p. 37.
- (en) Muriel Gargaud (dir.), Encyclopedia of Astrobiology, Springer2011, , p. 236-237.
- Luc Lambs, La science sacrée ou la conscience de l'atome, Éditions La Vallée Heureuse, , p. 87
Voir aussi
Bibliographie
- Eric Slezak, Frédéric Thévenin, Nucléosynthèse et abondance dans l'Univers. La formation des éléments du Big-Bang aux étoiles, Éditions Cépaduès, , 393 p.
Articles connexes
- Élément chimique et plus particulièrement les sections abondance naturelle et isotopes.
- Métallicité