Chimie des gaz nobles
Les gaz nobles, souvent appelés gaz rares, rarement gaz inertes (cf. l'article Gaz noble au sujet de ces différentes dénominations), forment une famille d'éléments a priori très peu réactifs car, ayant une couche de valence complète[1], ils n’ont aucun électron de valence pour former une liaison chimique. Il en découle que ces éléments ont une énergie d'ionisation élevée et une affinité électronique pratiquement nulle, et on a longtemps cru qu'ils ne pouvaient participer à aucune réaction chimique pour former des composés.
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |
| 1 | H | He | ||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | ||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr |
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe |
| 6 | Cs | Ba | * | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| 7 | Fr | Ra | ** | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
| 8 | Uue | Ubn | ⁂ | Uth | Uts | Uto | Ute | Uqn | Uqu | Uqb | ||||||||
| ↓ | ||||||||||||||||||
| * | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | |||
| ** | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | |||
| ⁂ | Ubu | Ubb | Ubt | Ubq | Ubp | Ubh | Ubs | Ubo | Ube | Utn | Utu | Utb | Utt | Utq | Utp | |||
| Li | Métaux alcalins | Al | Métaux pauvres | |||||||||||||||
| Be | Métaux alcalino-terreux | B | Métalloïdes | |||||||||||||||
| La | Lanthanides | Non-métaux : | ||||||||||||||||
| Ac | Actinides | H | « CHNOPS » et sélénium | |||||||||||||||
| Sc | Métaux de transition | F | Halogènes | |||||||||||||||
| Mt | Nature chimique inconnue | He | Gaz nobles | |||||||||||||||
| Uue | Éléments hypothétiques (dont les superactinides) | |||||||||||||||||
Approche théorique
Linus Pauling prédit dès 1933 que les gaz nobles les plus lourds pouvaient se combiner au fluor et même à l'oxygène. Plus précisément, il prédit l'existence de l'hexafluorure de xénon XeF6 et de l'hexafluorure de krypton KrF6, spécula sur l'existence d'un octafluorure de xénon XeF8 instable, et suggéra que l'acide xénique H2XeO4 puisse former des sels de perxénates XeO64−[2] - [3]. Ces prédictions se sont avérées quasiment exactes, bien que des études ultérieures ont indiqué que l'octafluorure de xénon XeF8 serait instable non seulement thermodynamiquement, mais encore cinétiquement[4]; il n'a d'ailleurs jamais été synthétisé à ce jour.
Les gaz nobles les plus lourds ont en effet plus de couches d'électrons que les plus légers, de sorte que, pour les électrons périphériques, les couches électroniques intérieures écrantent davantage le noyau dans les atomes lourds (xénon, krypton, argon) que dans les atomes plus légers (néon, hélium). Il en résulte une énergie d'ionisation plus faible pour ces gaz nobles plus lourds, suffisamment faible pour permettre la formation de composés stables avec les éléments les plus électronégatifs, en l'occurrence le fluor et l'oxygène.
Premières structures connues contenant des gaz nobles
Jusqu'en 1962, les seuls « composés » de gaz nobles connus étaient des clathrates et des hydrates. Des composés de coordination avaient également été observés, mais uniquement par spectroscopie, sans être isolés.
- Clathrates
Ces structures ne sont pas de véritables composés chimiques de gaz nobles. Elles surviennent lorsqu'un atome est piégé dans le réseau d'un cristal ou dans certaines molécules organiques. Les atomes les plus lourds tels que le xénon, le krypton et l'argon peuvent former des clathrates avec le β-quinol, mais le néon et l'hélium sont trop petits pour être piégés.
Les clathrates de 85Kr constituent une source de particules β tandis que ceux de 133Xe sont utilisés comme sources de rayons γ.
- Composés de coordination
Leur observation effective n'a jamais été réellement attestée. L'observation du complexe d'argon et de trifluorure de bore (Ar•BF3), réputé exister à basse température, n'a jamais été confirmée, et les complexes de l'hélium avec le tungstène WHe2 et le mercure HgHe10[5] qui ont été observés après bombardement électronique de ces métaux, seraient en fait le résultat de l'adsorption de l'hélium sur la surface de ces métaux.
- Hydrates
La réalité des hydrates de gaz nobles est toujours débattue. La molécule d'eau étant fortement dipolaire, elle devrait induire un dipôle dans les atomes des gaz nobles, les plus lourds d'entre eux étant les plus sensibles à cet effet. Ce dipôle conduirait à la formation d'hydrates stables à pression élevée ; le plus stable serait l'hexahydrate de xénon Xe•6H2O.
Premiers composés « véritables » d'un gaz noble
Synthèse de l'hexafluoroplatinate de xénon
On doit à Neil Bartlett la première synthèse, en 1962, d'un composé de gaz noble. Le raisonnement était le suivant :
- L'énergie d'ionisation de l'oxygène O2 en oxycation dioxygényle O2+ vaut 1 165 kJ/mol contre 1 170 kJ/mol pour ioniser Xe en Xe+.
- Or l'hexafluorure de platine PtF6 est capable d'oxyder O2 en O2+.
- Donc PtF6 devrait être capable d'oxyder Xe en Xe+ puisque les énergies d'ionisation de l'oxygène et du xénon sont semblables.
C'est ainsi que Bartlett publia la synthèse d'un solide cristallin qu'il formula comme de l'hexafluoroplatinate de xénon Xe+PtF6−[6].
On montra par la suite qu'en réalité cette phase était plus complexe, et résultait du mélange de plusieurs espèces moléculaires, XeFPtF6, XeFPt2F11 et Xe2F3PtF6[7] - [8].
Il s'agissait bien du premier composé synthétisé d'un gaz noble.
Fluorures de xénon
À la suite de la synthèse de l'hexafluoroplatinate de xénon, Howard Claassen publia en septembre 1962 la synthèse d'un composé binaire simple du xénon, le tétrafluorure de xénon XeF4 en soumettant un mélange de xénon et de fluor à température élevée[9].
Deux mois plus tard, le difluorure de xénon XeF2 était annoncé par Rudolf Hoppe[10].
Depuis lors, la grande majorité des composés de gaz nobles synthétisés l'ont été à partir du xénon.
Revue des composés de gaz nobles connus à ce jour
Excimères et exciplexes
Si les atomes de gaz nobles sont chimiquement peu réactifs à l'état fondamental, ils peuvent en revanche former des complexes entre eux ou avec des halogènes lorsqu'ils sont excités. Ces complexes sont stables lorsqu'ils sont excités, mais se dissocient dès que les atomes retombent à leur état fondamental : c'est ce qu'on appelle un excimère lorsque les atomes du complexe sont homogènes, ou un exciplexe lorsque les atomes du complexe sont hétérogènes. La transition d'énergie entre états excités et état fondamental est à l'origine d'un rayonnement de longueur d'onde précise utilisé dans la réalisation de certains lasers. Les principales espèces sont les suivantes :
- Excimères de gaz nobles : Ar2*, Kr2*, Xe2*.
- Exciplexes d'halogènes et de gaz nobles : NeF*, ArF*, KrF*, XeF*, ArCl*, KrCl*, XeCl*, XeBr*.
Chimie de l'hélium
- Configuration électronique de l'hélium : 1s2.
Outre un certain nombre d'excimères avec le tungstène, le fluor, l'iode, le soufre et le phosphore, l'hélium soumis à un flux d'électrons (sous l'effet d'un bombardement, d'une décharge ou à l'aide d'un plasma) peut également former des composés (dont la réalité "chimique" est encore débattue) avec le mercure (HgHe10) et le tungstène (WHe2), ainsi que des ions moléculaires HeNe+, He2+, He22+, HeH+ (hydrure d'hélium) et HeD+ (deutérure d'hélium)[11].
En théorie, d'autres composés seraient possibles, tel que le fluorohydrure d'hélium HHeF, qui serait analogue au fluorohydrure d'argon HArF détecté en 2000[12].
Certains calculs laissent penser que l'hélium pourrait former des oxydes ioniques stables[13]. Les deux nouvelles espèces moléculaires prédites par ce modèle, CsFHeO et N(CH3)4FHeO, dériveraient de l'anion métastable OHeF− déjà proposé en 2005 par une équipe de Taïwan, dans lequel la liaison O-He serait de nature covalente et la charge négative portée essentiellement par l'atome de fluor. Néanmoins, ces propositions demeurent pour l'heure de simples spéculations.
Chimie du néon
- Configuration électronique du néon : 1s2 2s2 2p6.
Le néon est en principe le moins réactif de tous les gaz nobles, et on considère généralement qu'il est réellement inerte chimiquement. Les énergies de liaisons calculées pour le néon avec divers éléments (hydrogène, bore, béryllium, métaux nobles) sont encore inférieures à celles calculées pour l'hélium. Aucun composé neutre du néon n'a été identifié, en revanche les ions moléculaires HNe+, HeNe+, Ne2+ et NeAr+ ont été observés lors d'études optiques ou spectroscopiques[14].
Chimie de l'argon
- Configuration électronique de l'argon : 1s2 2s2 2p6 3s2 3p6.
L'argon est à peine plus réactif que le néon. Le seul composé connu à ce jour autour de l'argon est l'hydrofluorure d'argon HArF, synthétisé en août 2000 à l'Université d'Helsinki[15]. Cette molécule n'a en fait jamais été isolée, mais seulement détectée par spectroscopie. Elle est extrêmement instable, et se dissocie en argon et fluorure d'hydrogène au-dessus de moins 246 °C.
Chimie du krypton
- Configuration électronique du krypton : 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6.
Le krypton est le plus léger des gaz nobles pour lequel on a pu isoler au moins un composé covalent, en l'occurrence le difluorure de krypton KrF2, synthétisé pour la première fois en 1963 dans la foulée des travaux sur le xénon[15]. D'autres composés, dans lesquels un atome de krypton est lié à un atome d'azote pour les uns et à un atome d'oxygène pour les autres, ont également été publiés[16], mais ils ne sont stables qu'en dessous de −60 °C pour les premiers et −90 °C pour les seconds. Certains résultats font ainsi état de la synthèse de divers oxydes et fluorures de krypton, ainsi que d'un sel d'oxoacide de krypton (à l'instar de la chimie du xénon).
Des études sur les ions moléculaires ArKr+ et KrH+ ont eu lieu, et les espèces KrXe et KrXe+ ont été observées[17].
Les équipes de l'Université d'Helsinki, à l'origine de la détection du fluorohydrure d'argon HArF, auraient également détecté du cyanohydrure de krypton HKrC≡N ainsi que de l'hydrokryptoacétylène HKrC≡CH, qui se dissocieraient dès 40 K[15].
D'une manière générale, il faut recourir à des conditions extrêmes (matrice cryogénique ou jet gazeux supersonique) pour observer des molécules neutres dans lesquelles un atome de krypton est lié à un non-métal comme l'hydrogène, le carbone ou le chlore, voire à un métal de transition tel que le cuivre, l'argent ou l'or[18].
Chimie du xénon
- Configuration électronique du xénon : 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6.
L'hexafluoroplatinate de xénon a été le premier composé jamais synthétisé du xénon (et, plus généralement, d'un gaz noble : voir plus haut).
À la suite de ces travaux, fondés sur des réactions d'oxydation, une foule de composés de xénon combiné à du fluor et/ou de l'oxygène ont été réalisés, donnant une série d'oxydes, de fluorures et d'oxyfluorures de xénon :
- XeF2 : Difluorure de xénon
- XeF4 : Tétrafluorure de xénon
- XeF6 : Hexafluorure de xénon
- XeO3 : Trioxyde de xénon, un solide explosif
- XeO4 : Tétraoxyde de xénon
- XeOF2 : Oxydifluorure de xénon
- XeO2F2 : Dioxydifluorure de xénon
- XeO3F2 : Trioxydifluorure de xénon
- XeOF4 : Oxytétrafluorure de xénon
- XeO2F4 : Dioxytétrafluorure de xénon
Les oxydes de xénon sont solubles dans l'eau, où ils donnent deux oxoacides :
- H2XeO4 : acide xénique, solution aqueuse de XeO3
- H4XeO6 : acide perxénique, solution aqueuse de XeO4
L'acide perxénique est lui-même susceptible de former des perxénates, par exemple :
- Na4XeO6 : Perxénate de sodium, soluble dans l'eau
- K4XeO6 : Perxénate de potassium, soluble dans l'eau
- Ba2XeO6 : Perxénate de baryum, insoluble
Le dioxyde de xénon XeO2 demeure rebelle à toute tentative de synthèse, et seul le cation XeO2+ a été détecté par spectroscopie dans de l'argon cryogénique[19].
La grande majorité des composés du xénon produits jusque dans les années 1980 combinaient le fluor et/ou l'oxygène avec le xénon[20] - [21]; lorsqu'ils intégraient d'autres éléments, comme de l'hydrogène ou du carbone, c'étaient généralement avec des atomes électronégatifs d'oxygène et/ou de fluor[22]. Néanmoins, une équipe animée par Markku Räsänen de l'Université d'Helsinki a publié en 1995 la synthèse du dihydrure de xénon XeH2, puis celle de l'hydroxy-hydrure de xénon HXeOH, de l'hydroxénoacétylène HXeCCH et d'autres composés du xénon[23] - [24]. Par la suite, Khriatchev et al. ont publié la synthèse de HXeOXeH par photolyse d'eau dans une matrice de xénon cryogénique[25]. Ils ont également fait état des molécules deutérées HXeOD et DXeOD[26]. Le nombre de composés connus du xénon est aujourd'hui de l'ordre du millier, certains présentant des liaisons entre le xénon et le carbone, l'azote, le chlore, l'or ou le mercure[18] - [27], tandis que d'autres, observés dans des conditions extrêmes (matrices cryogéniques ou jets gazeux supersoniques) présentent des liaisons entre le xénon et l'hydrogène, le bore, le béryllium, le soufre, l'iode, le brome, le titane, le cuivre et l'argent[18].
L'un des composés les plus inattendus du xénon est le complexe qu'il forme avec l'or. Le cation tétraxénon-or AuXe42+ a en effet été caractérisé par l'équipe allemande de Konrad Seppelt dans le complexe AuXe42+(Sb2F11−)2[28].
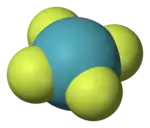
Les composés des gaz nobles sont vus comme des espèces hypercoordonnées dans la mesure où ils violent la règle de l'octet. Les liaisons dans ce type de structure peuvent être décrites selon le modèle de la liaison à trois centres et quatre électrons, dans lequel trois atomes colinéaires établissent deux liaisons résultant chacune de trois orbitales moléculaires issues des orbitales atomiques p de chacun des trois atomes. L'orbitale moléculaire haute occupée se concentre sur les ligands, configuration stabilisée par leur caractère électronégatif : typiquement l'oxygène et, surtout, le fluor.
Une liaison 3c-4e s'établit entre deux ligands situés de part et d'autre de l'atome de xénon. Les fluorures de xénon sont particulièrement bien décrits par ce modèle, qui explique d'une part pourquoi on a toujours un nombre pair d'atomes de fluor autour du xénon dans ces composés, et d'autre part pourquoi leur géométrie est toujours à base d'unités F-Xe-F orthogonales :
 |
 |
 |
| Difluorure de xénon XeF2 | Tétrafluorure de xénon XeF4 | Hexafluorure de xénon XeF6 |
|---|
Chaque unité F-Xe-F formant une liaison 3c-4e peut également être vue comme en équilibre entre deux formes ioniques en résonance :
- F-Xe+ −F F− +Xe-F
Cette représentation avec les formules de Lewis rend également bien compte de l'accroissement de la densité électronique autour des atomes de fluor ainsi que de la géométrie de ces molécules.
Chimie du radon
- Configuration électronique du radon : 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6.
Le radon est un gaz noble radioactif. Son isotope le plus stable, le 222Rn, est issu du 226Ra et se désintègre par radioactivité α en 218Po avec une période radioactive de 3,823 jours. Cette donnée limite fortement les recherches pratiques sur cet élément ainsi que les retombées potentielles de ces recherches, d'autant que ce gaz noble est plutôt cher. C'est la raison pour laquelle, bien que le radon soit chimiquement plus réactif que le xénon, assez peu de composés de radon ont à ce jour été publiés ; ce sont simplement des oxydes ou des fluorures.
Le fluorure de radon a ainsi été synthétisé dans les années 1970[29] - [30]; c'est un solide faiblement volatil dont la composition exacte n'a jamais pu être établie en raison de la radioactivité du radon. Il pourrait s'agir d'un composé ionique plus que covalent. La modélisation de la structure du difluorure de radon RnF2 aboutit à une longueur de 208 pm pour la liaison Rn-F, et une stabilité thermodynamique supérieure pour RnF2 que pour XeF2 [31]. La molécule octaédrique d'hexafluorure de radon RnF6 aurait une enthalpie de formation encore plus faible que celle de RnF2[32].
L'ion RnF+ se formerait avec l'hexafluoroarsénate de dioxygényle O2AsF6 selon la réaction[33]:
- Rn(g) + 2 O2+AsF6−(s) → RnF+As2F11−(s) + 2 O2 (g)
Des oxydes de radon auraient également été synthétisés, notamment le trioxyde de radon RnO3 en URSS[34]. Le carbonyle de radon RnCO serait stable, avec une configuration linéaire[35]. Les molécules Rn2 et XeRn seraient étroitement stabilisées par couplage de spin[36].
Chimie théorique de l'oganesson
- Configuration électronique classique de l'oganesson : 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d10 7p6 ?
L'oganesson est un élément synthétique radioactif de numéro atomique 118 et de symbole Og appartenant à la colonne des gaz nobles mais chimiquement très différent de ces derniers. Son noyau très instable n'a permis d'en synthétiser en tout et pour tout que trois atomes à ce jour, avec de surcroît une période radioactive de 0,89 ms (nucléide 294Og). Dans ces conditions, toutes nos connaissances sur les propriétés massives de cet élément sont issues de modèles théoriques élaborés pour certains dès les années 1960[37].
La structure électronique de l'élément 118 lui conférerait une réactivité chimique significative, qui le ferait s'écarter du paradigme des gaz nobles, avec un caractère électropositif plus marqué. Les calculs sur la molécule Og2 ont montré qu'elle aurait une énergie de liaison du même ordre de grandeur que celle du dimère de mercure Hg2 et une énergie de dissociation de 6 kJ/mol, soit quatre fois plus que celle du dimère Rn2[38]. Mais le plus frappant est que la longueur de liaison calculée pour Og2 serait inférieure de 16 pm à celle de Rn2, signe d'une liaison assez forte. Néanmoins, l'ion OgH+ aurait une énergie de dissociation inférieure à celle de l'ion RnH+. Le composé neutre OgH aurait une liaison extrêmement faible, qui serait assimilable à une pure liaison de Van der Waals[39].
L'oganesson semble former des composés plus stables avec les éléments très électronégatifs, notamment avec le fluor dans le difluorure d'oganesson OgF2 et le tétrafluorure d'oganesson OgF4[40].
Contrairement aux autres gaz nobles, l'élément 118 serait assez électropositif pour former des liaisons covalentes avec le chlore[41] et conduire à des chlorures d'oganesson OgCln.
Complexes endoédriques de fullerènes
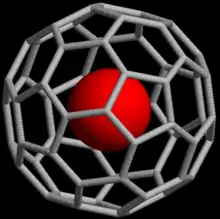
C'est une des formes parmi les plus étudiées pour piéger les gaz nobles. Les fullerènes forment une classe de molécules de carbone de forme sphéroïdale, ellipsoïdale, tubulaire (on parle alors de nanotubes) voire d'anneau. Ainsi elles se différencient des clathrates qui sont composés de molécules d'eau. Le plus courant de ces fullerènes est composé de soixante atomes de carbone disposés aux sommet d'un icosaèdre tronqué donnant à la molécule l'aspect d'une sphère creuse évoquant un ballon de football. Ces molécules étant creuses, il est possible d'y piéger un atome de gaz noble quelconque, noté Ng, pour former un complexe, doté de propriétés physicochimiques particulières, qu'on note conventionnellement Ng@C60 (voir image ci-contre).
La formation de complexes He@C60 et Ne@C60 par application d'une pression de 300 kPa de d'hélium ou de néon sur du fullerène C60 a été publiée dès 1993[42]. Mais en fait à peine une molécule de fullerène sur 650 000 peut être ainsi dopée par un atome endoédrique de gaz noble ; ce taux peut être porté à une molécule sur 1 000 en appliquant une pression de 300 MPa d'hélium ou de néon.
On a également obtenu des complexes endoédriques d'argon Ar@C60, de krypton Kr@C60 et de xénon Xe@C60[43].
Notes et références
- C'est-à-dire dont les sous-couches s et p sont occupées respectivement par deux et six électrons, faisant un total de huit — hormis bien sûr l'hélium, qui n'a que deux électrons sur sa sous-couche 1s.
- (en) Linus Pauling, « The Formulas of Antimonic Acid and the Antimonates », J. Am. Chem. Soc., vol. 55, no 5, , p. 1895–1900 (DOI 10.1021/ja01332a016).
- (en) John H. Holloway, Noble-Gas Chemistry, Londres, Methuen, .
- (en) Konrad Seppelt, « Recent developments in the Chemistry of Some Electronegative Elements », Acc. Chem. Res., vol. 12, , p. 211–216 (DOI 10.1021/ar50138a004).
- (en) J. J. Manley, « Mercury Helides », Nature, no 117, , p. 587-588 (DOI 10.1038/117587b0).
- (en) N. Bartlett, « Xenon hexafluoroplatinate Xe+[PtF6]− », Proceedings of the Chemical Society, no 6, , p. 218 (DOI 10.1039/PS9620000197).
- (en) L. Graham, O. Graudejus, N.K. Jha et N. Bartlett, « Concerning the nature of XePtF6 », Coord. Chem. Rev., vol. 197, , p. 321–334 (DOI 10.1016/S0010-8545(99)00190-3).
- Holleman, A. F.; Wiberg, E. "Inorganic Chemistry" Academic Press: San Diego, 2001. (ISBN 0-12-352651-5).
- (en) H. H. Claassen, H. Selig et J. G. Malm, « Xenon Tetrafluoride », J. Am. Chem. Soc., vol. 84, no 18, , p. 3593 (DOI 10.1021/ja00877a042).
- (en) R. Hoppe, W. Daehne, H. Mattauch et K. Roedder, « Fluorination of Xenon », Angew. Chem. Intern. Ed. Engl., vol. 1, , p. 599 (DOI 10.1002/anie.196205992).
- (en) Julius W. Hiby, « Massenspektrographische Untersuchungen an Wasserstoff- und Heliumkanalstrahlen (H3+, H2−, HeH+, HeD+, He−) », Annalen der Physik, vol. 426, no 5, , p. 473–487 (DOI 10.1002/andp.19394260506)
- (en) Ming Wah Wong, « Prediction of a Metastable Helium Compound: HHeF », J. Am. Chem. Soc., vol. 122, no 26, , p. 6289–6290 (DOI 10.1021/ja9938175)
- (en) W. Grochala, « On Chemical Bonding Between Helium and Oxygen », Pol. J. Chem., vol. 83, , p. 87–122
- « Periodic Table: Neon »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?) (consulté le ). Lawrence Livermore National Laboratory. Dernière mise à jour : 15/12/2003 ; consulté le 31/08/2007
- (en) Neil Bartlett, « The Noble Gases », Chemical & Engineering News
- (en) John F. Lehmann, Hélène P. A. Mercier and Gary J. Schrobilgen, « The chemistry of krypton », Coord. Chem. Rev., vol. 233-234, , p. 1-39 (DOI 10.1016/S0010-8545(02)00202-3)
- « http://www.bu.edu/ehs/ih/pdf/periodic_table.pdf »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?) (consulté le )
- (en) Wojciech Grochala, « Atypical compounds of gases, which have been called noble », Chem. Soc. Rev., vol. 36, no 36, , p. 1632–1655 (DOI 10.1039/b702109g)
- (en) M. Zhou, Y. Zhao, Y. Gong et J. Li, « Formation and Characterization of the XeOO+ Cation in Solid Argon », J. Am. Chem. Soc., vol. 128, , p. 2504–2505 (DOI 10.1021/ja055650n)
- « http://www.chemnetbase.com/periodic_table/elements/xenon.htm »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?) (consulté le )
- (en) G. J. Moody, « A Decade of Xenon Chemistry », J. Chem. Educ., vol. 51, , p. 628–630 (lire en ligne, consulté le )
- (en) Charlie J. Harding et Rob Janes, Elements of the P Block, Cambridge, Royal Society of Chemistry, , 305 p. (ISBN 978-0-85404-690-4, LCCN 2005472333, lire en ligne)
- (en) R. B. Gerber, « Formation of novel rare-gas molecules in low-temperature matrices », Annu. Rev. Phys. Chem., vol. 55, , p. 55–78 (DOI 10.1146/annurev.physchem.55.091602.094420, lire en ligne)
- Bartlett, 2003 : cf. § commençant par « Many recent findings ».
- (en) Leonid Khriachtchev, Karoliina Isokoski, Arik Cohen, Markku Räsänen et R. Benny Gerber, « A Small Neutral Molecule with Two Noble-Gas Atoms: HXeOXeH », J. Am. Chem. Soc., vol. 130, no 19, , p. 6114–6118 (DOI 10.1021/ja077835v, lire en ligne, consulté le )
- (en) Mika Pettersson, Leonid Khriachtchev, Jan Lundell et Markku Räsänen, « A Chemical Compound Formed from Water and Xenon: HXeOH », J. Am. Chem. Soc., vol. 121, no 50, , p. 11904–11905 (DOI 10.1021/ja9932784, lire en ligne, consulté le )
- (en) Charlie J. Harding et Rob Janes, Elements of the P Block, Royal Society of Chemistry, (ISBN 0-85404-690-9), p. 90-99
- (en) Konrad Seppelt et Stefan Seidel, « Xenon as a Complex Ligand: The Tetra Xenono Gold(II) Cation in AuXe42+(Sb2F11−)2 », Science, vol. 290, no 5489, , p. 117–118 (DOI 10.1126/science.290.5489.117)
- (en) L. Stein, « Ionic Radon Solution », Science, vol. 168, , p. 362 (PMID 17809133, DOI 10.1126/science.168.3929.362)
- (en) Kenneth S. Pitzer, « Fluorides of radon and element 118 », J. Chem. Soc., Chem. Commun., , p. 760–761 (DOI 10.1039/C3975000760b)
- (en) Liao Meng-Sheng et Zhang Qian-Er, « Chemical Bonding in XeF2, XeF4, KrF2, KrF4, RnF2, XeCl2, and XeBr2: From the Gas Phase to the Solid State », J. Phys. Chem. A, vol. 102, , p. 10647 (DOI 10.1021/jp9825516)
- (en) Michael Filatov, « Bonding in radon hexafluoride: An unusual relativistic problem? », Phys. Chem. Chem. Phys., vol. 5, , p. 1103 (DOI 10.1039/b212460m)
- (en) J Holloway, « Noble-gas fluorides », J. Fluor. Chem., vol. 33, , p. 149 (DOI 10.1016/S0022-1139(00)85275-6)
- (en) V. V. Avrorin, R. N. Krasikova, V. D. Nefedov et M. A. Toropova, « The Chemistry of Radon », Russ. Chem. Rev., vol. 51, no 1, , p. 12–20 (DOI 10.1070/RC1982v051n01ABEH002787)
- (en) Gulzari L. Malli, « Prediction of the existence of radon carbonyl: RnCO », Int. J. Quantum Chem., vol. 90, , p. 611 (DOI 10.1002/qua.963)
- (en) Nino Runeberg, « Relativistic pseudopotential calculations on Xe2, RnXe, and Rn2: The van der Waals properties of radon », Int. J. Quantum Chem., vol. 66, , p. 131 (DOI 10.1002/(SICI)1097-461X(1998)66:2<131::AID-QUA4>3.0.CO;2-W)
- (en) A. V. Grosse, « Some physical and chemical properties of element 118 (Eka-Em) and element 86 (Em) », Journal of Inorganic and Nuclear Chemistry, Elsevier Science Ltd., vol. 27, no 3, , p. 509–19 (DOI 10.1016/0022-1902(65)80255-X)
- (en) Clinton S. Nash, « Atomic and Molecular Properties of Elements 112, 114, and 118 », J. Phys. Chem. A, vol. 109, no 15, , p. 3493–3500 (DOI 10.1021/jp050736o)
- (en) Han Young-Kyu, Bae Cheolbeom, Son Sang-Kil et Lee Yoon Sup, « Spin–orbit effects on the transactinide p-block element monohydrides MH (M=element 113–118) », J. Chem. Phys., vol. 112, no 6, (DOI 10.1063/1.480842)
- (en) Han Young-Kyu et Lee Yoon Sup, « Structures of RgFn (Rg = Xe, Rn, and Element 118. n = 2, 4.) Calculated by Two-component Spin-Orbit Methods. A Spin-Orbit Induced Isomer of (118)F4 », J. Phys. Chem. A, vol. 103, no 8, , p. 1104–1108 (DOI 10.1021/jp983665k)
- (en) Uzi Kaldor et Stephen Wilson, Theoretical Chemistry and Physics of Heavy and Superheavy Elements, Dordrecht, Springer, , 565 p. (ISBN 978-1-4020-1371-3, LCCN 2003058219, lire en ligne), p. 105
- (en) M. Saunders, H. A. Jiménez-Vázquez, R. J. Cross et R. J. Poreda, « Stable compounds of helium and neon. He@C60 and Ne@C60 », Science, vol. 259, , p. 1428–1430 (PMID 17801275, DOI 10.1126/science.259.5100.1428)
- (en) Martin Saunders, Hugo A. Jimenez-Vazquez, R. James Cross, Stanley Mroczkowski, Michael L. Gross, Daryl E. Giblin et Robert J. Poreda, « Incorporation of helium, neon, argon, krypton, and xenon into fullerenes using high pressure », J. Am. Chem. Soc., vol. 116, no 5, , p. 2193–2194 (DOI 10.1021/ja00084a089)
