Hexafluorure de platine
| Hexafluorure de platine | |
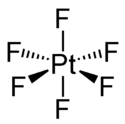  Structure de l'hexafluorure de platine |
|
| Identification | |
|---|---|
| Synonymes |
fluorure de platine(VI) |
| No CAS | |
| No ECHA | 100.033.816 |
| PubChem | 16195397 |
| SMILES | |
| InChI | |
| Apparence | solide volatil rouge foncé, gaz rouge[1] |
| Propriétés chimiques | |
| Formule | PtF6 |
| Masse molaire[2] | 309,074 ± 0,009 g/mol F 36,88 %, Pt 63,12 %, |
| Moment dipolaire | 0 D |
| Propriétés physiques | |
| T° fusion | 61,3 °C[1] |
| T° ébullition | 69,1 °C[1] |
| Miscibilité | 5,21 g·cm−3 à −140 °C[3] |
| Cristallographie | |
| Système cristallin | orthorhombique |
| Symbole de Pearson | |
| Classe cristalline ou groupe d’espace | (no 62) |
| Précautions | |
| Directive 67/548/EEC | |
| Oxydant puissant | |
| Unités du SI et CNTP, sauf indication contraire. | |
L'hexafluorure de platine est un composé chimique moléculaire de formule brute PtF6. C'est un solide rouge foncé, volatil qui forme un gaz rouge. Ces molécules contiennent du platine dans un état d'oxydation +6 et sont le seul exemple hexa-halogénure de la triade nickel, palladium, platine. Avec quatre électrons d, elles sont paramagnétiques avec un état fondamental triplet de spin (S=1).
PtF6 est un des plus puissants agents oxydants[4] - et aussi un puissant agent de fluoration - qui est bien connu pour sa réaction avec le xénon qui forme XePtF6, l'hexafluoroplatinate de xénon qui fut le premier composé d'un gaz noble synthétisé en 1962 par Neil Bartlett. Celui-ci avait auparavant observé que PtF6 est capable de réagir avec l'oxygène, O2, en l'oxydant pour former l'hexafluoroplatinate de dioxygényle, (PtF6)−O2+.
Synthèse
PtF6 a été préparé pour la première fois en 1957 par réaction du fluor sur le platine métal[5]. Cette voie de synthèse reste une méthode de choix[6].
- Pt + 3 F2 → PtF6
PtF6 peut aussi être préparé par dismutation de PtF5. Ce dernier peut être obtenu par fluoration de PtCl2.
- PtCl2 + 2.5 F2 → PtF5 + Cl2
- 2 PtF5 → PtF6 + PtF4
Autres hexafluorures
Les hexafluorures neutres d'autres éléments sont aussi volatils. Ce sont les composés d'osmium, iridium, rhodium, ruthénium, rhénium, tungstène, technétium et uranium. Tous sont des oxydants très agressifs. L'hexafluorure d'uranium et l'hexafluorure de tungstène sont utilisés dans les industries nucléaire et microélectronique, respectivement. Dans le groupe des non-métaux, le soufre, le xénon, le sélénium et le tellure forment des hexafluorures stables. L'hexafluorure de soufre est même si stable, ceci étant peut-être dû à des effets stériques, qu'il est utilisé comme liquide inerte dans des transformateurs électriques. Les analogues hexafluorure de sélénium et hexafluorure de tellure sont cependant extrêmement réactifs.
Comme les hexafluorures de Mo, Tc, Ru, Rh, W, Re, Os et Ir, PtF6 est octaédrique aussi bien à l'état solide qu'à l'état gazeux. La longueur des liaisons Pt-F vaut 185 pm[6].
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Platinum hexafluoride » (voir la liste des auteurs).
- Perry, Dale L. et Sidney L. Phillips, Handbook of Inorganic Compounds, CRC Press, 1995 (ISBN 0849386713). Lire en ligne
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- T. Drews, J. Supeł, A. Hagenbach, K. Seppelt, Solid State Molecular Structures of Transition Metal Hexafluorides, Inorganic Chemistry, 2006, vol. 45(9), pp. 3782–3788.DOI 10.1021/ic052029f, .
- Grennwood, N. N.; Earnshaw, A.; Chemistry of the elements; Pregamon Press, Edition 1994, pp 1333-1340. (ISBN 0-08-022056-8)
- Platinum Hexafluoride, Weinstock, B.; Claassen, H. H.; Malm, J. G.; Journal of the American Chemical Society, 1957, volume 79, pp 5832–5832. DOI 10.1021/ja01578a073
- Drews, T. ; Supel, J. ; Hagenbach, A. ; Seppelt, K. ; Solid State Molecular Structures of Transition Metal Hexafluorides, Inorganic Chemistry, 2006, vol. 45, p. 3782–3788. DOI 10.1021/ic052029f



