Acide xénique
L'acide xénique est un composé du xénon qui se forme lors de la mise en solution aqueuse de trioxyde de xénon XeO3.
| Acide xénique | |
| |
| Propriétés chimiques | |
|---|---|
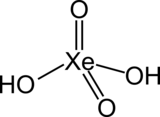
| Formule | H2XeO4 |
| Masse molaire[1] | 197,306 ± 0,007 g/mol H 1,02 %, O 32,44 %, Xe 66,54 %, |
| Unités du SI et CNTP, sauf indication contraire. | |
Sa formule chimique est H2XeO4 :
- XeO3(aq) + H2O → H2XeO4 H+ + HXeO4−
C'est un agent oxydant très énergique dont la décomposition est dangereuse, libérant de grandes quantités de gaz : du xénon, de l'oxygène et de l'ozone.
Il tend à se dismuter lentement en xénon et perxénate avec libération d'oxygène :
- 2 HXeO4− → Xe + O2 + H2XeO62−
C'est ce qui explique la formation de perxénate de sodium dans une solution d'acide xénique sous l'action de la soude :
- H2XeO62− + 4 Na+ + 2 OH− → Na4XeO6 (s) + 2 H2O
L'existence de l'acide xénique avait été conjecturée par Linus Pauling dès 1933[2].
Cet acide a été utilisé comme agent oxydant en synthèse organique.
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Linus Pauling, « The Formulas of Antimonic Acid and the Antimonates », J. Am. Chem. Soc., vol. 55,, no 5, , p. 1895–1900 (DOI 10.1021/ja01332a016)
Voir aussi
Cet article est issu de wikipedia. Text licence: CC BY-SA 4.0, Des conditions supplémentaires peuvent s’appliquer aux fichiers multimédias.
