Acide perxénique
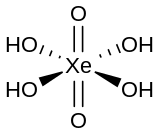
L'acide perxénique, de formule H4XeO6, est en réalité la solution aqueuse du tétraoxyde de xénon XeO4. C'est un agent oxydant très énergique et très acide, bien que plus faible que l'acide perchlorique dans l'eau :
- H4XeO6 + H2O H3O+ + H3XeO6−, pKa1 < 0
- H3XeO6− + H2O H3O+ + H2XeO62−, pKa2 = 4,29 ± 0,03, ΔH° = 0 ± 5 kJ·mol-1
- H2XeO62− + H2O H3O+ + HXeO63−, pKa3 = 10,81 ± 0,04, ΔH° = 3 ± 2 kJ·mol-1
- HXeO63− + H2O H3O+ + XeO64−, pKa4 > 14
| Acide perxénique | |
| |
| Identification | |
|---|---|
| No CAS | |
| Propriétés chimiques | |
| Formule | H4XeO6 |
| Masse molaire[1] | 231,321 ± 0,008 g/mol H 1,74 %, O 41,5 %, Xe 56,76 %, |
| Unités du SI et CNTP, sauf indication contraire. | |
L'acide perxénique est susceptible de former quatre types de sels, par exemple (en prenant les perxénates d'argent) :
- AgH3XeO6
- Ag2H2XeO6
- Ag3HXeO6
- Ag4XeO6
Cet acide n'est homologue d'aucun autre, mais le tétraoxyde de xénon peut être rangé avec le tétraoxyde d'osmium.
Articles connexes
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
Cet article est issu de wikipedia. Text licence: CC BY-SA 4.0, Des conditions supplémentaires peuvent s’appliquer aux fichiers multimédias.
