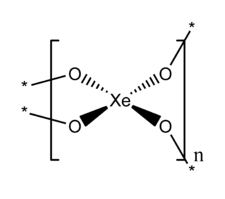
Dioxyde de xénon
Le dioxyde de xénon est le composé chimique de formule XeO2. Il fut synthétisé en 2011 par hydrolyse à 0 °C de tétrafluorure de xénon XeF4 avec 2,00 mol·L-1 d'acide sulfurique H2SO4[2].
Structure
XeO2 a une structure étendue dans laquelle le xénon et l'oxygène sont respectivement de coordinence 4 et 2.
Propriétés
XeO2 est un solide jaune-orangé[3]. C'est un composé instable, avec une demi-vie d'environ deux minutes, qui se dismute en trioxyde de xénon XeO3 et en xénon Xe. Ses propriétés ont été étudiées en le refroidissant à −78 °C et c'est surtout la spectroscopie Raman qui a été utilisée[4].
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) David S. Brock et Gary J. Schrobilgen, « Synthesis of the Missing Oxide of Xenon, XeO2, and Its Implications for Earth’s Missing Xenon », Journal of the American Chemical Society, vol. 133, no 16, , p. 6265-6269 (PMID 21341650, DOI 10.1021/ja110618g, lire en ligne)
- (en) Simon Cotton, « Soundbite Molecules », sur Royal Society of Chemistry, (consulté le )
- (en) « Xenon Dioxide May Solve One of Earth's Mysteries », sur L’Actualité chimique canadienne (Canadian Chemical News)., (version du 9 février 2013 sur Internet Archive)
Article connexe
Cet article est issu de wikipedia. Text licence: CC BY-SA 4.0, Des conditions supplémentaires peuvent s’appliquer aux fichiers multimédias.