Hexafluorure de xénon
L'hexaflurorure de xénon est le composé du xénon de formule XeF6. C'est un solide cristallin incolore stable à température ambiante, et le plus énergique des agents fluorants du xénon. On le prépare en chauffant le difluorure de xénon XeF2 à 300 °C sous 6 MPa pendant suffisamment longtemps pour que la concentration d'hexafluorure devienne significative.
| Hexafluorure de xénon | |
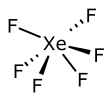 Structure de l'hexafluorure de xénon |
|
| Identification | |
|---|---|
| No CAS | |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | XeF6 |
| Masse molaire[1] | 245,283 ± 0,006 g/mol F 46,47 %, Xe 53,53 %, |
| Propriétés physiques | |
| T° fusion | 49,25 °C |
| T° ébullition | 75,6 °C |
| Solubilité | Réagit avec l'eau |
| Masse volumique | 3 560 kg·m-3 à 15 °C |
| Unités du SI et CNTP, sauf indication contraire. | |
Propriétés chimiques
L'hexafluorure de xénon s'hydrolyse par étapes en libérant du fluorure d'hydrogène HF pour aboutir finalement au trioxyde de xénon[2] XeO3 :
L'hexafluorure de xénon se comporte comme un acide de Lewis, pouvant capturer un ou deux ions fluorure :
- XeF6 + F− → XeF7−
- XeF7− + F− → XeF82−
Le sel Rb2XeF8 est l'un des composés les plus stables du xénon : il ne se décompose qu'au-delà de 400 °C[3].
Structure
À la différence du difluorure XeF2 et du tétrafluorure XeF4, l'établissement de la structure de l'hexafluorure de xénon XeF6 a nécessité plusieurs années. La théorie VSEPR prévoit que la présence de six ligands fluorure et un doublet non liant ne permet pas d'obtenir une symétrie octaédrique parfaite. En effet, la diffraction des électrons ainsi que les calculs avancés de chimie numérique indiquent que le groupe ponctuel de symétrie de la molécule est C3v. Il s'agit d'une molécule fluxionnelle (en), qui oscille entre plusieurs géométries équivalentes. L'énergie de la symétrie octaédrique Oh n'est que très peu supérieure, ce qui indique que le minimum de la surface d'énergie potentielle est très peu profond[4].
La spectroscopie RMN du xénon 129 et du fluor 19 indique que la molécule en solution présente une structure tétramérique : quatre atomes de xénon équivalents sont disposés de façon tétraédrique entourés d'un réseau fluctuant de 24 atomes de fluor échangeant leurs positions à la manière d'engrenages.
On connaît six polymorphes du XeF6[5], dont un formé d'ions XeF5+ avec des ions fluorure F− pontants.
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) E. H. Appelman, « Hydrolysis of Xenon Hexafluoride and the Aqueous Solution Chemistry of Xenon », Journal of the American Chemical Society, vol. 86, no 11, , p. 2141–2148 (DOI 10.1021/ja01065a009)
- Holleman, A. F.; Wiberg, E. « Inorganic Chemistry » Academic Press: San Diego, 2001. (ISBN 0-12-352651-5).
- (en) Konrad Seppelt, « Recent Developments in the Chemistry of Some Electronegative Elements », Accounts of Chemical Research, vol. 12, no 6, , p. 211–216 (DOI 10.1021/ar50138a004)
- (en) Sevim Hoyer, Thomas Emmler et Konrad Seppelt, « The structure of xenon hexafluoride in the solid state », Journal of Fluorine Chemistry, vol. 127, no 10, , p. 1415-1422 (DOI 10.1016/j.jfluchem.2006.04.014, lire en ligne)