Chlorochromate de pyridinium
Le chlorochromate de pyridinium, souvent abrégé en PCC, est un réactif rougeâtre utilisé pour oxyder les alcools primaires en aldéhydes et les alcools secondaires en cétones. Contrairement aux oxydations de Jones, trioxyde de chrome dans l'acide sulfurique, il n'oxyde pas jusqu'à l'acide carboxylique. Ce produit a été développé par Elias James Corey et William Suggs en 1975. Son principal inconvénient est sa toxicité.
| Chlorochromate de pyridinium | |
| |
| Identification | |
|---|---|
| Nom UICPA | chlorochromate de pyridinium |
| Synonymes |
PCC |
| No CAS | |
| No ECHA | 100.043.253 |
| No CE | 247-595-5 |
| Apparence | poudre cristalline orange |
| Propriétés chimiques | |
| Formule | C5H6ClCrNO3 [Isomères] |
| Masse molaire[1] | 215,555 ± 0,008 g/mol C 27,86 %, H 2,81 %, Cl 16,45 %, Cr 24,12 %, N 6,5 %, O 22,27 %, |
| Propriétés physiques | |
| T° fusion | 205 °C |
| T° ébullition | 346 à 348 °C |
| Solubilité | dichlorométhane, benzène, diéthyl éther, acétone, acétonitrile, THF |
| Unités du SI et CNTP, sauf indication contraire. | |
Préparation
La préparation originale de Corey consistait à ajouter un équivalent de pyridine à une solution d'un équivalent de trioxyde de chrome et d'acide chlorhydrique concentré.
- C5H5N + HCl + CrO3 → [C5H5NH][CrO3Cl]
Agarwal et al. a proposé une synthèse alternative qui évite le chlorure de chromyle (CrO2Cl2), produit secondaire dangereux.
- [C5H5NH+]Cl− + CrO3 → [C5H5NH][CrO3Cl]
Propriétés et utilisations
Le PCC est principalement utilisé comme oxydant. Il est particulièrement efficace pour oxyder les alcools primaires et secondaires respectivement en aldéhydes et cétones. Il conduit rarement à une suroxydation et ne produit donc pas d'acides carboxyliques.
Une oxydation typique au PCC consiste par exemple en l'addition d'un alcool à une suspension de PCC dans le dichlorométhane.
- 2 C5H5NHCrO3Cl + 3 R2CHOH → 2 C5H5NHCl + "CrO1.5" + 3 R2C=O + 3 H2O
En pratique, les sous-produits chromés se déposent avec la pyridine sous forme de résidu collant qui peut gêner la suite de la manipulation. Dès lors, on peut ajouter un adsorbant broyé qui va collecter les résidus et faciliter leur élimination. Un traitement typique de fin de réaction est une filtration sur silicate de magnésium (florosil).
Une autre réaction notable du PCC est la cyclisation cationique oxydante, c'est-à-dire la conversion d'alcools insaturés ou d'aldéhydes en cyclohexènones.

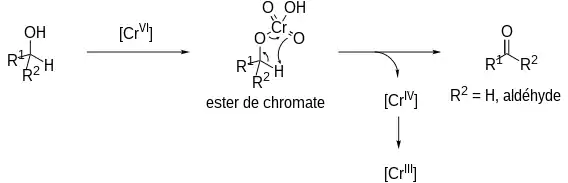
Mécanisme
Comme pour la plupart des oxydations d'alcools basées sur un réactif de chrome(VI), la réaction passe par un ester de chromate qui se réarrange afin de donner un carbonyle et une espèce de chrome(IV). Le chrome(IV) est instable et finit par donner une espèce de chrome(III)[2].
Oxydation des alcools allyliques tertiaires
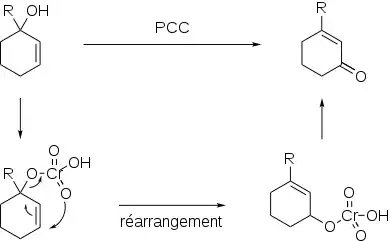
Le PCC peut aussi oxyder les alcools allyliques tertiaires ènones. Dans ce cas, l'ester de chromate intermédiaire ne possède pas d'atome d'hydrogène en position α. Il évolue selon un processus de réarrangement sigmatropique afin de donner un nouvel ester de chromate qui lui en possède un et mène à une ènone après oxydation[3]. Les rendements sont particulièrement bons pour la synthèse d'énones cycliques. L'alcool allylique de départ peut provenir de la réaction entre une ènone et un organolithium, R-Li. Il s'agit d'un moyen efficace de synthétiser des ènones fonctionnalisées en position 4.
Problèmes de sécurité
Le PCC pose problème car il contient du chrome hexavalent. Des oxydations basées sur le diméthylsulfoxyde ou sur l'iode hypervalent sont donc employées plus volontiers par les "chimistes verts".
Références
- Agarwal, S, Tiwari, H. P., Sharma, J. P., 'Pyridinium Chlorochromate: an Improved Method for its Synthesis and use of Anhydrous acetic acid as catalyst for oxidation reactions', Tetrahedron (journal) 1990, 46, 4417-4420.
- Corey, E.J., and Suggs, W. 'Pyridinium Chlorochromate. An Efficient Reagent for Oxidation of Primary and Secondary Alcohols to Carbonyl Compounds', Tetrahedron Lett. 1975, 16, 2647-2650.
- Paquette, L. A.; Earle, M. J.; Smith, G. F. Organic Syntheses, Coll. Vol. 9, p. 132 (1998); Vol. 73, p. 36 (1996). (Article)
- Piancatelli, G. 'Pyridinium Chlorochromate', Encyclopedia of Reagents for Organic Synthesis 2001. (Article)
- Tu, Y.; Frohn, M.; Wang, Z.-X.; Shi, Y. Organic Syntheses, Vol. 80, p. 1 (2003). (Article)
- White, J. D.; Grether, U. M.; Lee, C.-S. Organic Syntheses, Vol. 82, p. 108 (2005). (Article)
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Jonathan Clayden et Stuart G. Warren, Organic chemistry, Oxford University Press, (ISBN 978-0-19-927029-3, 0-19-927029-5 et 0-19-166621-1, OCLC 761379371, lire en ligne)
- William G. Dauben et Drake M. Michno, « Direct oxidation of tertiary allylic alcohols. A simple and effective method for alkylative carbonyl transposition », The Journal of Organic Chemistry, vol. 42, no 4, , p. 682–685 (ISSN 0022-3263, DOI 10.1021/jo00424a023, lire en ligne, consulté le )