Ose
Un ose[1] (ou monosaccharide) est un monomère de glucide. Les oses possèdent au moins trois atomes de carbone : ce sont des polyhydroxyaldéhydes ou des polyhydroxycétones[2]. Les monosaccharides ne sont pas hydrolysables, mais les polysaccharides sont très solubles dans l'eau et possèdent généralement un pouvoir sucrant. On les distingue par la longueur de leur chaîne carbonée, comme suit :
- les trioses : oses à 3 carbones, C3H6O3 (glycéraldéhyde, dihydroxyacétone) ;
- les tétroses : oses à 4 carbones, C4H8O4 (érythrose, thréose, érythrulose) ;
- les pentoses : oses à 5 carbones, C5H10O5 (désoxyribose (C5H10O4), ribose, arabinose, xylose, lyxose, ribulose, xylulose) ;
- les hexoses : oses à 6 carbones, C6H12O6 (allose, altrose, galactose, glucose, gulose, idose, mannose, talose, fructose, psicose, sorbose, tagatose) ;
- les désoxyhexoses : oses à 6 carbones, C6H12O5 (fucose, rhamnose) ;
- les heptoses : oses à 7 carbones, C7H14O7 (sédoheptulose, mannoheptulose) ;
- les octoses : oses à 8 carbones, C8H16O8 (heptahydroxyoctanal) ;
- les nonoses : oses à 9 carbones, C9H17N1O8 (acide neuraminique ou acide sialique).
Les oses peuvent être libres ou liés entre eux (oligosides et polyosides) ou liés à des protéines (glycoprotéines), ou encore à des lipides (glycolipides). Ils sont à l'origine du glycome (le patrimoine de sucres d'un organisme) et jouent un grand rôle au niveau cellulaire, tout particulièrement chez certaines bactéries (à Gram négatif notamment) dont les capsules protectrices sont constituées de polymères d'oses, plus souvent que de protéines.
Propriétés physiques et organoleptiques
Les oses ont une couleur blanchâtre.
Solubilité
L'abondance des groupes hydroxyle (OH) dans leur molécule confère aux oses une très grande solubilité dans l'eau.
Cristallisation
Les solutions aqueuses concentrés d'oses sont visqueuses, ce sont des sirops (la cristallisation est difficile). Celle-ci peut être facilitée par addition de solvants organiques (méthanol, éthanol, etc.) et à chaud (présence de chaleur) où les oses sont peu solubles.
Pouvoir rotatoire
Tous les oses ont un pouvoir rotatoire défini (à l'exception de celles possédant le groupe cétone comme le dihydroxyacétone), ce qui constitue un moyen d'identification par polarimétrie.
Propriétés organoleptiques
Quelques-uns ont une saveur agréable sucrée, mais il est faux de généraliser cette propriété car d'autres composés qui ne sont pas des oses, tels la glycine ou l'acide aspartique (duquel dérive l'édulcorant aspartame) par exemple, possèdent une saveur sucrée.
Structure
Formule brute
Cn(H2O)n où n est un nombre entier représentant le nombre de carbones (de trois à sept pour les oses naturels) pour de nombreux oses, cependant il ne faut pas généraliser cette propriété. Par exemple, l'acide acétique, qui n'est en aucun cas un ose possède la formule brute CH3COOH soit C2(H2O)2. D'autre part, des dérivés d'ose, comme la glucosamine (qui possède d'autres atomes que le carbone, l'hydrogène et l'oxygène ; en l'occurrence, l'azote) ne présentent pas la propriété énoncée ci-dessus valable pour de nombreux oses.
Il est possible de synthétiser à partir d'un ose de n carbones un autre ose de n+1 carbones (par ajout d'un groupe CH-OH en dessous du groupe aldéhyde ou cétone, à carbone asymétrique) : on effectue des réactions chimiques successives de Kiliani-Fischer (ou synthèse de l'acide cyanhydrique), réaction non stéréospécifique qui peut donc donner, à partir d'un même ose, deux oses différents.
Structure acyclique
Un ose à n carbones est composé d'une chaîne carbonée non ramifiée, de trois à sept carbones, ne comportant que des liaisons simples. Tous les carbones portent un groupe hydroxyle (OH) sauf un qui porte un groupe carbonyle.
Cela détermine deux catégories d'oses :
- aldose, si le groupe carbonyle est un groupe aldéhyde, il se trouve sur le premier carbone (par exemple le glucose) ;
- cétose, si le groupe carbonyle est un groupe cétone, il se trouve sur le second carbone (par exemple le fructose).
Hormis la dihydroxyacétone, tous les oses possèdent un pouvoir rotatoire du fait de la présence d'au moins un carbone asymétrique : les oses sont dits « chiraux ». S'il y a n atomes de carbone asymétriques, il existe 2n paires d'énantiomères, diastéréoisomères entre elles. Chaque paire a un nom différent et les descripteurs D et L sont traditionnellement utilisés pour différencier chaque énantiomère.

Deux énantiomères (antipodes optiques) ont les mêmes propriétés à l'exception d'une seule : leur pouvoir rotatoire opposé. La figure 1 représente les deux énantiomères du glucose, la forme D-glucose est la forme naturelle.
- Dans la forme D, le groupe hydroxyle (-OH) porté par le carbone n-1 est à droite (en représentation de Fischer).
- Dans la forme L, le groupe hydroxyle (-OH) porté par le carbone n-1 est à gauche (en représentation de Fischer).
La forme D ou L n'implique en rien le caractère dextrogyre ou lévogyre de la molécule. Ainsi le D-(+)-glucose est dextrogyre (+52°) et le D-(-)-fructose est fortement lévogyre (−92,4°).
La majorité des oses naturels sont de la forme D, mais il existe également des oses de la série L.
Structure cyclique
La projection de Haworth est souvent utilisée pour représenter la forme cyclique des oses.
Il y a hémiacétalisation entre le groupe carbonyle et un OH, dès lors qu'ils sont distants d'au moins trois carbones, (ex. : entre le carbone 1 et 5 du glucose ou entre le carbone 2 et 5 du fructose, ou encore entre le carbone 1 et 4 du ribose). Le OH né de la cyclisation est appelé OH anomérique ou anomère. Il donne lieu à un nouveau carbone asymétrique (le carbone porteur du groupe carbonyle : no 1 dans le cas d’un aldose ou no 2 dans le cas d’un cétose) et selon qu'il est placé sous ou sur le plan du cycle il donne naissance à deux isomères alpha (α) ou bêta (β) (alpha signifiant en dessous, et bêta au-dessus pour la série D ; c'est l'inverse pour la série L), la forme bêta étant plus stable que la forme alpha.
Une fois la chaîne carbonée repliée, la proximité de la double liaison du groupe aldéhyde (ou cétone s’il s'agissait d’un cétose) permet, du fait de sa fragilité, la rupture de la liaison P et de la liaison OH du groupe hydroxyle (ici du C no 5), permettant l’établissement d’une nouvelle liaison C no 1 et O de l’ancien groupe hydroxyle du C no 5, fermant ainsi un cycle.
Cycle sous forme furanique
Les oses se cyclisant généralement sous forme furanique (furane) sont :
- le ribose donnant du ribofuranose ;
- le 2-désoxyribose donnant du 2-désoxyribofuranose.
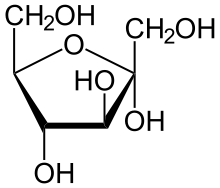
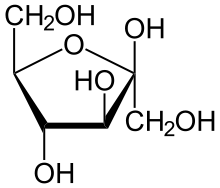
Cycle sous forme pyranique
Les oses se cyclisant généralement sous forme pyranique (pyrane) sont :
Le mécanisme le plus commun de cyclisation est un mécanisme d'hémiacétalisation pour les aldoses et hémicétalisation pour les cétoses. L'oxygène qui va se positionner à l'intérieur du cycle est celui du groupe hydroxyle qui détermine la série L ou D (donc porté par C5 pour les pyranoses ou C4 pour les furanoses). L'oxygène du groupe carbonyle donnera le OH porté par C1.
Mécanisme[3] :
- Le groupe carbonyle capte un proton du solvant ;
- Attaque nucléophile sur C1 par le OH qui détermine la série L ou D ;
- Le O intracyclique perd son proton.
En série D, les formes bêta ont toujours leur groupe hémiacétalique (OH en 1, qui n'est pas un hydroxyle) vers le haut sous la représentation de Haworth ; de même, les formes alpha portent le OH vers le bas.
Nomenclature
Ils peuvent se présenter sous forme cristalline. Les oses sont de deux types :
- si le groupe carbonyle de l'ose est un aldéhyde, c'est un aldose ;
- si ce groupe est une cétone, c'est un cétose (ou cétulose).
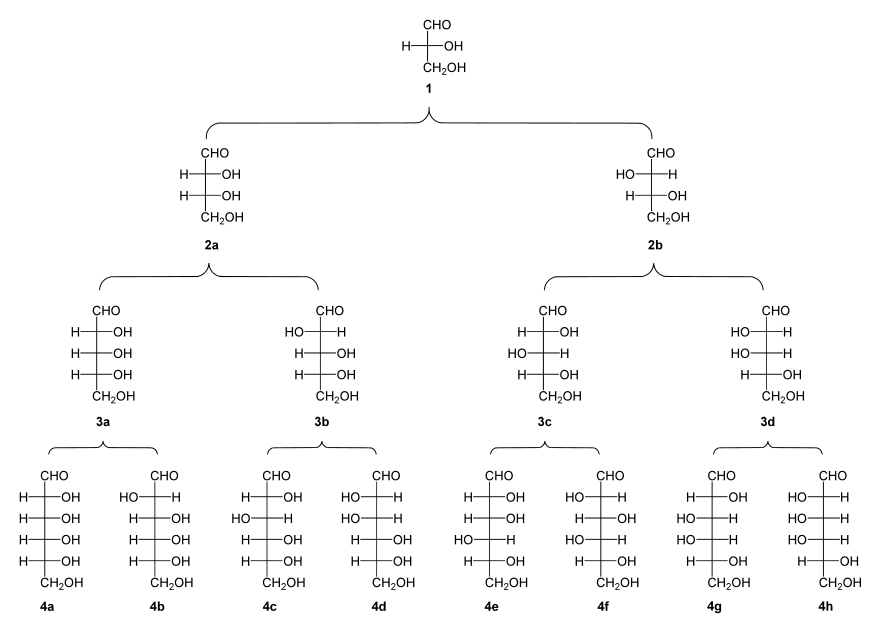
* Triose : (1) D-(+)-glycéraldéhyde ;
* Tétroses : (2a) D-(−)-érythrose ; (2b) D-(−)-thréose ;
* Pentoses : (3a) D-(−)-ribose ; (3b) D-(−)-arabinose ; (3c) D-(+)-xylose ; (3d) D-(−)-lyxose ;
* Hexoses : (4a) D-(+)-allose ; (4b) D-(+)-altrose ; (4c) D-(+)-glucose ; (4d) D-(+)-mannose ; (4e) D-(−)-gulose ; (4f) D-(−)-idose ; (4g) D-(+)-galactose ; (4h) D-(+)-talose.
Exemples d'oses remarquables :
Trioses
- Aldotriose
- D- et L-glycéraldéhyde
- (Cétotriose)
Hexoses
- Dérivés ayant un rôle physiologique
- D-glucuronate (6-carboxy-D-glucose)
- D-galacturonate (6-carboxy-D-galactose)
- N-acétyl-D-glucosamine
- D-glucosamine
- N-acétyl-D-galactosamine
- D- et parfois L-fucose (6-désoxy-D- et -L-galactose)
- L-rhamnose (6-désoxy-L-mannose)
- D-quinovose (6-désoxy-D-glucose)
- Cétohexose
- D-fructose
Dérivés
Polyalcools
Les polyalcools (ou polyols), sont obtenus par réduction du groupe aldéhyde en hydroxyle, c'est le cas par exemple du glycérol.
Osamines
Dans les osamines, le groupe hydroxyle (–OH) en C2 est remplacé par –NH2. On peut également lui rajouter un groupe acétyl.
Désoxyoses ou désoses
Les désoxyoses sont créés par substitution d'hydrogène en remplacement du groupe hydroxyle, on peut noter l'exemple du désoxyribose.
Acides aldoniques
Ils sont formés par une oxydation dite « douce ». (Exemples d'oxydants doux : le réactif de Tollens ou la liqueur de Fehling) des aldoses et sont caractérisés par l'oxydation du groupe aldéhyde en groupe carboxyle. Exemple : acide gluconique.
Acides uroniques
Les acides uroniques sont des aldohexoses dont un groupe acide carboxylique (-COOH) remplace le groupe alcool primaire (-CH2OH, OH du C6) par oxydation. Exemple : acide glucuronique.
Oses complexes
On distingue l'acide neuraminique et l'acide muramique. L'acide neuraminique est un dérivé de cétose à 9 atomes de carbone résultant d'une crotonisation d'acide pyruvique et de la D-mannosamine. L'acide muramique est formé de la N-acétyl-glucosamine, de l'acide lactique et de la D-alanine.
Acides aldariques
Les acides aldariques sont formés par oxydation du groupe aldéhyde en groupe carboxylique et l'oxydation du groupe alcool primaire en fin de chaîne en groupe carboxylique. Pour réaliser cette réaction, il faut un oxydant puissant car le groupe alcool primaire est plus difficile à oxyder que le groupe aldéhyde.
Notes et références
- « 08.01.Q03 : Les sucres, saccharides, glucides, hydrate de carbone, oses… De quoi parle-t-on ? - Académie d'Agriculture de France », sur academie-agriculture.fr (consulté le ).
- (en) Nomenclature of carbohydrates, sur qmul.ac.uk.
- « animation mécanisme cyclisation du glucose »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?)
Voir aussi
Articles connexes
Liens externes
- Cours sur les glucides [PDF], sur sites.univ-provence.fr
- (en) Nomenclature des sucres, sur chem.qmul.ac.uk
