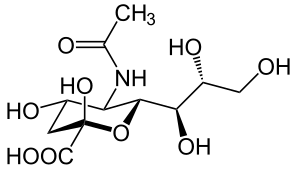
Acide sialique
Acide sialique (du grec τὸ σίαλον (to sialon) « la salive ») est un terme générique désignant une famille de plus de 50 dérivés de l'acide neuraminique, un sucre (ose) acide à squelette de neuf atomes de carbone[2]. C'est aussi le nom du membre le plus commun de ce groupe, l'acide N-acétylneuraminique (Neu5Ac ou NANA), provenant de la condensation de l'acide pyruvique et du N-Acétyl-D-mannosamine.
Ces molécules sont communément présentes chez les organismes vivants (animaux et bactéries, levures et champignons, et plus rarement chez les plantes)[2], principalement dans les glycoprotéines et les gangliosides. Toutes leurs fonctions ne sont probablement pas encore connues. L'acide N-acétylneuraminique est un constituant caractéristique des sucres aminés jouant un rôle important dans les interactions inter-cellulaires, dont chez l'Homme. Le cerveau en contient le plus ; il y joue un rôle dans la transmission neuronale et la structure des gangliosides dans la synaptogenèse[3].
Histoire
L'expression « acide sialique » (du grec pour la salive, σίαλον - síalon) a été introduit pour la première fois par le biochimiste suédois Gunnar Blix en 1952.
Biochimie
- Les lectines produites par de nombreuses espèces ont une affinité pour différents sucres[4], dont pour l'acide sialique, avec des interactions importantes pour divers systèmes et en cause dans certains processus pathologiques[5].
C'est souvent grâce à des lectines que les pathogènes tels que virus, bactéries, champignons ou parasites eucaryotes, identifient[4] et ciblent certains sucres spécifiques de la surface des cellules hôte qu'ils peuvent infecter[6] - [7] - [8].
Les SIGLEC, ou lectines de type I sont une famille de lectines reconnaissant spécifiquement l’acide sialique[9]. Elles appartiennent à la superfamille des immunoglobulines (Ig) et se replient de la même manière que les immunoglobulines. - Ces affinités lectines-sucres permettent aussi à des pathogènes d'adhérer aux tissus richement glycosylés présents dans les voies respiratoires, le tube digestif, l'appareil urinaire ou génital (Imberty and Varrot 2008, Sharon 1996). C'est ainsi par exemple que le virus de la grippe se fixe sur la muqueuse pulmonaire, en ciblant l'acide sialique ; dans ce cas, la lectine est l'hémagglutinine virale et le sucre est un acide sialique (acide 5-N-acétylneuraminique).
- Certaines toxines bactériennes sont également des lectines[10].
- Dans certains organes, le taux d'acide sialique est contrôlé par le système hormonal ; ainsi l'administration d'œstrogènes à des souris castrées entraîne une réduction dose-dépendante de la teneur en acide sialique du vagin. Inversement, la teneur en acide sialique du vagin de souris est une mesure de la puissance des œstrogènes. Les substances de référence sont l'estradiol pour l'application sous-cutanée et l'éthinylestradiol pour l'administration orale[11].
Définition
L'expression acide sialique peut désigner :
- L'acide N-acétylneuraminique (NeuNAc ou NANA), que l'on rencontre chez l'être humain ;
- Plus de 50 molécules apparentées à l'acide N-acétylneuraminique, par exemple l'acide N-glycosylneuraminique que l'on trouve chez les souris ou l'acide N-glycolylneuraminique, toutes peuvent être dérivés de l'acide neuraminique par substitution d'un de ses groupes hydroxyle par un groupe groupe amino )[12]. Le groupe amino porte généralement soit un groupe acétyle, soit un groupe glycolyle, mais d'autres modifications ont été décrites, qui sont spécifiques au tissu et régulées par le développement (certaines ne se trouvent que sur certains types de glycoconjugués dans des cellules spécifiques)[13]. Les substituants hydroxyle peuvent varier considérablement (groupes acétyle, lactyle, méthyle, sulfate et phosphate...)[14].
Fonctions
Elles ne sont probablement pas toutes connue, mais on sait que :
- l'acide sialique protège les protéines de leur dégradation par les protéases ;
- associé aux glycoprotéines, c'est un constituant des gangliosides et des glycolipides ; ce pourquoi il est présent dans les sécrétions glandulaires (lait y compris), les membranes cellulaires et le plasma sanguin (neuraminidase) ;
- il est présent dans le lait maternel (notamment sous forme de glycoconjugués et glycanes libres, et à une concentration qui évolue rapidement). Il semble répondre à des besoins élevés du nouveau-né juste après la naissance. A l'autre extrémité de la vie, chez la personne âgée, la sialylation diminue dans les gangliosides du cerveau[15] - [16] - [17], dans les protéines salivaires[18] et dans les cellules immunitaires[19] (ce qui a fait suggérer que l'acide sialique pourrait être un complément alimentaire utile à cet âge)[20] ;
- il limite les risques d'infections (mucus associé aux membranes muqueuses : bouche, nez, tractus gastro-intestinal, tractus respiratoire) ;
- il contribue aux mucus ou substances mucilagineuses qui jouent un rôle protecteur et/ou fonctionnel chez de nombreuses espèces ; il est présent dans les mucus humains ; et « chez les Mammifères, de nombreux travaux ont montré la corrélation nette entre mucification et teneur en acide sialique, relation vérifiée dans les cellules à mucus de divers poissons et cyclostomes », par exemple chez l'anguille qui présente une peau particulièrement gluante[21] - [22] mais l'acide sialique est aussi présent à haute concentration dans les cellules à mucus de la peau d'espèces telles que la limace, l'escargot, et dans leur mucus.
La charge négative de cette substance est responsable de la sensation plus ou moins visqueuse de la salive, des mucus, des larmes[23], du fluide vaginal[24] et du sperme[25] - [26] et des mucines enrobant les organes corporels. Le mucus joue aussi un rôle l'osmorégulation ; - l'acide sialique joue aussi un rôle dans certains processus apoptotiques (de « suicide cellulaire ») ; quand une cellule meurt, elle perd ses connexions intercellulaires et se transforme en corps apoptotiques qui doit être repéré par des globules blanc qui vont la digérer par phagocytose ; le clivage des acides sialiques terminaux et l'exposition de saccharides sub-terminaux qui se produisent à la mort de la cellule comptent parmi les signaux permettant aux macrophages de repérer ce cadavre cellulaire[27] ;
- de nombreuses bactéries pathogènes utilisent l'acide sialique dans leurs surface cellulaire comme dans leur lipopolysaccharide, ce qui les aide à échapper à la réponse immunitaire innée de l'hôte ; ces bactéries camouflées font presque toutes partie de celles qui ont co-évolué avec des hôtes qui sont des animaux dits supérieurs (deutérostomes)[28] ;
- dans la paroi cellulaire de la bactérie Escherichia coli, il est un maillon de l'acide colominique, un polysaccharide qui est un polymère de l'acide N-acétylneuraminique ;
- la bactérie Tannerella forsythia, pathogène buccal très fréquemment impliqué dans les parodontites, utilise l'acide sialique pour produire ses biofilms (ainsi que deux fragment de sucre : l'acide glycolylsialique et le sialyllactose qu'elle produit grâce à un enzyme, la sialidase, qui peut être inhibée par un médicament, l'oseltamivir).
Un locus lui permettant d'utiliser l'acide sialique de son hôte a été trouvé dans le génome de cette bactérie (gènes TF0033-TF0034 qui codent également pour une perméation d'acide sialique (NanT) de la membrane interne putative, ainsi que pour un système de transport d'acide sialique membranaire extérieur. L'acide sialique peut donc être l'unique source de carbone et d'énergie, voire un facteur de croissance clé pour certaines bactéries pathogènes[29]. Le vibrion du choléra fait partie des pathogènes qui tirent avantage de cette capacité[30] ; - l'acide sialique est aussi une nourriture (source de sucres et de carbone) possible pour certains pathogènes qui semblent avoir coévolué avec des animaux ; ainsi, Cronobacter sakazakii qui coévolue depuis 15 à 23 millions d'années avec ses hôtes vertébrés, mammifères notamment. Ceci explique des facteurs de virulence rendant cette bactérie parfois mortelle pour le nouveau-nés qui reçoit de l'acide sialique du lait maternel (ou du lait maternisé), de laits animaux (oligosaccharides), et dont les mucines qui tapissent son intestin et les gangliosides de son cerveau produisent aussi des acides sialiques ; le pathogène peut franchir les barrières intestinales et hémato-encéphalique.
C'est le cas pour streptocoques viridans, souvent sources de maladies extra-orales (attaque du cœur, du cerveau...) ; cet acide est « susceptible de jouer un rôle dans la persistance et la survie de ces organismes infectieux in vivo »[31] ; - c'est un récepteur pour certains virus (Influenza notamment) qui s'y attachent pour infecter les cellules, muqueuses notamment (1re étape de l'infection grippale). Un exemple illustrant son importance est que le zanamivir et l'oseltamivir, deux inhibiteurs de la neuraminidase sont utilisés comme principes actifs contre le virus Influenza, responsable de la grippe. En effet, l'acide sialique est la cible moléculaire du virus ; il lui permet de s'ancrer aux cellules qu'il va infecter. Les neuraminidases sont des enzymes glycoprotéine antigéniques trouvées à la surface des virus de la grippe, ce sont elle qui permettent au virus de se fixer, mais aussi d'être plus mobile dans le mucus respiratoire, ou encore de faciliter l'élution des virions au sein des cellules infectées[32] - [33].
De même pour certaines bactéries responsables de surinfections pulmonaires, telle que le pneumocoque (Streptococcus pneumoniae), cause majeure de pneumonie mais aussi responsable de méningite ; ces bactérie ne trouvent pas ou peu de sucres libres dans la trachée ou le poumon, mais semblent pouvoir dégrader les acides sialiques pour les transformer en sucre et s'en nourrir[34] ; - des sialoglycoprotéines (glycoprotéines riches en acide sialique) se lient à la sélectine chez l'homme et d'autres organismes. Les cellules cancéreuses métastatiques expriment souvent une densité anormalement élevée de ces sialoglycoprotéines. Cette surexpression d'acide sialique à la surfaces des cellules concernées y crée une charge négative. Cette charge est source d'une répulsion entre cellules cancéreuses, répulsion qui les aide à pénétrer dans la circulation sanguine étendant ainsi le processus de métastase[35].
Note : Les plantes sont réputées en contenir peu, mais l'acide neuraminique est un constituant de glycoprotéines végétales qui contiennent un résidu d'acide sialique terminal dans une chaîne glycannique[36].
Voir aussi
Bibliographie
- Gerlach, D., Wagner, M., Schlott, B., Zahringer, U. and Schmidt, K.H. (2002) Chemical and physicochemical characterization of the sialic acid-specific lectin from Cepaea hortensis. FEMS Microbiol Lett, 214, 61-68.
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- « Essentials of glycobiology », Biochemistry, Cold Spring Harbor Laboratory Press, (ISBN 978-0-87969-770-9, lire en ligne, consulté le )
- B. Wang et J. Brand-Miller, « The role and potential of sialic acid in human nutrition », European Journal of Clinical Nutrition, vol. 57, no 11, , p. 1351–1369 (ISSN 0954-3007, PMID 14576748, DOI 10.1038/sj.ejcn.1601704, lire en ligne, consulté le )
- Lis, H. & Sharon, N. (1998). Lectins: Carbohydrate-specific proteins that mediate cellular recognition. Chem. Rev. 98, 637-674.
- Sharon N (1996) Carbohydrate-lectin interactions in infectious disease. Advances in Experimental Medicine and Biology, 408, 1-8.
- Imberty, A., Mitchell, E.P. and Wimmerová, M. (2005) Structural basis for high affinity glycan recognition by bacterial and fungal lectins. Curr. Opin. Struct. Biol., 15, 525 - 534.
- Imberty, A. and Varrot, A. (2008) Microbial recognition of human cell surface glycoconjugates. Curr. Opin. Struct. Biol., 18, 567-576.
- Imberty, A., Wimmerova, M., Mitchell, E.P. and Gilboa-Garber, N. (2004) Structures of the lectins from Pseudomonas aeruginosa: Insights into molecular basis for host glycan recognition. Microb. Infect., 6, 222-229.
- Crocker, P.R. (2002) Siglecs: sialic-acid-binding immunoglobulin-like lectins in cell-cell interactions and signalling. Curr. Opin. Struct. Biol., 12, 609-615.
- Karoline SABÓIA ARAGÃO Thèse (Biologie structurale et nanobiologie) présentée le 5 décembre 2008 à l'université de Grenoble ; Études structure-fonction de lectines (DiscI et DiscII) de Dictyostelium discoideum.
- (en) Matthias Bohnet, Ullmann's encyclopedia of industrial chemistry, Wiley-VCH, (ISBN 978-3-527-30673-2, lire en ligne)
- (en) Ajit Varki, Essentials of glycobiology, Cold Spring Harbor Laboratory Press, (ISBN 978-0-87969-770-9, lire en ligne)
- C. Mandal et C. Mandal, « Sialic acid binding lectins », Experientia, vol. 46, no 5, , p. 433–441 (ISSN 0014-4754, PMID 2189746, DOI 10.1007/bf01954221, lire en ligne, consulté le )
- R. Schauer, « Achievements and challenges of sialic acid research », Glycoconjugate Journal, vol. 17, nos 7-9, , p. 485–499 (ISSN 0282-0080, PMID 11421344, DOI 10.1023/a:1011062223612, lire en ligne, consulté le )
- Segler-Stahl K, Webster JC, Brunngraber EG. Changes in the concen- tration and composition of human brain gangliosides with aging. Ger- ontology. 1983;29:161–8.
- Kracun I, Rosner H, Drnovsek V, Heffer-Lauc M, Cosovic C, Lauc G. Human brain gangliosides in development, aging and disease. Int J Dev Biol. 1991;35:289–95.
- Svennerholm L, Bostrom K, Helander CG, Jungbjer B. Membrane lipids in the aging human brain. J Neurochem. 1991;56:2051–9
- Salvolini E, Mazzanti L, Martarelli D, Di Giorgio R, Fratto G, Curatola G. Changes in the composition of human unstimulated whole saliva with age. Aging (Milano). 1999;11:119–22.
- Garcia GG, Berger SB, Sadighi Akha AA, Miller RA. Age-associated changes in glycosylation of CD43 and CD45 on mouse CD4 T cells. Eur J Immunol. 2005;35:622–31.
- (en) Norbert Sprenger et Peter I. Duncan, « Sialic Acid Utilization », Advances in Nutrition, vol. 3, no 3, , p. 392S–397S (ISSN 2161-8313 et 2156-5376, PMID 22585917, PMCID PMC3649475, DOI 10.3945/an.111.001479, lire en ligne, consulté le )
- Bolognani-Fantin A.M & Bolognani L (1964) Observations on the histochemistry and biochemistry of the cutaneous mucus of Anguilla vulgaris. Internat. Kongr. Histo- und Cytochemie, Frankfurt/Main, p. 183-184 -
- A. M. Lemoine et M. Olivereau, « Présence d'acide N-acétyl-neuraminique dans la peau d'Anguilla anguilla L. », Zeitschrift für vergleichende Physiologie, vol. 73, no 1, , p. 22–33 (ISSN 1432-1351, DOI 10.1007/BF00297699, lire en ligne, consulté le )
- J. A Cabezas, J. V Porto, M. D Frois et C Marino, « Acide sialique dans les larmes humaines », Biochimica et Biophysica Acta (BBA) - Specialized Section on Mucoproteins and Mucopolysaccharides, vol. 83, no 3, , p. 318–325 (ISSN 0926-6526, DOI 10.1016/0926-6526(64)90009-6, lire en ligne, consulté le )
- Carlborg L (1969) Action of diethylstilboestrol on mouse vaginal sialic acids. I. Acta endocr. (Kbh.) 62, 657–662
- Peyre A & Laporte P (1966) Etude des acides sialiques épididymaires chez le rat impubère et adulte. C.R. Acad. Sci. (Paris), Sér. D 263, 1872–1875.
- (en-US) M. Rajalakshmi et M. R. N. Prasad, « Changes in sialic acid in the tests and epididymis ot the rat during the onset of puberty », Journal of Endocrinology, vol. 44, no 3, , p. 379–385 (ISSN 0022-0795 et 1479-6805, DOI 10.1677/joe.0.0440379, lire en ligne, consulté le )
- R. Levy, « Apoptose au cours de la spermatogenèse et dans le sperme éjaculé », Andrologie, vol. 9, no 4, , p. 449–458 (ISSN 1760-5377, DOI 10.1007/BF03034661, lire en ligne, consulté le )
- Emmanuele Severi, Derek W. Hood et Gavin H. Thomas, « Sialic acid utilization by bacterial pathogens », Microbiology (Reading, England), vol. 153, no Pt 9, , p. 2817–2822 (ISSN 1350-0872, PMID 17768226, DOI 10.1099/mic.0.2007/009480-0, lire en ligne, consulté le )
- (en) S. Roy, C. W. I. Douglas et G. P. Stafford, « A Novel Sialic Acid Utilization and Uptake System in the Periodontal Pathogen Tannerella forsythia », Journal of Bacteriology, vol. 192, no 9, , p. 2285–2293 (ISSN 0021-9193, DOI 10.1128/JB.00079-10, lire en ligne, consulté le )
- (en) S. Almagro-Moreno et E. F. Boyd, « Sialic Acid Catabolism Confers a Competitive Advantage to Pathogenic Vibrio cholerae in the Mouse Intestine », Infection and Immunity, vol. 77, no 9, , p. 3807–3816 (ISSN 0019-9567, PMID 19564383, PMCID PMC2738016, DOI 10.1128/IAI.00279-09, lire en ligne, consulté le )
- (en-US) H.L. Byers, K.A. Homer et D. Beighton, « Utilization of Sialic Acid by Viridans Streptococci », Journal of Dental Research, vol. 75, no 8, , p. 1564–1571 (ISSN 0022-0345 et 1544-0591, DOI 10.1177/00220345960750080701, lire en ligne, consulté le )
- (en) Peter Palese, Kiyotake Tobita et Masahiro Ueda, « Characterization of temperature sensitive influenza virus mutants defective in neuraminidase », Virology, vol. 61, no 2, , p. 397-410 (PMID 4472498, DOI 10.1016/0042-6822(74)90276-1, lire en ligne)
- (en) C. Liu, M. C. Eichelberger, R. W. Compans et G. M. Air, « Influenza type A virus neuraminidase does not play a role in viral entry, replication, assembly, or budding », Journal of Virology, vol. 69, no 2, , p. 1099-1106 (PMID 7815489, PMCID 188682, lire en ligne)
- (en) Carolyn Marion, Amanda M. Burnaugh, Shireen A. Woodiga et Samantha J. King, « Sialic Acid Transport Contributes to Pneumococcal Colonization », Infection and Immunity, vol. 79, no 3, , p. 1262–1269 (ISSN 0019-9567 et 1098-5522, PMID 21189320, PMCID PMC3067482, DOI 10.1128/IAI.00832-10, lire en ligne, consulté le )
- Mark M. Fuster et Jeffrey D. Esko, « The sweet and sour of cancer: glycans as novel therapeutic targets », Nature Reviews. Cancer, vol. 5, no 7, , p. 526–542 (ISSN 1474-175X, PMID 16069816, DOI 10.1038/nrc1649, lire en ligne, consulté le )
- Richard Bourbouze, Charbel Akiki, Isabelle Chardon-Loriaux et François Percheron, « Mise en évidence de dérivés de l'acide neuraminique dans des glycoprotéines végétales », Carbohydrate Research, vol. 106, no 1, , p. 21–30 (ISSN 0008-6215, DOI 10.1016/S0008-6215(00)80729-6, lire en ligne, consulté le )