Biofilm
Un biofilm est une communauté multicellulaire plus ou moins complexe, souvent symbiotique, de micro-organismes (bactéries, microchampignons, microalgues ou protozoaires), adhérant entre eux et à une surface, et marquée par la sécrétion d'une matrice adhésive et protectrice. Il se forme généralement dans l'eau ou en milieu aqueux[7].


.JPG.webp)




Antoni van Leeuwenhoek est le premier savant à observer en 1683 un biofilm naturel multispécifique, la plaque dentaire. C'est sur la base de l’observation de l’ultrastructure de cette plaque et de communautés microbiennes sessiles dans les torrents de montagne, que le microbiologiste John William (Bill) Costerton propose en 1978[8] la théorie des biofilms[9], et qu'il invente le terme de biofilm en 1987[10].
Le biofilm est une étape normale ou potentielle du cycle de vie de la plupart des bactéries[11], qui affichent alors un comportement coopératif[11] et produisent des phénotypes différenciés conduisant à des fonctions spécifiques, parfois en réaction à un stress.
Sa structure est hétérogène, souvent sous forme de colonie d'une ou plusieurs espèces de bactéries et d'une matrice extracellulaire composée de substances polymères. La définition d'un biofilm peut légèrement varier : certains auteurs choisissent par exemple d'exclure du terme « biofilm » les communautés bactériennes ne produisant pas leur propre matrice extracellulaire.
S'étant jusque-là principalement attachée à étudier les cellules pour elles-mêmes et indépendamment de leur milieu, la microbiologie intègre les récents développements de la notion d'interactions avec le milieu et se tourne maintenant vers les biotopes, et notamment les biofilms, surtout observés comme habitat d'écotone ou comme élément du réseau trophique[12].
Généralités
Le mode de vie en biofilm est l'un des deux modes de comportement des organismes unicellulaires – l'alternative étant la flottaison libre de type dit « planctonique », dans un médium liquide, fluide ou même solide. John William Costerton a proposé en 1978 le terme de biofilm en suggérant que ce serait le mode de vie naturel de la plupart des micro-organismes[13]. Cette proposition, qui s'appuyait initialement sur la comparaison du nombre de bactéries sous forme planctonique d'une part, et au sein de biofilms dans les cours d'eau[14] - [15] d'autre part, est désormais généralement admise par les microbiologistes.
Les biofilms sont, sauf exceptions, observés dans les milieux aqueux ou exposés à l'humidité. Ils peuvent se développer sur n'importe quel type de surface naturelle ou artificielle, qu'elle soit minérale (roche, interfaces air-liquide…) ou organique (peau, tube digestif des animaux, racines et feuilles des plantes), industrielle (canalisations, coques des navires) ou médicale (prothèses, cathéters)… Il est possible à un biofilm d'adhérer sur des matériaux « anti-adhésifs » comme le polytétrafluoroéthylène (ou téflon). Voir l'article sur les micro-organismes extrêmophiles pour la diversité étonnante de leurs habitats possibles dans les gammes de chaud, froid, pression, et autres extrêmes. Dans des conditions optimales de croissance, un biofilm peut rapidement devenir macroscopique, jusqu'à atteindre le mètre d'épaisseur si l'environnement le permet.
Hormis les cas où les bactéries se rassemblent sur une surface nutritive (bois immergé en décomposition par exemple), un biofilm n'est pas une parade à la pauvreté du milieu, mais plutôt à son agressivité envers les micro-organismes. Le biofilm croît d'ailleurs généralement d'autant plus rapidement que le milieu est riche en nutriments[16].
Nature homogène ou hétérogène des biofilms
Qu'ils croissent sur un substrat vivant ou inerte, les biofilms sont dits :
- homogènes quand ils sont composés d'une seule espèce ;
- hétérogènes quand plusieurs espèces sont associées. Dans ce dernier cas, le biofilm peut être également caractérisé par une hétérogénéité structurelle : en son sein coexistent des différentiations géographiquement marquées en termes de populations d'organismes mais aussi de gradients de pH, de teneur en oxygène, avec des structures évoquant parfois des pores, des canaux, des écailles, des couches, dures ou souples selon les cas ; au point de quelquefois presque évoquer une peau ou un superorganisme autonome ou symbiote de son hôte.
La biodiversité intrinsèque d'un biofilm permet des synergies bactériennes ou fongo-bactériennes qui améliorent sa résistance à certains facteurs de stress, dont les antibiotiques[17] (antibiorésistance).
Traces fossiles
Les biofilms ont sans doute constitué les premières colonies d'organismes vivants, il y a plus de 3,5 milliards d'années. Avec les stromatolithes, ils semblent à l'origine des premières roches biogéniques et structures récifales, bien avant l'apparition des coraux.
Les voiles algaux que l'on trouve encore sur certains sédiments exondés, certains sols humides ou certaines plages ou rivages d'eau douce pourraient aussi être à l'origine de processus de fossilisation d'êtres vivants au corps mou, et aussi de traces (humaines, de dinosaures[18] ou de microreliefs…) sur un substrat mou. Ils sont étudiés et de mieux en mieux pris en compte par la taphonomie[19]. Il en est de même pour les voiles microbiens[20].
Certains biofilms encroutant sont capables de croître sur eux-mêmes ou plutôt sur les lamines générées par les générations précédentes de bactéries. Ils semblent, toujours avec les stromatolithes, à l'origine du premier puits de carbone majeur, il y a plus de 3 milliards d'années.
L'environnement particulier du biofilm permet aux cellules de (ou les force à) coopérer et agir les unes avec les autres de manière différente de ce qu'elles feraient en environnement libre. Les bactéries vivant dans un biofilm ont des propriétés sensiblement différentes de celles des bactéries « flottantes » de la même espèce, qui peut faire penser comme dans le cas des stromatolithes à des propriétés émergentes de superorganismes.
La promiscuité des bactéries dans le biofilm favorise aussi probablement le transfert horizontal de gènes de bactérie à bactérie de la même famille, ou à d'autres genres et familles.
Composition, propriétés, fonctions

Les biofilms naturels sont surtout composés d'algues et de bactéries pour les surfaces éclairées ou exondées, mais ils sont quasi exclusivement constitués de bactéries (dont photosynthétiques) et de champignons au sein du biofilm qui colonise les sédiments ainsi que les feuilles ou les bois immergés[22]. Leur biodiversité intrinsèque peut être mesurée par des méthodes moléculaires et métagénomiques tels que l'empreinte génétique par PCR-DGGR (électrophorèse en gradient de gel dénaturant)[23].
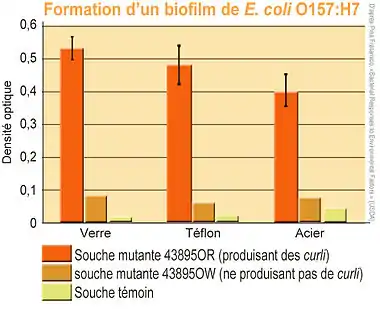
Les espèces les mieux étudiées (parce que certaines souches en sont très pathogènes) sont Escherichia coli et Salmonella enterica. Des souches chlororésistantes et capables de produire des biofilms sur des substrats lisses (inox ou verre) et même antiadhésif (Téflon) présentant des similitudes ont été trouvées et cultivées pour ces deux espèces[24]. Ainsi le sérovar de salmonelle Typhimurium - souche 43895OR, et les souches les plus résistantes de E.coli (ex. : E.coli 43895OR) produisent toutes les deux des colonies bactériennes solidement consolidées par une matrice extracellulaire contenant des fibres de type curli (et cellulose dans le cas de la salmonelle), que ce soit en culture sur de l'agar-agar, ou sur un substrat très lisse.
Dans tous les cas, les souches ayant formé des biofilms développent une résistance statistiquement plus élevée (P <0,05) que les cultures planctoniques des mêmes souches, face au peroxyde d'hydrogène, au chlore ou à des désinfectants à base d'ammonium quaternaire[24].
À la différence de E. coli, les Salmonelles semblent aussi capables de produire de la cellulose pour consolider leur biofilm[24].
Le biofilm formé par d'autres espèces, n'étant pas connu comme pathogénes pour l'humain, est aussi très étudié comme celui produit par la bactérie Myxococcus xanthus. Les études dans ce cas-ci, se concentrent sur l'étude des mécanismes amenant à la formation de ces biofilms comme le pilus du type IV[25],les polysaccharides[26] ou les systémes de régulations de ces systémes.
- Composition
Presque tous les micro-organismes ou certaines de leurs souches, éventuellement mutantes, ont développé des mécanismes d'adhérence aux surfaces et/ou les uns aux autres et/ou avec les cellules symbiotes, et/ou avec des cellules qu'ils doivent infecter pour survivre.
Ils peuvent s'intégrer à un biofilm en formation créé par d'autres espèces, de même qu'ils peuvent, plus ou moins facilement selon les cas, se détacher du biofilm sous l'action des forces mécaniques ou chimiques de l'environnement.
L'adhésion est le fait de divers mécanismes : fimbriae, pili, curli, impliquant des protéines de différents types (adhésines par exemple), production de cellulose[24] dans certains cas, etc. Il est donc mécaniquement et biochimiquement possible pour un biofilm d'abriter plusieurs espèces différentes, et de ce fait d'éventuellement être plus résistant à l'érosion mécanique, à des détergents et à la désinfection (chloration par exemple, qui peut générer dans ce cas une chlororésistance). Il en va de même pour les biofilms monospécifiques (constitués, in vitro, par une seule espèce mise en culture) ; ces biofilms sont beaucoup plus résistants aux lavages agressifs quand une souche est accompagnée de souches « compagnonnes »[27]. Il a été montré que des souches de E. coli (dont de E. coli O157: H7) ne formant pas spontanément de biofilms peuvent néanmoins survivre en tant que souche compagnonne dans des biofilms générés par d'autres souches, bien qu'elles survivent alors moins bien que les souches plus résistantes en cas de stress.
De fait seuls quelques biofilms sont composés d'un seul type d'organisme - phénomène lié aux conditions environnantes plus souvent qu'à la nature même des organismes. Les biofilms naturels ne sont que rarement clonaux mais au contraire abritent souvent de nombreux types de micro-organismes – bactéries, protozoaires ou encore algues, chaque groupe exécutant des fonctions métaboliques spécialisées, au profit de la résistance de la communauté constituée par le biofilm.
La « matrice » du biofilm à proprement parler, en plus de contenir les éléments dont sont faits les organismes qu'elle abrite (protéines, lipides, ADN, ARN…) est également constituée d'excrétats et de déchets métaboliques. Ce sont notamment des polysaccharides, (peptidoglycanes, cellulose…) ou plus rarement des lipides et protéines. Ces matériaux nutritifs ou protecteurs sont produits par les micro-organismes eux-mêmes ou par leur hôte dans les cas où il s'agit d'un biofilm formé sur une surface vivante (peau humaine par exemple). Ils contiennent souvent aussi une importante proportion d'eau.
La diversité des espèces vivantes qui composent le biofilm a une importance, car diversifiant les interactions durables possibles au sein de chaque espèce (ex : comportement colonial et bioconstructeur des bactéries produisant des stromatolithes) et synergiques (ex. : symbioses) avec d'autres espèces augmentent la fitness (par rapport à ce qu'elle serait pour une espèce seule). Ceci vaut pour les bactéries, par exemple quand elles s'organisent en colonies cohérentes.
Face à un stress externe (chaud, froid, pH…), les biofilms sont plus stables, plus résistants et se protègent mieux contre l'invasion par d'autres bactéries quand ils abritent une diversité d'espèces et de groupes de micro-organismes[28].
- Propriétés, fonctions écosystémiques
Un des aspects majeurs des biofilms est l'induction de changements dans les phénotypes correspondant au changement de mode de comportement (de «planctonique» et individuel, à fixe et communautaire). Des séries entières de gènes voient changer la durée et le rythme de leurs mécanismes d'activation, correspondant donc aussi à des changements de fonctions. L'environnement particulier du biofilm permet aux cellules de, ou les force à, coopérer et agir les unes avec les autres de manière différente qu'en environnement libre. Les bactéries vivant dans un biofilm ont des propriétés notablement différentes, voire très différentes de celles des bactéries « flottantes » de la même espèce.
Certaines souches de bactéries de laboratoire ont perdu leur capacité à former des biofilms, soit par les cultures et sélections successives de bactéries planctoniques, soit par la perte de leur plasmides naturels connus pour favoriser la formation de biofilm[29].
La plus spectaculaire propriété des biofilms est très certainement l'étonnante capacité de résistance qu'ils fournissent à leurs participants contre diverses agressions, comparée à la situation des mêmes organismes en état dit « planctonique ». Cette matrice est, d'autre part, elle-même, assez résistante pour que dans certaines conditions les biofilms puissent se fossiliser. Le biofilm pourrait d'ailleurs être à l'origine des premiers processus de vie coloniale et récifale.
Les micro-organismes sont à plus d'un titre protégés et reliés entre eux par la matrice que fait le biofilm.
- Protection passive
- Par sa simple présence cette matrice protège passivement les cellules dans un rôle de simple barrière physique contre l'entrée des agents antimicrobiens, détergents et antibiotiques[30] - [31] : la matrice extracellulaire dense et la couche externe de cellules protègent l'intérieur de la communauté.
- Protection métabolique
- Autre facteur de résistance accrue : pour des raisons qui restent à déterminer les bactéries entourées de biofilm sont moins actives métaboliquement, donc moins réceptives aux agents antimicrobiens[32] et aux disruptions environnementales[31].
- Protection active
- La résistance de P. aeruginosa aux antibiotiques a également été partiellement attribuée à des pompes de flux du biofilm expulsant activement les composants antimicrobiens[33] - [34] - [35]. Quelques biofilms se sont avérés contenir des canaux aqueux qui en sus de la distribution de nutriments permettent celle de molécules de signalisation, établissant la communication entre cellules par des signaux biochimiques. La formation du biofilm et par le biofilm est contrôlée par des signaux de cellule à cellule, et des mécanismes dits de quorum sensing[36] - [37] - [38] - [39] - [40], ou perception du quota, fondés sur le principe de masse critique. Les systèmes de perception du quota chez les bactéries gram-négatives détectent la densité des cellules en utilisant des signaux de cellule à cellule dépendant de la population, généralement une molécule d'acyl homosérine lactone. Quand cet [auto-inducer] atteint une certaine concentration critique, il active un régulateur transcriptionnel qui induit des gènes cibles spécifiques[41]. La nature et donc la fonction des molécules signalant les échanges de cellule à cellule changent à partir d'une concentration donnée des bactéries.
- Protection génétique
- Dans certains cas, la résistance aux antibiotiques et biocides (notion de récalcitrance) et la résistance aux défenses immunitaires peuvent être exponentiellement multipliées. En effet, lors de leur implantation dans un biofilm l'expression génétique des bactéries est modifiée. Cet environnement d'échanges de matériel génétique permettant le transfert d'informations est donc propice à l'acquisition de nouveaux caractères.
Contribution à minéralisation ou à la corrosion ou dégradation de matériaux. Selon les cas et contextes, les biofilms contribuent à la dégradation de matériaux ou inversement à en produire.
- De nombreux matériaux (métaux, bois) voient leur dégradation (ou corrosion) très accélérée, ou au contraire retardée, lorsqu'ils sont recouverts par certains biofilms, selon le contexte (humide ou sec, acide ou basique, chaud ou froid, eutrophe ou oligotrophe, etc.).
- Les cyanobactéries du picoplancton (ex. : Synechococcus elongatus) sont capables de précipiter le carbone du CO2 dissous dans l'eau sous forme de calcite (carbonate de calcium ou CaCO3) dans tous les lacs riches en calcium de la Terre, contribuant ainsi aux puits de carbone naturels de la sédimentation lacustre[42]. On a ainsi estimé qu'environ 8 000 t/an de carbone sont géologiquement naturellement stockés dans le seul lac de Lugano et 2 500 t/an dans le lac de Sempach en Suisse[43]. Cette production est relativement saisonnière avec un pic correspondant aux blooms planctoniques de cyanophicées dont les cellules (planctoniques ou de biofilms) peuvent alors se recouvrir de cristaux de calcite. Le microscope électronique montre des bactéries en bâtonnets entièrement enrobées de cristaux de calcite[42]. on a montré en laboratoire que les substances extrapolymériques (SEP) produites par les biofilms, même en l'absence de bactéries provoquaient la nucléation de cristaux de calcite. Ces bactéries contribuent donc au tamponnement de l'eau et au maintien du caractère oligotrophe de nombreux lacs de montagne[42].
Biofilms et santé


Les biofilms posent question dans le domaine médical, vétérinaire, de l'écologie, de l'hygiène agroalimentaire, et de la qualité microbiologique des eaux potables et de la gestion des canalisations. On cherche à mieux les comprendre et à les modéliser[44] - [45]
L'eau potable - si elle était peu chargée en matière organique avant le traitement chloré - est considérée comme relativement bien désinfectée par la chloration permanente[46], mais elle est d'autant plus vulnérable en cas d'interruption de la chloration que :
- le contact permanent avec le chlore a pu éventuellement favoriser des mécanismes de chlororésistance chez les espèces présentes dans le biofilm (dont certaines peuvent être pathogènes)[46],
- la chloration ne saurait en aucun cas détruire les biofilms qui se sont développés sur toutes les parois des canalisations de distribution d'eau et qui constituent l'essentiel de la biomasse bactérienne présente dans le réseau de distribution[46] ;
Même dans des réseaux de distribution d'eau « constamment chlorés, le biofilm peut représenter jusqu'à 107 bactéries/cm2 dont 1 % sont viables et capables de se multiplier, prouvant l'inefficacité réelle du traitement sur ces biomasses fixées »[46]; - on peut supposer que depuis un siècle environ (invention de la verdunisation de l'eau), le nombre de souches résistantes, et l'importance de la résistance a pu augmenter.
En France, l'étude des biofilms s'est notamment faite à l'INRA à partir de souches de culture de Bacillus subtilis (une bactérie Gram-positive, ubiquiste et facile à cultiver) qui durant dix ans a servi de modèle pour étudier les voies moléculaires et génétiques contrôlant la formation et l'organisation d'un biofilm. La plupart des données sur les biofilms de B. subtilis concernent les écotones air-liquide, ou air/gélose nutritive semi-solide. Quelques études ont porté sur la formation de macrocolonies complexes (formant parfois des excroissances en forme de thalles ou de haricots de 300 µm de hauteur) sur l'interface liquide/solide[47].
Formation
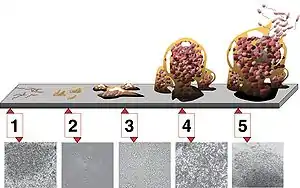
Étape 1 : attachement initial ;
étape 2 : attachement irréversible ;
étape 3 : apparition et « maturation I » du biofilm ;
étape 4 : maturation II ;
étape 5 : érosion et dispersion/Détachement autogène[48].
Les photomicrographies (toutes à même échelle) sont celles d'un biofilm de Pseudomonas aeruginosa en développement.
(Informations tirées du Center for Biofilm Engineering, Montana State University )
Considérant le biofilm au sens « embryologique » c'est-à-dire comme une entité/unité fonctionnelle de structure multicellulaire organisée, on peut également parler de cycle de développement ou de cycle de vie car le modèle en cinq étapes proposé ci-après peut se répéter indéfiniment:
- L’adsorption des bactéries ou l’adhésion réversible sur le support constitue la première étape de formation du biofilm. Elle est déclenchée, lorsque les microorganismes arrivent à la surface à une certaine distance (entre 2 et 50 nm), par l'intermédiaire des forces non covalentes, comme les interactions de Van der Waals, acide-base et électrostatiques[49]. L'accès des bactéries à la surface est fonction du couplage chimiotaxie/motilité, de la sédimentation, du mouvement brownien, du transport convectif. Le taux d’établissement des bactéries pionnières dépend de la nature du substrat mais aussi de la rhéologie locale, en particulier des caractéristiques de vélocité et de turbulence du milieu liquide environnant contenant les micro-organismes en suspension[50].
- Vient ensuite l'adhésion irréversible par la formation de molécules protéiques appelées adhésines (en), et de structures telles que les pili. Ces premiers points fixes augmentent la capacité d'ancrage d'autres micro-organismes en accroissant et en variant les surfaces d'ancrage. Noter que certaines espèces ne sont pas capables de s'ancrer elles-mêmes et s'intègrent à d'autres espèces déjà installées en colonies en s'attachant à leur biofilm. On a ici les prémices de la structure du biofilm : sa diversité de natures et de structures laisse envisager une diversité de fonctions.
- Les micro-organismes se divisent, commençant ainsi des microcolonies. À partir d'une concentration suffisamment dense d'individus, les microcolonies commencent la sécrétion du biofilm proprement dit.
- Ensuite, la colonisation de la surface se fait grâce à la multiplication des microorganismes qui vont former des macrocolonies tout en sécrétant une substance polymérique extracellulaire (en). Ainsi, le biofilm grandit et mûrit, s'épaississant jusqu'à devenir macroscopique, et former un biofilm mature proprement dit[51].
- La cinquième étape est la phase de dispersion[52] : induits par le vieillissement du biofilm, certains stress ou carences, les micro-organismes peuvent activement se séparer du biofilm, parfois consommant la matrice qui représente une source d'énergie. Ces micro-organismes retournent à l'état dit « planctonique » de libre circulation et peuvent aller coloniser de nouvelles surfaces, la planctonisation complétant ainsi le cycle. Dans le mode de vie du biofilm et selon ce modèle en cinq étapes, la phase « planctonique » peut alors être vue comme une phase de dispersion, tout comme le détachement « autogène » de plaques ou morceaux de biofilms, qui semble fortement influencé par la température, en eaux douces tempérées[48].
Communication inter-cellules
Au sein de certains biofilms les bactéries échangent des signaux qui permettent l'intégrité et une synchronication métabolique de la communauté.
On a récemment (2017) montré en laboratoire que deux biofilms différents d'une même bactérie peuvent aussi échanger des signaux[53]. Ainsi Gürol Süel (université de Californie, San Diego) et son équipe ont placé deux biofilms de Bacillus subtilis proches l'un de l'autre, mais séparés par environ 1 000 longueurs de cellules. Les auteurs ont surveillé les flux de signalisation électrique et ont montré que ces deux communautés ont synchronisé leurs oscillations métaboliques, ce qui a favorisé une concurrence pour les nutriments et induit un ralentissement de la croissance de chaque biofilm. De manière plus inattendue, quand le taux de nutriments disponible a été diminué par les chercheurs, les colonies ont modifié leurs oscillations métaboliques en les rendant complémentaires ce qui a paradoxalement augmenté le taux moyen de croissance de chaque colonie bactérienne (par rapport à deux biofilms en croissance dans un environnement plus riche en nutriments[54]. Selon les auteurs, il peut s'agir d'une forme de résolution d'un conflit face à une alimentation rare : Les biofilms résolvent le conflit en passant d'oscillations en phase à des oscillations antiphasiques (un biofilm se nourrit pendant que l'autre est en pause et inversement).
Chez l'animal dont l'humain
Tous les organes internes creux communiquant avec l'environnement extérieur (bouche, tube digestif, vagin…) sont une niche écologique abritant un film d'organismes vivants plus ou moins riche. Ces organismes, bactériens notamment, coévoluent avec leur hôte et son système immunitaire. Ils jouent un rôle fonctionnel important pour l'organisme, dans la digestion par exemple (et tout particulièrement chez les ruminants). Ce sont parfois des symbiotes (mutualistes), ce sont parfois des pathogènes (sources de plus de 60 % des foyers infectieux[55]) ou parasites, ou ils le deviennent lorsque des conditions de déséquilibre leur permettent de pulluler (ex. : mycose survenant après traitement antibiotique).
Chez l'animal on parle alors de « flore » (flore intestinale, flore vaginale…) ou de microbiote.
Certains animaux sont également extérieurement couverts d'un biofilm (le paresseux a les poils qui verdissent en raison d'une algue qui y vit).
Chez les plantes
Surtout en zone tropicale, mais aussi en climat tempéré, un biofilm algal et bactérien, fongique et/ou lichénique existe sur les feuilles des arbres, les écorces et les racines. Certaines des bactéries qui le forment deviennent dans certaines circonstances (stress, gel, piqure d'insectes, etc) pathogènes, c'est le cas par exemple d'un pseudomonas commun (Pseudomonas syringae) dont certaines souches provoquent une maladie mortelle chez le marronnier (maladie émergente). Le biofilm bactérien et fongique se développe en été « en épiphyte » et prépare la bonne décomposition des feuilles avant même qu'elles ne tombent (à l'automne en climat tempéré, toute l'année en zone équatoriale).
Ressource alimentaire pour les animaux
Les écotones des biofilms croissant sur des plantes ou sur les roches et le sédiment sont une des sources importantes de nourriture pour de nombreux organismes racleurs (invertébrés dont limaces, escargots, parfois aquatiques, escargots, poissons, crustacés…) ainsi que pour les organismes brouteurs de la méiofaune[56] - [57], dont jeunes larves de chironomes, nématodes[58] qui y trouvent une source importante de carbone organique[59].
Un exemple particulier de « recyclage » rapide de nécromasse faisant aussi intervenir des biofilms naturels est celui des millions de saumons qui mourraient autrefois après le frai en amont des cours d'eau, près des sources. Leurs cadavres se décomposaient assez rapidement en libérant des oligoéléments rapportés de la mer (dont iode, élément souvent absent ou très rare dans le haut des bassins versants) et en donnant source à des bactéries et microinvertébrés qui seront la nourriture des alevins. Ces saumons étaient si nombreux que les vertébrés nécrophages ne pouvaient en consommer qu'une petite partie[60]. Une étude a comparé en Alaska (en 1996) le biofilm naturel et la biomasse de macroinvertébrés d'un cours d'eau où étaient venus pondre environ 75 000 saumons adultes et une partie du cours d'eau situé en amont de la frayère[60]. En aval de cette dernière et après la mort des reproducteurs, la masse sèche de biofilm était 15 fois plus élevée qu'en amont de la frayère, et la densité totale en macroinvertévrés était jusqu'à 25 fois supérieure dans les zones enrichie par les cadavres de saumons[60]. Dans ce cas, (saumons morts à demi-immergés dans une eau peu profonde et bien oxygénée), ces macroinvertébrés benthiques d'eau douce étaient principalement des moucherons chironomidés, des éphémères (Baetis et Cinygmula) ainsi que des perles[60].
Le biofilm microbien des vasières est aussi une source de nourriture directe : on a récemment montré[1] qu'ils pouvaient aussi l'être pour quelques vertébrés supérieur. L'étude conjointe d'enregistrements vidéo et du contenu stomacal et d'isotopes stables comme marqueurs a récemment (2008) montré qu'un bécasseau (Calidris mauri) peut abondamment brouter le biofilm superficiel intertidal et s'en nourrir (auparavant, ce type de biofilm était uniquement considéré comme une source de nourriture pour les invertébrés râpeurs et quelques poissons spécialisée).
Dans ce cas, le biofilms constituait de 45 à 59 % de la ration alimentaire totale de l'oiseau. Et il fournissait environ la moitié (50 %) de son budget énergétique quotidien[1].
Il est possible que cette espèce puisse profiter d'une augmentation de l'épaisseur du biofilm due à l'eutrophisation générale de l'environnement.
Ce constat implique aussi une concurrence entre cet oiseau de rivage et les invertébrés herbivores consommateurs primaires qui exploitent aussi cette ressource, mais il est possible qu'en remuant la couche superficielle du sédiment, l'oiseau favorise la régénération naturelle du biofilm qui à marée haute peut alors être consommé par les invertébrés aquatiques[1].
En outre, étant donné les taux de "pâturage" individuels estimée à sept fois la masse corporelle par jour, et l'importance des groupes d'oiseaux en cause (dizaines de milliers d'individus), les oiseaux de rivage se nourrissant de biofilm pourrait avoir des impacts non négligeables à « majeurs » sur la dynamique sédimentaire[1]. Le dragage et le chalutage, l'apport de polluants piégés par le biofilm ou susceptible de l'altérer (pesticides, antifoulings, cuivre…) peut interférer avec la productivité de cette ressource. Les auteurs de cette étude soulignent « l'importance des processus physiques et biologiques de maintien du biofilm pour la conservation de certains oiseaux de rivage et des écosystèmes interditaux »[1].
Utilisation
Si les biofilms sont une source de contamination dans des secteurs tels que l'agro-alimentaire ou le médical, ils peuvent également être utilisés positivement
- dans les procédés de traitement d'eaux usées. Ces procédés utilisent des supports fixes (lit fixe, biofiltre) ou mobiles (moving bed, lit fluidisé) sur lesquels peuvent se développer des biofilms qui participent au traitement de la pollution. Dans le traitement des eaux résiduaires urbaines, ce type de procédé peut remplacer le procédé à boues activées en réduisant la taille des bassins d'aération et en supprimant l'étape de décantation. Les biofiltres aérés sont cependant des procédés intensifs et les coûts énergétiques associés peuvent être plus élevés pour la même quantité de pollution traitée. On peut également utiliser les procédés à biofilm en digestion anaérobie (méthanisation), pour le traitement des eaux usées industrielles riches en matière organique (agro-alimentaire, papeterie, pharmacie, etc.).
- D'autres usages sont envisageables dans le domaine de la lubrification sous l'eau ou des piles microbiennes (ex. : Projet BAGAM: Biofilms Amazonien issus de la biodiversité Guyanaise pour Applications en pile Microbiennes[61].
- Dans la nature, ils peuvent servir de bioindicateurs et de marqueurs du degré de pollution chronique de leur habitat (Wanner, 2006).
Et en tant que biointégrateurs, leur analyse physicochimique peut apporter d'intéressantes informations sur les contaminants présents dans l'environnement, par exemple pour les métaux, métalloïdes toxiques ou les pesticides[22], par exemple en zone de vignobles[62] (pesticides qui peuvent eux-mêmes modifier la composition du biofilm[63]).
Biofilms, pathogènes et santé publique
La contamination des surfaces, des installations et des dispositifs, par des microorganismes dans les secteurs alimentaires et hospitaliers, constitue un véritable problème de santé publique. Ces contaminations sont à l’origine de deux types d’infections :
les intoxications alimentaires et les infections nosocomiales. Selon l’enquête réalisée par le Réseau d’Alerte, d’Investigations et de Surveillance des infections nosocomiales (RAISIN, 2003), 6,9 % des patients hospitalisés sont victimes d’une infection nosocomiale (800 000 personnes chaque année). Ces infections sont à l’origine de 4 200 décès par an en France.
Dans les écosystèmes naturels ou artificiels, si les conditions environnementales sont appropriées, les biofilms peuvent se former sur tout type de surfaces abiotiques, comme le verre, le plastique, le caoutchouc et l'acier inoxydable[64] - [65]. Le développement non désiré de biofilms engendre de nombreux problèmes économiques et sanitaires. En milieu hospitalier, les biofilms suscitent un intérêt particulier car ils sont impliqués dans un large éventail d’infections chez l’homme. Environ 60 % des infections nosocomiales, dans les pays dits développés, sont dues à des biofilms[66]. Par ailleurs, l’industrie agro-alimentaire n’est pas à l’abri de cette problématique. En effet, ces biofilms sont présents dans les laiteries, brasseries, sucreries, salaisonneries, etc. La présence du biofilm dans ces industries constitue un problème relatif à la qualité et la sécurité des produits alimentaires.
L'alginate permet à certaines bactéries de produire des biofilms souples qui les rendent jusqu'à 1000 fois plus résistantes aux antibiotiques que lorsqu'elles vivent à l'état libre[67] - [68] - [69]
Sur ou dans les organismes
- Sur la peau ou à l'intérieur des organismes vivants les biofilms bactériens ont un rôle la plupart du temps protecteur (ex : pour la digestion dans l'intestin, pour la protection de la peau) et accidentellement destructeurs ; Des biofilms pathogènes sont impliqués dans une large gamme de maladies infectieuses : 65 % des infections recensées chez l'Homme dans les pays développés sont causées ou entretenues par des biofilms, et plus de 80 % des infections bactériennes chroniques le sont[70]. Certaines maladies (ex : mucoviscidose) ou de mauvaises conditions environnementales favorisent la formation de biofilms source d'infections et surinfections.
- Des biofilms peuvent aussi se développer sur des surfaces « inertes » du corps humains : les dents où ils forment la plaque dentaire chez tous ; mais aussi sur des prothèses (ce qui justifie les très strictes conditions des opérations d'implantation de celles-ci), ou des séquestres osseux. Toute bactérie (même considérée comme n'étant pas pathogène en général) peut y former un biofilm et causer des fièvres (avec bactériémie) périodiques lors des phases de dispersion.
- Ils semblent une cause importante de la formation des tumeurs de l'appareil digestif :
- tumeur de l'estomac : biofilm d'Helicobacter pylori[71] qui en attaquant la muqueuse crée l'ulcère ou le cancer[72] - [73] - [74] - [75] ;
- polype du colon[76] - [77] : associé à plus de 90 % des cancers[78] ;
- adénocarcinome du pancréas : des études[79] ont montré la présence d'un biofilm, bactérien (Bacteroides, Gammaproteobacteria, Firmicutes et Clostridium lituseburense) ;
- tumeur du foie : biofilm[80] - [81] d'Aspergillus, lui permettant d'échapper au système immunitaire[82], dans une infection de type aspergillose non invasive.
Exemples de maladies impliquant des biofilms
- Carie dentaire
- Gingivite
- Péritonite
- infection pulmonaire chronique chez les patients atteints de Mucoviscidose[83] - [84] - [85] - [86] - [87]
- Otite (notamment chez l'enfant)
- Ostéomyélite
- Parodontite
- Prostatite
- Endocardite bactérienne
- Nombreuses maladies de peau
Les maladies liées à des biofilms bactériens pathogènes sont souvent chroniques.
Destruction ou traitement thérapeutique
Etant donné la forte résistance des biofilms aux différents agents qui peuvent l'agresser, la destruction du biofilm est souvent malaisée, notamment en matière médicale. Ainsi les antibiotiques sont-ils moins efficaces sur une bactérie formant biofilm que sur la même bactérie à l'état de flottaison planctonique. La phagothérapie, qui utilise des virus bactériophage pour attaquer les bactéries, a démontré une certaine efficacité, surtout lorsqu'elle est utilisée en conjonction avec un antibiotique. Il y a alors synergie. Pour que le phage ait une efficacité, il faut qu'une séquence de son matériel génétique code une enzyme dégradant la matrice extracellulaire.
Dans l'environnement
- Presque tous les biofilms peuvent abriter (ou piéger) des organismes pathogènes pour d'autres espèces, y compris dans les tuyaux d'eau chaude où l'on trouve des Legionella d'origine hydro-telluriques qui survivent au chlore dans les biofilms[88] - [89] qui la protègent de la chloration et semble jouer un rôle important pour sa survie dans les installations[90]. On en trouve y compris dans les biofilms de réseaux d'eau domestiques, parfois associée à Pseudomonas aeruginosa[91]. Outre la nature de l'eau (acidité, minéralisation, teneur en matières organiques et nutriments), la température et le type de matériaux utilisés en plomberie jouent aussi un rôle important dans la formation des biofilms[92] - [93]. En conditions difficiles (chaleur élevée, biocide, etc.), les Legionelles croissent mieux et plus vite quand elles sont cocultivées avec des amibes et en présence de cyanobactéries (qui modifient la teneur en nutriments du milieu)[88].
- Dans l'eau, les biofilms épilithiques bioaccumulent aussi des métaux et métalloïdes toxiques, et peuvent dans une certaine mesure s'en « détoxiquer »[94] ou les séquestrer. Ils contribuent donc à épurer la colonne d'eau de plusieurs types de polluants xénobiotiques[95] - [96] - [97]. Ils contribuent aussi à recycler les nutriments notamment là où les plantes ne peuvent s'installer en raison du courant ou de la turbidité[98] - [99] - [100].
Dans la nature, leur analyse peut révéler un stress métallique environnemental.
Ainsi, après les crues ou pluies d'orages qui apportent des eaux de ruissellement polluées et/ou qui remanient les sédiments en remettant des métaux en suspension dans l'eau, les biofilms algaux d'étangs ou cours d'eau peuvent réagir rapidement[94] ; on y constate une augmentation rapide des taux de certains polluants après leur arrivée dans le milieu. Des polypeptides dits « phytochélatines » neutralisant au moins provisoirement les métaux en les chélatant[101], ce qui épure la masse d'eau, mais concentre ces polluants dans l'alimentation des racleurs tels que les escargots aquatiques ou certains poissons.
Biofilms et recherche
Les biofilms se formant sur les roches, sols et sédiments sont étudiés par une discipline scientifique, la géomicrobiologie. Des chercheurs se sont spécialisés dans les biofilms se formant sous l'eau, telle l'écologue Jennifer Tank, dont le travail de maitrise et de thèse de doctorat ont respectivement porté sur la respiration microbienne mesurée sur les feuilles et le bois mort en décomposition dans un ruisseau de la région des Appalaches[102] et sur l'activité microbienne des biofilms se formant sur les bois immergés des cours d'eau [103].
En France existe un Réseau national Biofilm (RNB) de laboratoires et organismes de recherche (CNRS INRA, Ifremer...) étudiant les biofilms en milieux alimentaire, médical et naturel marin[104] - [105].
Biofilms et industrie
Les biofilms sont utilisés pour leur capacité de filtration (biofiltres), mais posent problème dans certains processus en étant à la fois source d'entartrement et de corrosion (notamment pour l'industrie de l'extraction gazière et pétrolière, dans les conduites d'eau de process (parfois riches en nutriments, dans le domaine de l'agroalimentaire ou de la papeterie par exemple), sur les échangeurs thermiques[106] etc.)
Les biofilms posent aussi problème dans les canalisations des réseaux d’alimentation en eau potable. dans les canalisations d'eau sanitaire chauffée (ex. : légionellose...).
Ils sont aussi impliqués dans la détérioration de dispositifs médicaux par bio-corrosion.
La bio-corrosion résulte des biofilms composés de bactéries réductrices de sulfate (SRB[107]) qui interagissent avec de l'hydrogène moléculaire présente sur les surfaces des tubes et produisent du sulfure d'hydrogène, comme produit secondaire de métabolisme bactérien. Ce processus décompose le fer et l'acier de tuyaux, même à paroi épaisse, ce qui entraîne des fuites et des graves défaillance des pipelines et des canalisations métalliques non protégées.
La surveillance et le contrôle de biofilms dans les industries pourraient prévenir les pannes d'équipements, de réduire les dégradations des installations et par conséquent, les pertes économiques.
Détection et analyse de biofilms
Une technique de choix pour l'analyse des biofilms est la microscopie à fluorescence avec ou sans marqueurs génétiquement fusionnés. Une difficulté pour l'analyse quantitative de biofilms à l'aide de protéines fluorescentes comme la GFP ou ses dérivés est l'appauvrissement du milieu en oxygène au fur et à mesure de la croissance du biofilm. On a montré que la technique Fluorescence-Activating and absorption-Shifting Tag, qui ne nécessite pas d'oxygène pour la maturation du fluorophore, permettait de suivre la dynamique de croissance des biofilms bien au-delà des techniques d'imagerie conventionnelles[108].
Il est aussi possible de mesurer via des analyses potentiométriques des biofilms d'une épaisseur de l'ordre du micromètre. Cette analyse détermine d'élasticité du biofilm donnant un indice sur la proportion des phases minérales et organiques. Il est possible d'en déduire des stratégies de traitement et d'évaluer leur efficacité au cours du temps. L'appareil industriel permettant de faire ces mesures s'intitule le BioFilm Monitor. Il est développé par OrigaLys ElectroChem SAS en collaboration avec BIOmétriZ.
Notes et références
- Tomohiro Kuwae, Peter G. Beninger, Priscilla Decottignies, Kimberley J. Mathot, Dieta R. Lund, Robert W. Elner. (2008) Biofilm grazing in a higher vertebrate : the westerne sandpiper, Calidris Mauri ; Ecology 89:3, 599-606 ; En ligne 2008-03-01 (résumé)
- Cette photosynthèse se caractérise par la présence de pigments verts photosynthétiques masqués par des pigments gris noirâtre qui ont un rôle de photoprotection analogue à celui des mélanines épidermiques. En rayant le biofilm avec un couteau, il est parfois possible de démasquer les pigments verts de chlorophylle en les solubilisant, et d'observer cette coloration.
- « Avec le temps, le biofilm s’épaissit : si le support est vertical, il finit par se décoller, et un nouveau cycle de colonisation recommence. Si la pente est moindre, des lichens et des mousses peuvent s’ancrer ; le biofilm épaissit, puis bientôt les premières plantes arrivent ! Le biofilm devient alors un sol : d’ailleurs, les cyanobactéries lèguent à ce sol l’azote qu’il contiendra ensuite ! Le biofilm des façades et des falaises est le début d’un sol, condamné à l’échec par la verticalité. Mais ailleurs, sur le plat, les biofilms ont laissé place aux sols qui nous entourent ». Cf Marc-André Selosse, Petites histoires naturelles: Chroniques du vivant, Actes Sud Nature, , p. 32.
- S'il s'agissait de dépôts atmosphériques dus à la pollution, la localisation de ces croûtes serait plus continue et ces dépôts seraient partiellement lessivés par les eaux de ruissellement. Cf Philippe Bromblet, Mémento sur les altérations de la pierre, CICRP, (lire en ligne), p. 10
- On peut dire que ces micro-organismes vivent d’air et d’eau fraiche.
- Le rôle des biofilms dans l'altération joue sur plusieurs niveaux : mécanique (désagrégation rendant la surface rocheuse poudreuse), chimique (catalyse acide). De plus, cette matière organique favorise la rétention d'eau (hydrolyse, dissolution). Cf. (en) A. A. Gorbushina & W. J. Broughton, « Microbiology of the atmosphere-rock interface: how biological interactions and physical stresses modulate a sophisticated microbial ecosystem », Annual Review of Microbiology, vol. 63, no 1, , p. 431-450 (DOI 10.1146/annurev.micro.091208.073349).
- (en) Costerton JW, Lewandowski Z, De Beer D, Caldwell D, Korber D, James G, « Minireview: biofilms, the customized microniche » Journal of Bacteriology 1994;176:2137–2142.
- (en) Costerton JW, Geesey GG, Cheng KJ, « How bacteria stick », Sci Am., vol. 238, no 1, , p. 86-95.
- (en) Hilary Lappin-Scott, Sara Burton & Paul Stoodley, « Revealing a world of biofilms — the pioneering research of Bill Costerton », Nature Reviews Microbiology, vol. 12, , p. 781–787 (DOI 10.1038/nrmicro3343).
- (en) J W Costerton, K J Cheng, G G Geesey, T I Ladd, J C Nickel, M Dasgupta, T J Marrie, « Bacterial biofilms in nature and disease », Annu Rev Microbiol, vol. 41, , p. 435-464 (DOI 10.1146/annurev.mi.41.100187.002251).
- (en) Bridier A, Le Coq D, Dubois-Brissonnet F, Thomas V, Aymerich S, Briandet R, « The spatial architecture of Bacillus subtilis biofilms deciphered using a surface-associated model and in situ imaging » PLoS One. 2011;6(1):e16177.
- Programme de recherche VASIREMI, soutenu par l'ANR blanc coordonné par l'université de La Rochelle (C. Dupuy) 2006-2010. Trophic web linked to microbial biofilm in intertidal mud flats
- (en) Costerton JW, Geesey GG, Cheng KJ, « How bacteria stick » Scientific American 1978;238:86-95
- (en) Lock M.A. « Attached microbial Communities in rivers » In: Aquatic Microbiology (ed. T.E. Ford). Blackwell Scientific Publications, Oxford, 1993, p. 113–138
- Michael Döring et Urs Uehlinger, « Les biofilms du Tagliamento » (l'un des derniers fleuves sauvages européens, en Italie), Eawag News 60f/juillet 2006, 3 p.
- Uhlich GA, Cooke PH, Solomon EB. ; Analyses of the red-dry-rough phenotype of an Escherichia coli O157:H7 strain and its role in biofilm formation and resistance to antibacterial agents. ; Appl Environ Microbiol. 2006 Apr;72(4):2564-72. (Résumé)
- Burmolle M, Webb JS et al. (2006) Enhanced biofilm formation and increased resistance to antimicrobial agents and bacterial invasion are caused by synergistic interactions in multispecies biofilms. Appl. Environ. Microbiol. 3916-3923]
- Freytet P (2003) Analyse d'un exemple de fossilisation d'une trace de pas de Dinosaure (Lias inférieur des Causses). Le Naturaliste vendéen, 3, 63-67.
- Gall, J. C., Bernier, P., Gaillard, C., Barale, G., Bourseau, J. P., Buffetaut, E., & Wenz, S. (1985). Influence du développement d'un voile algaire sur la sédimentation et la taphonomie des calcaires lithographiques. Exemple du gisement de Cerin (Kimméridgien supérieur, Jura méridional français). Comptes rendus de l'Académie des sciences. Série 2, Mécanique, Physique, Chimie, Sciences de l'univers, Sciences de la Terre, 301(8), 547-552.
- Gall JC (1990) Les voiles microbiens. Leur contribution à la fossilisation des organismes au corps mou. Lethaia, 23(1), 21-28 (résumé).
- (en) Ryu JH, Beuchat LR. « Biofilm formation by Escherichia coli O157:H7 on stainless steel: effect of exopolysaccharide and Curli production on its resistance to chlorine » Appl Environ Microbiol. 2005;71(1):247-54.
- IRSTEA, Les biofilms, sentinelles des rivières, à propos de modélisation de biofilms par l'Irstea-Lyon, consulté 2012-08-01
- Stéphane Pesce, Ahmed tili et Bernard Montuelle, « Les biofilms aquatiques : dans quelle mesure permettent-ils de comprendre l'effet des pesticides sur le fonctionnement des cours d'eau ? Exemple en zone de vignoble » Ingénieries 2008;55-56:79-91.
- (en) Uhlich GA, Cooke PH, Solomon EB « Analyses of the red-dry-rough phenotype of an Escherichia coli O157:H7 strain and its role in biofilm formation and resistance to antibacterial agents » Appl Environ Microbiol. 2006 Apr;72(4):2564-72. . (Résumé)
- (en) Samuel S. Wu et Dale Kaiser, « Genetic and functional evidence that Type IV pili are required for social gliding motility in Myxococcus xanthus », Molecular Microbiology, vol. 18, no 3, , p. 547–558 (ISSN 1365-2958, DOI 10.1111/j.1365-2958.1995.mmi_18030547.x, lire en ligne, consulté le )
- (en) Salim T. Islam, Israel Vergara Alvarez, Fares Saïdi et Annick Guiseppi, « Modulation of bacterial multicellularity via spatio-specific polysaccharide secretion », PLOS Biology, vol. 18, no 6, , e3000728 (ISSN 1545-7885, PMID 32516311, PMCID PMC7310880, DOI 10.1371/journal.pbio.3000728, lire en ligne, consulté le )
- Uhlich GA, Rogers DP, Mosier DA Escherichia coli serotype O157:H7 retention on solid surfaces and peroxide resistance is enhanced by dual-strain biofilm formation ; Foodborne Pathog Dis. 2010 Aug;7(8):935-43. (Résumé)
- Burmolle M, Webb JS & al (2006) Enhanced biofilm formation and increased resistance to antimicrobial agents and bacterial invasion are caused by synergistic interactions in multispecies biofilms. Applied and environmental Microbiology, 3916-3923
- (en) Ghigo JM, « Natural conjugative plasmids induce bacterial biofilm development » Nature 2001;412(6845):442-5.
- Costerton, J. W., 2001, Cystic fibrosis pathogenesis and the role of biofilms in persistent infection. Trends Microbiol. 9:50-52
- G.A. O'Toole, L. A. Pratt, P. I. Watnick, D. K. Newman, V. B. Weaver, and R. Kolter, 1999, Genetic approaches to study of biofilms. Methods Enzymol. 310:91-109
- Drenkard, E. 2003, Antimicrobial resistance of Pseudomonas aeruginosa biofilms. Microb. Infect. 5:1213-1219
- Aeschlimann, J. R. 2003, The role of multidrug efflux pumps in the antibiotic resistance of Pseudomonas aeruginosa and other Gram-negative bacteria: insights from the Society of Infectious Diseases Pharmacists. Pharmacotherapy 23:916-924
- De Kievit, T. R., M. D. Parkins, R. J. Gillis, R. Srikumar, H. Ceri, K. Poole, B. H. Iglewski, and D. G. Storey, 2001, Multidrug efflux pumps: expression patterns and contribution to antibiotic resistance in Pseudomonas aeruginosa biofilms. Antimicrob. Agents Chemother. 45:1761-1770
- Poole, K. 2001, Multidrug efflux pumps and antimicrobial resistance in Pseudomonas aeruginosa and related organisms. J. Mol. Microbiol. Biotechnol. 3:255-264
- Davies, D. G., M. R. Parsek, J. P. Pearson, B. H. Iglewski, J. W. Costerton, and E. P. Greenberg, 1998, The involvement of cell-to-cell signals in the development of a bacterial biofilm. Science 280:295-298
- Hall-Stoodley, L., J. W. Costerton, and P. Stoodley, 2004, Bacterial biofilms: from the natural environment to infectious diseases., Nat. Rev. Microbiol. 2:95-108
- Mah, T.-F., B. Pitts, B. Pellock, G. C. Walker, P. S. Stewart, and G. A. O'Toole, 2003, A genetic basis for Pseudomonas aeruginosa biofilm antibiotic resistance., Nature 426:306-310
- Parsek, M. R., and P. K. Singh, 2003, Bacterial biofilms: an emerging link to disease pathogenesis. Annu. Rev. Microbiol. 57:677-701
- Smith, R. S., and B. H. Iglewski, 2003, P. aeruginosa quorum sensing systems and virulence. Curr. Opin. Microbiol. 6:56-60
- W.C. Fuqua, S.C. Winans, E.P. Greenberg, 1994. Quorum sensing in bacteria: the LuxR-LuxI family of cell density-responsive transcriptional regulators., J Bacteriol 176: 269-275
- Maria Dittrich, Philipp Kurz & Bernhard Wehrli, [The role of autotrophic picocyanobacteria in calcite precipitation in an oligotrophic lake] ; Geomicrobiology Journal, Volume 21, Issue 1, 2004 ; p. 45 à 53 ; DOI:10.1080/01490450490253455(résumé)
- Sabine Sibler et Maria Dittrich, Précipitation de calcite à la surface des cyanobactéries
- Oskar Wanner, La modélisation des biofilms: un outil de recherche ; Eawag ; Eawag News 60f/juillet 2006
- Wanner O., Eberl H.J., Morgenroth E., Noguera D.R., Picioreanu C., Rittmann B.E., van Loosdrecht, M.C.M. (2006), Mathematical modeling of biofilms. Scientific and Technical Report 18, IWA Publishing, London, 179 p.
- La qualité de l'eau et assainissement en France : Rapport de l'OPECST no 2152 (2002-2003) de M. Gérard MIQUEL, fait au nom de l'Office parlementaire d'évaluation des choix scientifiques et techniques (PDF, 2,2 mégaoctets), déposé le 18 mars 2003, Voir Annexe 69 - Les membranes et l'eau potable, consulté 2011/02/27
- illustration en microscopie confocale à balayage laser (PLoS One. 2011 Jan 18;6(1):e16177., in The spatial architecture of Bacillus subtilis biofilms deciphered using a surface-associated model and in situ imaging déjà cité)
- Boulêtreau S., Sánchez-Pérez J.-M., Sauvage S., Lyautey E., Garabetian F, Détachement autogène : un contrôle de la dynamique des biofilms phototrophes en rivière sensible à la température (BRGM, Toulouse-III)
- (en) Rolf Bos, Henny C. van der Mei et Henk J. Busscher, « Physico-chemistry of initial microbial adhesive interactions – its mechanisms and methods for study », FEMS Microbiology Reviews, vol. 23, , p. 179-230 (ISSN 1574-6976, PMID 10234844, DOI 10.1111/j.1574-6976.1999.tb00396.x, lire en ligne, consulté le )
- (en) RM Donlan, « Biofilms: microbial life on surfaces », Emerg Infect Dis., septembre 2002, vol. 8, n°9, p.881-90
- (en) J. W. Costerton, Philip S. Stewart et E. P. Greenberg, « Bacterial Biofilms: A Common Cause of Persistent Infections », Science, vol. 284, , p. 1318-1322 (ISSN 0036-8075 et 1095-9203, PMID 10334980, DOI 10.1126/science.284.5418.1318, lire en ligne, consulté le )
- Paul Stoodley, John D. Boyle, Dirk DeBeer et Hilary M. Lappin‐Scott, « Evolving perspectives of biofilm structure », Biofouling, vol. 14, , p. 75-90 (ISSN 0892-7014, DOI 10.1080/08927019909378398, lire en ligne, consulté le )
- Jintao Liu & al. (2017) Coupling between distant biofilms and emergence of nutrient time-sharing ; Science, le 6 avril 2017 DOI: 10.1126/science.aah4204 (résumé)
- News du journal Nature (2017), Biofilms call out to each other from a distance ; Bacterial communities coordinate activities to boost growth when nutrients run low. (résumé), 06 avril 2017, consultée le 15 avril 2017
- "Collège de France, 2010, Sansonetti: Biofilms"
- Majdi, Nabil (2011), thèse d’État : La méiofaune du biofilm épilithique de rivière : dynamique et interactions trophiques ; Laboratoire d'Écologie Fonctionnelle et environnement (EcoLab), mai 2012, 176 pp (résumé)
- Majdi, N., B. Mialet, S. Boyer, M. Tackx, J. Leflaive, S. Boulêtreau, L. Ten-Hage, F. Julien, R. Fernandez & E. Buffan-Dubau (2012). The relationship between epilithic biofilm stability and its associated meiofauna under two patterns of flood disturbance. Freshwater Science 31: 38–50.
- Majdi N., M. Tackx, W. Traunspuger & E. Buffan-Dubau (2012). Feeding of biofilmdwelling nematodes examined using HPLC-analysis of gut pigment contents. Hydrobiologia 680: 219–232
- Majdi N., M. Tackx & E. Buffan-Dubau (soumis). Trophic positionning and microphytobenthic carbon uptake of biofilm-dwelling meiofauna in a temperate river
- Wipfli M.S, Hudson J & Caouette J (1998) Influence of salmon carcasses on stream productivity: response of biofilm and benthic macroinvertebrates in southeastern Alaska, USA. Canadian Journal of Fisheries and Aquatic Sciences, 55(6), 1503-1511
- P. Salvin (Univ. Des Antilles et de la Guyane), Présentation du projet BAGAM : Biofilms Amazonien issus de la biodiversité Guyanaise pour Applications en pile Microbiennes – AAP FRB 2009
- Stéphane Pesce, Ahmed Tlili et Bernard Montuelle, Les biofilms aquatiques : dans quelles mesures permettent-ils de comprendre l’effet des pesticides sur le fonctionnement des cours d’eau ? Exemple en zone de vignoble ; Revue Ingénierie-EAT no 55-56
- Aurélie Villeneuve, [ Effets conjoints de facteurs physiques (lumière et vitesse du courant) et chimiques (pesticides) sur la structure et la composition du périphyton : une approche multi-échelles] ; Thèse soutenue le 18 décembre 2008 (codirection Irstea-Inra), résumé. Le pesticide testé était le diuron
- (en) Kamila Myszka et Katarzyna Czaczyk, « Bacterial Biofilms on Food Contact Surfaces - a Review », Polish Journal of Food and Nutrition Sciences, vol. 61, no 3, (DOI 10.2478/v10222-011-0018-4, lire en ligne, consulté le )
- (en) David J Stickler, « Bacterial biofilms in patients with indwelling urinary catheters », Nature Clinical Practice Urology, vol. 5, , p. 598-608 (DOI 10.1038/ncpuro1231)
- (en) « Microbial Biofilms », Annual Review of Microbiology, vol. 49, , p. 711-745 (PMID 8561477, DOI 10.1146/annurev.mi.49.100195.003431, lire en ligne, consulté le )
- Lopes, S.P.; Ceri, H.; Azevedo, N.F.; Pereira, M.O. (2012) Antibiotic resistance of mixed biofilms in cystic fibrosis: Impact of emerging microorganisms on treatment of infection. Int. J. Antimicrob. Agents, 40, 260–263.
- Römling, U.; Balsalobre, C. (2012 ) Biofilm infections, their resilience to therapy and innovative treatment strategies. J. Intern. Med., 272, 541–561.
- Sun, F.; Qu, F.; Ling, Y.; Mao, P.; Xia, P.; Chen, H.; Zhou, D. (2013) Biofilm-associated infections: Antibiotic resistance and novel therapeutic strategies. Future Microbiol, 8, 877–886 (résumé).
- Hall-Stoodley L, Costerton JW, Stoodley P (2004) Bacterial biofilms: from the natural environment to infectious diseases. Nat. Rev. Microbiol. 2(2): 95-108]
- "Diversification of the AlpB Outer Membrane Protein of Helicobacter pylori Affects Biofilm Formation and Cellular Adhesion."
- "Microbiology - Helicobacter Pylori (Ulcer)"
- "Pasteur contre Béchamp : le combat stérile des partisans"
- "Effect of curcumin on Helicobacter pylori biofilm formation"
- "Probiotic Lactobacillus fermentum UCO-979C biofilm formation on AGS and Caco-2 cells and Helicobacter pylori inhibition"
- "You tube: polyps start as Bacterial Biofilm. What is their growth cycle?"
- "Fusobacterium nucleatum Une bactérie favorise le cancer de l’intestin et son développement"
- "National Cancer Institute:Bacterial Biofilms Provide Clues into Colorectal Cancer Risk"
- "Nbci, 2005:Bacterial biofilm within diseased pancreatic and biliary tracts"
- "Biofilm, l'éradication a commencé"
- "Nbci:Aspergillus fumigatus DBM 4057 biofilm formation is inhibited by chitosan"
- "Youtube:Hospitals Warns of Aspergillus Mold In Homes"
- Costerton, J.W.; Stewart, P.S.; Greenberg, E.P. Bacterial biofilms: A common cause of persistent infections. Science 1999, 284, 1318–1322.
- Sutherland, I. Biofilm exopolysaccharides: A strong and sticky framework. Microbiology 2001, 147, 3–9.
- Lopes, S.P.; Ceri, H.; Azevedo, N.F.; Pereira, M.O. Antibiotic resistance of mixed biofilms in cystic fibrosis: Impact of emerging microorganisms on treatment of infection. Int. J. Antimicrob. Agents 2012, 40, 260–263.
- Römling, U.; Balsalobre, C. Biofilm infections, their resilience to therapy and innovative treatment strategies. J. Intern. Med. 2012, 272, 541–561.
- Zun, F.; Qu, F.; Ling, Y.; Mao, P.; Xia, P.; Chen, H.; Zhou, D. Biofilm-associated infections: Antibiotic resistance and novel therapeutic strategies. Future Microbiol. 2013, 8, 877–886.
- Declerck P (2010) Biofilms: the environmental playground of Legionella pneumophila. Environ Microbiol 12, 557-566.
- Lee HJ, Ho MR, Bhuwan M, Hsu CY, Huang MS, Peng HL, Chang HY (2010) Enhancing ATP-based bacteria and biofilm detection by enzymatic pyrophosphate regeneration. Analytical Biochemistry 399, 168-173
- Murga R, Forster TS, Brown E, Pruckler JM, Fields BS, Donlan RM (2001) Role of biofilms in the survival of Legionella pneumophila in a model potable-water system. Microbiology 147, 3121-3126.
- Moritz MM, Flemming HC, Wingender J (2010) Integration of Pseudomonas aeruginosa and Legionella pneumophila in drinking water biofilms grown on domestic plumbing materials. Int J Hyg Environ Health 213, 190-197.
- Rogers J, Dowsett AB, Dennis PJ, Lee JV, Keevil CW (1994) Influence of temperature and plumbing material selection on biofilm formation and growth of Legionella pneumophila in a model potable water system containing complex microbial flora. Applied and Environmental Microbiology 60, 1585-1592.
- Van der Kooij D, Veenendaal HR, Scheffer WJH (2005) Biofilm formation and multiplication of Legionella in a model warm water system with pipes of copper, stainless steel and cross-linked polyethylene. Water Research 39, 2789-2798
- Renata Behra, "Influence des métaux sur les biofilms d’algues", Eawag News 60f/juillet 2006
- Kaplan, D, Christiaen D & Arad S-M (1987), Chelating properties of extracellular polysaccharides from Chlorella spp. Applied and Environmental Microbiology 53:2953–2956
- Wolfaardt G.M, Lawrence JR, Robarts R.D & Caldwell D.E (1995), Bioaccumulation of the herbicide diclofop in extracellular polymers and its utilization by a biofilm community during starvation. Applied and Environmental Microbiology 61: 152–158
- Beck ., Janssen F & de Beer D (2011), The influence of phototrophic benthic biofilms on Cd, Cu, Ni, and Pb transport in permeable sediments. Biogeochemistry 102: 167–181
- Burkholder J.A.M, Wetzel R.G & Klomparens K.L (1990), Direct comparison of phosphate uptake by adnate and loosely attached microalgae within an intact biofilm matrix. Applied and Environmental Microbiology 56: 2882–2890
- Mulholland, P.J., 1992. Regulation of nutrient concentrations in temperate forest stream: roles of upland, riparian, and instream processes. Limnology and Oceanography 37: 1512– 1526
- Flemming H.C (1995), Sorption sites in biofilms. Water Science and Technology 32: 27–33
- Wanner O, Bauchrowitz M (2006) Les biofilms sont omniprésents. EAWAG News 60 f: 4-7
- (en) Jennifer Leah Tank, « Microbial respiration on decaying leaves and sticks along an elevational gradient of a southern Appalachian stream », (OCLC 26208466)
- thèse intitulée « Microbial activity on wood in streams: Exploring abiotic and biotic factors affecting the structure and function of wood biofilms » (extrait)
- Réseau National Biofilm
- Biofilm - Traitement de Surfaces, Ifremer
- Oskar Wanner (2006), Les biofilms s’opposent à la récupération de chaleur, Eawag News 60e/July 2006, p. 31 à 32
- (en) Dennis Enning et Julia Garrelfs, « Corrosion of iron by sulfate-reducing bacteria : New views of an old problem », Applied and Environmental Microbiology, vol. 80, no 4, , p. 1226-1236 (DOI 10.1128/AEM.02848-13, lire en ligne)
- Monmeyran, A., Thomen, P., Jonquière, H., Sureau, F., Li, C., Plamont, M. A., ... & Henry, N. (2018). The inducible chemical-genetic fluorescent marker FAST outperforms classical fluorescent proteins in the quantitative reporting of bacterial biofilm dynamics. Scientific reports, 8(1), 10336.
Voir aussi
Bibliographie
- (en) Majdi N. (2011). Meiofauna in river epilithic biofilm : Dynamics and trophic relationships (thèse de doctorat en écologie fonctionnelle soutenue le 29 novembre 2011 ; École doctorale, Sciences de l'Univers, de l'Environnement et de l'Espace (SDUEE), unité de recherche EcoLab UMR 5245, Université Paul Sabatier de Toulouse), 176 pp. voir p 27.
- (fr) Briandet R, Feschner L, Naitali M & Dreano C. (2012). Biofilms, quand les microbes s'organisent. Éditions Quae. http://www.quae.com/fr/r1476-biofilms-quand-les-microbes-s-organisent.html
- (fr) Klingler C, Filloux A & et Lazdunski A. (2005). Les biofilms, forteresses bactériennes. La Recherche, 389 pp.
- (en) Lu T. (2008). Combating biofilms and antibiotic resistance using synthetic biology, Massachusetts Institute of Technology.
Articles connexes
Liens externes
- Ressources relatives à la santé :
- (en) Medical Subject Headings
- (cs + sk) WikiSkripta
- Notices dans des dictionnaires ou encyclopédies généralistes :
- Analyse de l'épaisseur, de la proportion minérale et organique du biofilm via une analyse potentiométrique
- Laboratoire de Biotechnologie de l'Environnement de l'INRA
- MICALIS, UMR 1319 INRA Agroparistech, équipe B2HM
- Réseau National Biofilm
- Biofilms 5, 10-12 décembre 2012, Paris
- À propos des biofilms bactériens (docs pdf divers)
- Les sixièmes journées thématiques du RNB : remue-ménage aux interfaces