Méiofaune
Le terme méiofaune a été introduit et défini par Molly F. Mare en 1942[1]. Le terme méio dérive du grec “μειος” qui signifie « plus petit ». Dans ce contexte, la méiofaune fait référence aux petits métazoaires benthiques plus petits que la macrofaune mais plus grands que la microfaune. Pour sa part, le terme méiobenthos se définit comme le compartiment benthique intermédiaire entre le macrobenthos et le microbenthos. Pour de nombreux auteurs, méiobenthos et méiofaune sont synonymes[2] - [3] - [4] - [5]. Conventionnellement, tous les métazoaires qui passent à travers un tamis de maille de 1 mm et qui sont retenus par un tamis de mailles de 42 µm font partie de la méiofaune[4] - [6]. Il est à noter toutefois que plusieurs études utilisent des tamis de maille de 500 µm pour la limite supérieure et de 42 à 20 µm de mailles pour la limite inférieure[2] - [5] - [7] - [8] - [9] - [10].
Pour certains groupes taxonomiques, comme les nématodes, qui peuvent avoir des longueurs corporelles dépassant les 2 mm au stade adulte et qui ne vivent qu’une partie de leur cycle au sein de la meiofaune, il y a chevauchement des limites de tailles. On distingue alors la méiofaune temporaire, ceux qui passent par ce compartiment dans leur phase juvénile et qui termine leur cycle de vie au sein de le macrofaune, et la méiofaune permanente, ceux qui restent tout leur cycle de vie dans ce compartiment. Les métazoaires de la méiofaune (qui comprennent également des protozoaires de grandes tailles comme les foraminifères) ne sont pas seulement un groupe de petits organismes benthiques défini par leur taille, ils partagent entre eux un mode de vie distinctif, des relations écologiques et des traits évolutifs spécifiques[2].
Habitats

La méiofaune se retrouve dans une très grande diversité d’habitats. Ces petits métazoaires vivent en eaux douces (lacs et rivières) comme en milieux marins. On les retrouve à toutes les profondeurs, autant dans l’eau interstitielle entre les grains de sable de la plage que dans les fonds marins, dans les régions polaires et dans les zones équatoriales[3].
La méiofaune se retrouve dans tous les types de substrats meubles (des sédiments vaseux aux plus grossiers), mais aussi sur les surfaces végétales inertes et dans les biofilms sur les roches[11]. Ils occupent aussi d’autres types d’habitats : le système racinaire des végétaux, dans les mousses, sur les thalles des macroalgues, sur les banquises et même sur certaines structures animales comme les coraux, les tubes digestifs de vers et les épines des échinodermes[3].
En milieux marins, des études ont révélé que la méiofaune se retrouve dans les dix premiers centimètres de sédiments[12] et que la majorité se retrouve dans les six premiers centimètres[13]. Lorsqu’ils sont dans les sédiments sableux et vaseux, ils se retrouvent dans les deux à trois premiers centimètres de sédiments[3].
Distribution et structure de la méiofaune
Plusieurs facteurs abiotiques et biotiques agissent en synergie. Ils structurent l’environnement ainsi que les communautés de la méiofaune et déterminent l’abondance et la distribution spatiale de ces petits métazoaires.
Facteurs abiotiques
- Les facteurs océanographiques et hydrodynamiques tels que : l’action des vagues et des marées, la circulation de l’eau, l’exposition aux courants.
- Les facteurs sédimentaires tels que : la granulométrie, la forme et la taille des grains, leur porosité et perméabilité, la composition chimique des sédiments et leur teneur en eau, les conditions géologiques du milieu.
- Les facteurs physico-chimiques tels que : l’oxygène disponible, la salinité, l’oxydoréduction (potentiel redox), la température, la teneur en sulfure d’hydrogène (H2S), le pH et la pollution.
Parmi ces facteurs abiotiques, la taille des grains est un facteur clé puisqu’il détermine la structure spatiale du milieu et, indirectement, les conditions physiques et chimiques qui prévalent dans les sédiments[4] - [6]. C’est la variable naturelle qui influence la distribution et la composition des communautés de la méiofaune en agissant directement ou indirectement sur l’espace interstitiel, le taux d’oxygène et la nourriture disponible dans les sédiments[14]. Ainsi, selon la composition des sédiments, le volume que pourra occuper la méiofaune dans les pores (espaces entre les grains) peut être très réduit (par ex. un mélange de sable, limon et de gravier) ou beaucoup plus grand (sédiments plus grossiers). Certaines études démontrent que la diversité des métazoaires de la méiofaune augmente avec une augmentation de la concentration de grains de grosseurs moyennes[15] - [16] - [17]. De plus, la surface externe et la porosité des sédiments déterminent la surface disponible pour la colonisation par les bactéries, les microchampignons, les diatomées et les microalgues qui sont une source de nourriture pour la méiofaune.
La pollution joue un rôle dans l’abondance et la structure de la méiofaune. L’augmentation des températures et l’eutrophisation engendrent une réduction de l’oxygène disponible et sont associées à une augmentation de sulfure d’hydrogène (H2S) et d’ammoniac dans les sédiments, ce qui réduit l’espace disponible pour la méiofaune[4].
Facteurs biotiques
Les facteurs biotiques qui influencent et structurent les communautés de la méiofaune sont :
- la matière organique particulaire (MOP : détritus et vivant) qui provient surtout des organismes morts du plancton et des détritus du phytoplancton ;
- les biofilms (mucus provenant des microorganismes benthiques et de méiofaune et macrofaune) ;
- la matière organique dissoute (MOD) qui provient surtout des excrétions et de la décomposition des bactéries[18] et l’exsudation des bactéries et des plantes ;
- les bactéries ;
- la microfaune ;
- la macrofaune.
Le mucus et les biofilms produits par les microorganismes forment une matrice dans laquelle les sédiments sont imbriqués, diminuant ainsi le flux d’érosion et de suspension de la méiofaune, ce qui permet une stabilisation du milieu benthique et une favorise la colonisation par la méiofaune[2].
Abondance et biodiversité
Les niveaux d’abondances les plus élevés de la méiofaune se retrouvent dans les estuaires vaseux intertidaux, alors que les niveaux les plus bas sont typiques des fonds marins[2] - [7] et ce dans tous les types de milieux, partout à travers le monde, peu importe la région climatique[5].
Dans les fonds marins, la méiofaune représente le groupe de métazoaires benthiques le plus abondant. On estime à près de 105-106 individus par mètre carré, ce qui représente une biomasse de 1-2 dW/m2[4]. La biomasse et l’abondance de la méiofaune varient naturellement selon la saison, la latitude, la profondeur, les marées, la taille des grains du substrat, le type d’habitat, la nourriture disponible et beaucoup d’autres facteurs abiotiques et biotiques présents dans l’écosystème.
Les taux les plus élevés d’abondance et de biodiversité de la méiofaune se retrouvent dans les premiers centimètres de sédiments, c'est-à-dire ces zones où les sédiments sont les mieux oxygénés et dépourvus de sulfure[3].
La macrofaune peut aussi jouer un rôle dans l’abondance et la structure de la communauté de la méiofaune en créant une pression de prédation et de la bioturbation, en réduisant la quantité de nourriture disponible, en modifiant la qualité de l’habitat et la stabilité des sédiments[19].
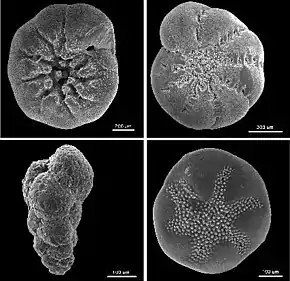
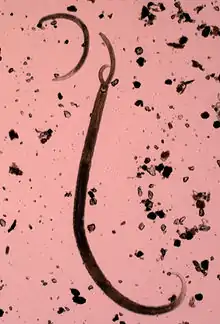
La meiofaune est un groupe hétérogène. Ce groupe est le plus diversifié de tous les composants du biotope marin[2]. Ainsi, 24 phyla du règne animal sur 35 sont présents dans la méiofaune. Les taxons les plus représentés par la méiofaune sont les Foraminifera, les Proseriata, les Gastrotricha Chaetonotida, les Nematoda, les Kinorhyncha, les Tardigrada et les Copepoda Harpacticoida. Les nématodes, les foraminifères et les copépodes sont les taxons les plus abondants au sein de la méiofaune. Des études archéologiques révèlent que la composition de la méiofaune est restée inchangée depuis au moins la période du Trias moyen, soit il y a 250 millions d’années[20].
Parce que les métazoaires de la méiofaune ont besoin d’une certaine stabilité du milieu afin de s’établir, la biodiversité et l’abondance est plus faible dans certains types de milieux perturbés (sources hydrothermales, pollution due aux activités anthropiques)[7]. Aussi, dans les milieux plus difficiles tels que les canyons et les fonds marins, l’abondance et la biodiversité de la méiofaune sont moindre.
Les espèces de la méiofaune diffèrent selon les milieux. Celles qui vivent dans l’eau de mer ne se retrouvent pas en eaux douces. Les Kinorhyncha préfèrent vivre dans des sédiments où la grosseur moyenne des grains est plus petite que 125 μm, alors que celle des Gastrotricha et les Tardigrada est entre 125 μm et 500 μm[2].
Adaptations
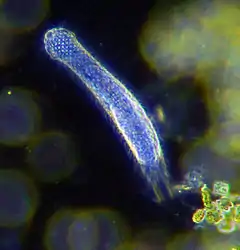
Étant donné la très grande diversité des habitats et l’hétérogénéité au sein de la méiofaune, il y a peu d’adaptations morphologiques partagées par tout le groupe. Elles sont surtout représentées par ceux qui vivent dans l’eau interstitielle des sédiments[2] - [4]. Ainsi, pour bouger et vivre dans des espaces restreints, comme entre des grains de sable, les métazoaires benthiques ont développé des adaptations morphologiques telles que : la miniaturisation, la simplification du corps jusqu’à la perte d’organes, l’amincissement, l’élongation et une très grande souplesse du corps, des organes mécaniques ou glandulaires adhésifs pour l’ancrage aux sédiments et une longue queue postérieure. Ce sont des adaptations essentielles pour des habitats soumis à un fort hydrodynamisme.
Pour augmenter l’adhérence aux sédiments, les animaux de la méiofaune ont développé des dispositifs d’ancrage tel que des plaques externes rigides chitineuses, des appendices, des coquillages et des anneaux. Pour un mode de locomotion plus efficace, la sécrétion de mucus, la ciliation (Gastrotricha), les épines (Kinorhyncha) et le développement d’une musculature appropriée permettent une meilleure adaptation aux conditions particulières du milieu[2] - [4]. L’aplatissement du corps permet aussi un plus grand rapport surface/volume pour la diffusion de l’oxygène et une plus grande surface d’absorption pour les éléments nutritifs[4].
De plus, ces petits métazoaires de la méiofaune ont des structures de protection et de renforcement contre le stress mécanique, la pression et l’agitation des sédiments. Il y a une réduction de la pigmentation du corps et des photorécepteurs pour ce groupe, contrairement à d’autres groupes épibenthiques. Aussi, ils sont dotés d’organes qui permettent l’orientation en trois dimensions dans ce système homogène[2] - [4].
Rôles écologiques de la méiofaune
- La méiofaune améliore la minéralisation et la régénération des nutriments en stimulant l’activité bactérienne. La méiofaune stimule l’activité bactérienne par la sécrétion de substrat pour les bactéries (excrétion de nutriments, mucus), en créant de la bioturbation et par prédation[3].
- Elle sert de nourriture aux niveaux trophiques supérieurs.
- Elle est un intermédiaire trophique assurant le lien entre les producteurs primaires et les niveaux trophiques supérieurs.
- Elle démontre une sensibilité aux polluants qui permet de l’utiliser comme bioindicateur.
Bioindicateur
Parce qu’ils sont hydrophobes et lipophiles, plusieurs polluants ont une grande affinité pour les particules et surtout pour les sédiments en milieu aquatique. Ils peuvent se lier avec les limons en suspension, aux argiles et aux particules organiques, notamment les polluants organiques comme les HAP (hydrocarbures aromatiques polycycliques). Dans un milieu aqueux, les contaminants séquestrés dans les sédiments vaseux prennent jusqu’à dix fois plus de temps à se dégrader[3].
Les métazoaires de la méiofaune sont considérés comme de bons bioindicateurs d’impact des polluants : ce sont des organismes ubiquistes, ils sont abondant en nombre et en espèce, ils sont de petites tailles, leurs métabolismes est élevé, leurs cycles de reproduction courts, ils vivent dans les sédiments et parce que certains taxons sont sensibles à plusieurs substances toxiques[21].
Par exemple : dans les sédiments pollués, caractérisés par un potentiel redox bas, les niveaux d’abondances de la méiofaune sont plus bas et des taxons comme les Kinorhyncha et les Tanaidacea en sont absents, alors qu’ils sont présents dans le même type de milieu mais non pollué. Par contre, les genres dans les nématodes : Terschellingia spp., Sabatiera spp., Paracomesoma spp et Daptonema ssp. se retrouvent en plus grande abondance dans les milieux perturbés. Ainsi, le genre Sabatieria peut survivre dans un environnement présentant un taux faible en oxygène mais une concentration élevée en sulfures[3].
Notes et références
- Mare, M.F. (1942) A study of a marine benthic community with special reference to the micro-organisms. Journal of the Marine Biological Association of the United Kingdom, 25: 517-554.
- Balsamo, M., G. Albertilli, V.U. Ceccherelli, R. Coccioni, M.A. Colangelo, M. Curini-Galletti, R. Danovaro, R. D’Addabbo, C. De Leonardis, M.Fabiano, F. Frontalini, M. Gallo, C. Gambi, L. Guidi, M. Moreno, A. Pusceddu, R. Sandulli, F. Semprucci, M.A. Todaro, P. Tongiorgi. (2010). Meiofauna of the Adriatic Sea: present knowledge and future perspectives. Chemistry and Ecology. Vol. 26, Supplement, June 2010, 45–63.
- Coull, B.C., 1999. Role of meiofauna in estuarine soft-bottom habitats. Aust. J. Ecol. 24, 327–343.
- Giere, Olav (2009). Meiobenthology. The microscopic motile fauna of aquatic sediments, 2nd edition, Springer
- Soltwedel, T. (2000): Metazoan meiobenthos along continental margins: a review. Prog. Oceanogr., 46, 59–84.
- Higgins, R.P. and Thiel, H. (1988) Introduction to the study of meiofauna. Smithsonian Institution Press, Washington D.C.
- Bianchelli S, Gambi C, Zeppilli D, Danovaro R (2009) Metazoan meiofauna in deep-sea canyons and adjacent open slopes: A large-scale comparison with focus on the rare taxa. Deep Sea Res I 57: 420–433.
- Brandt, A. et al.(2007). The biodiversity of the deep Southern Ocean benthos. Phil. Trans. Roy. Soc. B 362, 39–66.
- Moreno, M., Vezzulli, L., Marin, V., Laconi, P., Albertelli, G. & Fabiano, M. (2008) The use of meiofauna diversity as an indicator of pollution in harbours. ICES Journal of Marine Science, 65, 1428-1435.
- Pusceddu A, Gambi C, Zeppilli D, Bianchelli S, Danovaro R (2009) Organic matter composition, metazoan meiofauna and nematode biodiversity in Mediterranean deep-sea sediments. Deep-Sea Research Part II 56: 755–762.
- Majdi, Nabil (2011), thèse d’État : La méiofaune du biofilm épilithique de rivière : dynamique et interactions trophiques ; Laboratoire d'Ecologie Fonctionnelle et environnement (EcoLab), mai 2012, 176 pp (résumé)
- Danovaro, R., M. Fabiano, G. Albertelli & N. Della Croce (1995) Vertical distribution of meiobenthos in bathyal sediments of the Eastern Mediterranean Sea: relationship with labile organic matter and bacterial biomasses. PSZNI: Marine Ecology, 16(2), 103-116.
- Danovaro, R., Della Croce, N., Eleftheriou, A., Fabiano, M., Papadopoulou, N., Smith, C., & Tselepides, A. (1995). Meiofauna of the deep Eastern Mediterranean Sea: distribution and abundance in relation to bacterial biomass, organic matter composition and environmental factors. Progress in Oceanography, 36, 329–341.
- Semprucci, F., P. Boi, A. Manti, A. Covazzi Harriague, M. Rocchi, P. Colantoni, S. Papa, and M. Balsamo. (2010) Benthic communities along a littoral of the Central Adriatic Sea (Italy), Helgoland Mar. Res., Helgol Mar Res 64:101–115
- Heip C, Vincx M, Vranken G (1985) The ecology of marine nematodes. Oceanogr Mar Biol Annu Rev 23:399–489
- Steyaert M, Garner N, Gansbeke D, Vincx M (1999) Nematode communities from the North Sea: environmental controls on species diversity and vertical distribution within the sediment. J Mar Biol Assoc U K 79:253–264
- Van Oevelen D, Moodley L, Soetaert K, Middelburg JJ (2006) The trophic significance of bacterial carbon in a marine intertidal sediment: results of an in situ stable isotope labeling study. Limnol Oceanogr 51: 2349–2359.
- Kuhnert, J., Gritta Veit-Köhler, Marco Büntzow, Nils Volkenborn. (2010). Sediment-mediated effects of lugworms on intertidal meiofauna. Journal of Experimental Marine Biology and Ecology, Volume 387, Issues 1-2:36-4.3
- Knaust, D. (2010). Remarkably preserved benthic organisms and their traces from a Middle Triassic (Muschelkalk) mud flat. Lethaia, 43
- Guo, Y., Somerfield, P. J., Warwick, R. M., and Zhang, Z. (2001). Large-scale patterns in the community structure and biodiversity of the free living nematodes in the Bohai Sea, China. Journal of the Marine Biological Association of the UK, 81: 755–763