Chlororésistance
La notion de chlororésistance recouvre tous les phénomènes de survie de microbes ou d'autres espèces au chlore libre ou associé à d'autres molécules (hypochlorite de sodium de l'eau de Javel par exemple), qu'il s'agisse d'espèces pathogènes ou non. Elle peut apparaitre chez certaines souches de micro-organismes, à certaines doses ou dans certaines conditions (effets synergiques).
A priori trois phénomènes peuvent exister ou coexister :
- une résistance naturelle augmentée en phase de sporulation ;
- une résistance individuelle et de groupe acquise par modification/mutation du génome et sélection adaptative ;
- une résistance coloniale acquise par formation de biofilms protégeant au moins une partie des bactéries et organismes présents dans le biofilm[1].
Le transfert horizontal de gènes étant commun chez les bactéries, on peut supposer, que dans un milieu régulièrement exposé au chlore, le transfert de gènes de résistance soit possible, au moins au sein des biofilms ou de structures coloniales.
On parle de Chlorosensibilité pour la mesure de la vulnérabilité d'un organisme au chlore[2], lui-même quantifié dans l'eau de javel par exemple par un degré chlorométrique (nombre de litres de chlore gazeux, mesurés à 0 °C et 760 mmHg, nécessaires pour fabriquer un litre d'eau de Javel). Certains microbes sont naturellement plus résistants au chlore que la moyenne, ont par exemple Escherichia coli qui sert pour cette raison dans certains tests appréciant la qualité d'une désinfection au chlore. Par ailleurs, le pH et la température de la solution chlorée modifient fortement le pouvoir désinfectant de produits tels que l'eau de Javel[2]. Les désinfectants utilisant le chlore actif sont souvent proposés à des pH alcalins ou tamponnés afin d'être moins corrosifs qu'en cas d'utilisation d'eau de Javel pure, et afin d'obtenir une plus grande stabilité du chlore[2]. Le chlore en solution alcaline agit dès une concentration de quelques ppm sur les bactéries, mais nécessite jusqu'à 50 ppm pour détruire les spores de bactéries, plus résistants[2].
Enjeux
Ce sont :
- des enjeux de connaissance et de recherche scientifique fondamentale et appliquée ;
- des enjeux économiques (l'eau de Javel est le désinfectant le plus utilisé et très peu coûteux, il convient donc de ne pas faciliter ou encourager la diffusion de souches chlororéistantes de pathogènes) ;
- des enjeux de qualité microbiologique des eaux potables et donc de santé publique et de veille sanitaire. L'eau potable est relativement bien désinfectée par la chloration permanente, mais elle est d'autant plus vulnérable en cas d'interruption de la chloration, que cette dernière a éventuellement favorisé des mécanismes de résistance chez des espèces pathogènes cachées dans le biofilm, et d'autant que la chloration ne saurait en aucun cas détruire les biofilms qui se sont développés sur toutes les parois des canalisations de distribution d'eau et qui constituent en réalité l'essentiel de la biomasse bactérienne du réseau de distribution [3];
Même dans des réseaux de distribution d'eau « constamment chlorés, le biofilm peut représenter jusqu'à 107 bactéries par cm2 dont 1 % sont viables et capables de se multiplier, prouvant l'inefficacité réelle du traitement sur ces biomasses fixées » [3]; - des enjeux de maitrise des risques nosocomiaux ;
- des enjeux environnementaux, car on peut supposer que si des souches microbiennes chlororésistantes et pathogènes ou indésirables se diffusent dans l'environnement, la quantité de désinfectants chlorés utilisée risque d'augmenter, ainsi que les concentrations, avec le risque d'une contamination environnementale plus grande, ou de quantité présente dans les déchets à incinérer plus grande (au risque de produire plus de dioxines, furanes et autres organochlorés.
Éléments d'explication
La plupart des microbes ne sont pas dans leur environnement extérieur confrontés au chlore, qui est un puissant oxydant, fortement antibiotique. Néanmoins, ceux qui infectent les organismes y sont confrontés, car la production de chlore est l'un des moyens dont dispose le système immunitaire pour éliminer les microbes pathogènes qui infectent l'organisme animal. On connait aussi au moins une espèce d'éponge marine qui produit un organochloré qui semble pouvoir expliquer pourquoi elle n'est jamais recouverte par des algues ou d'autres organismes encroutant. Une bactérie stressée (et l'exposition au chlore est un puissant facteur de stress) peut échanger des gènes de résistance avec d'autres bactéries de la même famille, voire avec des bactéries non apparentées.
Exemples de chlororésistances
Chez la bactérie Escherichia coli


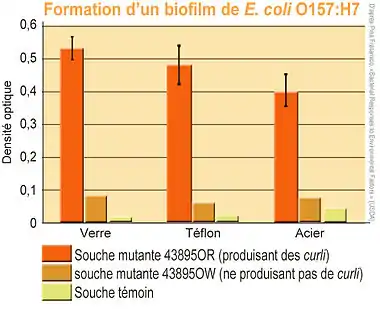
Certaines souches mutantes d' Escherichia coli peuvent former des biofilms et produire une coque de polysaccharides leur permettant de résister au chlore [4].
Escherichia coli O157:H7 est pour cette raison un sérotype particulièrement surveillé car présente chez les bovins d'élevage, et responsable de plusieurs pathologies graves (colite hémorragique, syndrome hémolytique et urémique (SHU), purpura thrombotique thrombocytopénique (PTT)) et souvent potentiellement mortelle.
Or, plusieurs souches mutantes (ATCC 43895-, 43895-EPS (qui surproduit un exopolysaccharide [EPS]), et ATCC 43895+ ) présentent des bactéries de plus en plus résistantes au chlore qui est un désinfectant couramment utilisé dans l'industrie agroalimentaire (à faible doses, mais autrefois supposées suffisantes pour désinfecter des salades ou des poulets par exemple).
De plus, on a constaté dans les années 1990 l'apparition de souches mutantes, qui in vitro (en culture de laboratoire) comme dans le milieu industriel, - dès lors qu'elles disposaient de nourriture - colonisaient spontanément des surfaces inerte réputées faciles à désinfecter (inox par exemple), ce qu'elle ne font pas dans la nature, en y produisant des biofilms [5]. Elles peuvent alors former un biofilm épais, visible à l'œil nu, sur le parois du milieu de culture. Or on sait que les biofilms rendent les colonies bactériennes moins sensible à tous les désinfectants connus.
- On a en France à la fin des années 1990 trouvé et séquencé une souche mutante qui a acquis la capacité à coloniser des surfaces lisses et hydrophiles (verre) ainsi que des surfaces hydrophobes (polystyrène) en y formant des amas d'agrégation[5]. L'analyse génétique de cette souche a montré qu'une seule mutation ponctuelle (remplacement d'une leucine par un résidu arginine en position 43 dans la protéine de régulation OmpR [5]) a suffi à créer ce phénotype adapté à la plupart des milieux artificiels de l'environnement industriel agroalimentaire ou des laboratoires. La microscopie électronique a permis d'identifier le mécanisme d'adhésion. Il est lié à une capacité nouvelle de la membrane de la bactérie mutante à produire des structures fibrillaires de type fimbriae dite curli. Les curli ont été découverts pour la première fois chez des entérobactéries (dans les années 1980 et justement sur des souches d' Escherichia coli qui causaient des mammites chez les bovins.
Ces curli avaient été décrits par l'équipe d'Olsen dix ans plus tôt dans le Journal Nature [6]. Ils se sont avérés impliqués dans de nombreux processus pathologiques et de résistance par formation de biofilm, chez des E. Coli, mais aussi chez des Salmonella spp.
Chez les E Coli mutantes, La production de curli (visualisée par coloration au rouge Congo) et l'expression du gène impliqué étaient significativement augmentée en présence de l'allèle ompR, et l'inhibition des gènes impliqués (ACPS ou ompR) par transduction de mutations knock-out de ces gènes se traduisait bien par une perte des propriétés adhésive de ces E. Coli ainsi que de leur capacité à former des biofilms, y compris pour toutes les souches isolées dans des réacteurs de culture en laboratoire, ou pour les souches cliniques isolées chez des patients ayant développé des infections liées aux cathéters[5]. Ceci montre que les structures morphologiques de type curli sont d'une importance majeure pour la production de biofilms[5], qui est elle-même une des composantes majeures de la chlororésistance. - L'autre composante de la chlororésistance chez E. Coli, vient d'une mutation lui conférant la capacité de produire en quantité importante un manteau d'exopolysaccharide [EPS], un polymère de sucres qui permet par exemple aux souches mutantes d'Escherichia coli O157: H7 ATCC 43895 -, 43895-EPS qui surproduit l'EPS t à la souche ATCC 43895 + (qui en plus produit des curli une résistance au chlore). La chlororéistance observée en laboratoire, en culture libre de type planctonique (env. 9 log (10) UFC/ml), est la plus élevée qu'on ait trouvé chez E. Coli selon les publications disponibles, ce qui laisse penser que l'EPS et la production de curli sont bien les deux principaux facteurs de chlororésistance chez E. Coli. Néanmoins, dans ce cas, c'est-à-dire en l'absence de biofilm, les cellules planctoniques (de toutes les souches) ont fini par mourir dans les 10 minutes lorsqu'exposées à un traitement fortement chloré (dosé à 50 µg de chlore par millilitre). Il faut cependant beaucoup plus de chlore celui nécessaire à tuer la souche la souche ATCC 43895 lorsqu'elle est fixée en biofilm sur des échantillons d'inox.
Le taux de croissance de la souche 43895-EPS sur les coupons n'était cependant pas significativement différent de celui de la souche ATCC 43895-, ce qui indique que la production de BPA n'a pas affecté la croissance des cellules au cours de la formation du biofilm[5]. La production de curli n'affecte pas la fixation initiale de cellules à une paroi lisse (morceau d'inox en l'occurrence) mais améliore la production de biofilm[5].
Sur les surfaces lisses ou rugueuses, la résistance de E. coli O157: H7 au chlore augmente fortement quand les cellules y ont formé un biofilm, et à la fin des années 1998, parmi les souches testées, c'est la souche ATCC 43895 + qui était la plus chlororésistante. La taille des populations bactériennes de souches ATCC 43895+ et ATCC 43895 - dans le biofilm formé à 12 °C - n'était pas significativement différentes, mais les cellules de la souche ATCC 43895 + se sont montrées plus chlororésistantes que les cellules de la souche ATCC 43895 -, ce qui confirme l'hypothèse que la production d'EPS augmente la chlororésistance de E. coli O157: H7 développant des curli, d'où l'intérêt de mieux comprendre la biogenèse et le fonctionnement des curli [7], d'autant qu'ils jouent un rôle dans la pathogénicité de nombreuses bactéries, via leur capacité de s'attacher à leur hôte et d'y pénétrer[8], et qu'ils pourraient être un modèle pour mieux comprendre le phénomène d'attachement [9] aux parois cellulaires ou non biologiques (pour les prions par exemple[10]), même si l'inactivation des curli doit être envisagée avec précaution, car potentiellement nécessaire ou impliqué dans de nombreux processus symbiotiques ou endosymbiotiques, dans l'intestin ou d'autres processus biologiques.
Chez les virus
Les norovirus peuvent présenter une certaine résistance au chlore, dont dans une piscine dont le processus de chloration serait défectueux ou mal géré[11])
Voir aussi
Articles connexes
Références
- Goeres, D. M., Palys, T., Sandel, B. B., & Geiger, J. (2004). Evaluation of disinfectant efficacy against biofilm and suspended bacteria in a laboratory swimming pool model. Water research, 38(13), 3103-3109 (résumé)
- Hygiène dans l'industrie alimentaire (L'). Les produits et l'application de l'hygiène ; Étude FAO / Production et santé animales 117 ; voir le Chap III. Les désinfectants ; (ISBN 92-5-203169-3)
- La qualité de l'eau et assainissement en France : Rapport de l'OPECST n° 2152 (2002-2003) de M. Gérard MIQUEL, fait au nom de l'Office parlementaire d'évaluation des choix scientifiques et techniques (PDF, 2,2 mégaoctets) , déposé le 18 mars 2003, Voir Annexe 69 - Les membranes et l'eau potable, consulté 2011/02/27
- Biofilm formation by Escherichia coli O157:H7 on stainless steel: effect of exopolysaccharide and Curli production on its resistance to chlorine. Ryu JH, Beuchat LR. Appl Environ Microbiol. 2005 Jan; 71(1):247-54. ([Résumé])
- Olivier Vidal, Robert Longin, Claire Prigent-Combaret, Corinne Dorel, Michel Hooreman, et Philippe Lejeune ; Isolation of an Escherichia coli K-12 Mutant Strain Able To Form Biofilms on Inert Surfaces: Involvement of a New ompR Allele That Increases Curli Expression ; J Bacteriol. 1998 May; 180(9): 2442–2449. PMCID: PMC107187, American Society for Microbiology (Article complet)
- (A. Olsen, A. Jonsson, et S. Normark, Nature 338:652-655 , 1989)
- Barnhart MM, Chapman MR. ; Curli biogenesis and function. ; Annu Rev Microbiol. 2006;60:131-47.
- Curli fibers mediate internalization of Escherichia coli by eukaryotic cells. Gophna U, Barlev M, Seijffers R, Oelschlager TA, Hacker J, Ron EZ. Infect Immun. 2001 Apr; 69(4):2659-65.(Résumé)
- Epstein EA, Chapman MR ; Polymerizing the fibre between bacteria and host cells: the biogenesis of functional amyloid fibres. Cell Microbiol. 2008 Jul; 10(7):1413-20. Epub 2008 Mar 26. (Résumé)
- Wang X, Chapman MR Curli provide the template for understanding controlled amyloid propagation. . Prion. 2008 Apr; 2(2):57-60. Epub 2008 Apr 5. (Résumé)
- Podewils, L. J., Zanardi Blevins, L., Hagenbuch, M., Itani, D., Burns, A., Otto, C., ... & Widdowson, M. (2007). Outbreak of norovirus illness associated with a swimming pool. Epidemiology and infection, 135(05), 827-833. (résumé