Parodontite
La parodontite consiste en une inflammation du parodonte, c'est-à-dire des tissus de soutien de l'organe dentaire : la gencive, le cément, le ligament alvéolo-dentaire et l'os alvéolaire.

| Causes | Actinobacillus actinomycetemcomitans (d), Porphyromonas gingivalis, Peptostreptococcus micros (d), Eikenella corrodens, Tannerella forsythia, Treponema denticola (en), Fusobacterium nucleatum, Prevotella intermedia (en), Prevotella nigrescens (en), Parvimonas micra (en), Campylobacter gracilis (d), Campylobacter rectus (en), Eubacterium nodatum (en), Campylobacter consisus (en), Enterococcus faecalis V583 (d) ou fumer |
|---|
| Médicament | Peroxyde de carbamide, minocycline, chlorhexidine, amoxicilline et métronidazole |
|---|---|
| Spécialité | Parodontie et odontologie |
| CISP-2 | D82 |
|---|---|
| CIM-10 | K05.2 - K05.3 |
| DiseasesDB | 29362 |
| MedlinePlus | 001059 |
| MeSH | D010518 |
![]() Mise en garde médicale
Mise en garde médicale
La parodontite est une forme de maladie parodontale, au même titre que la gingivite.
Les parodontites sont diagnostiquées grâce à un examen clinique associé à un examen radiographique étendu (le bilan radiographique long-cône).
On est en présence d'une parodontite s'il y a concomitamment formation de poche + perte d'attache. Afin de mesurer la profondeur des poches, le dentiste utilise une sonde qu'il glisse entre la gencive et la dent.
La parodontite s'accompagne d'une perte osseuse, appelée alvéolyse (ce qui signifie « destruction de l'os alvéolaire »).
Épidémiologie
Il s'agit d'une maladie fréquente, concernant par exemple plus de la moitié des Anglais de plus de 65 ans[1].
Elle est souvent associée avec d'autres maladies chroniques, comme le diabète de type 2[2], la polyarthrite rhumatoïde[3], les maladies cardiovasculaires[4], relevant probablement du même mécanisme inflammatoire[1].
Symptômes
La parodontite s'accompagne généralement de signes visibles[5] - [6] :
- gingivite : inflammation de la gencive, très souvent associée à des saignements ;
- « déchaussement » des dents, c'est-à-dire que l'os de soutien de la dent perd de la hauteur, la dent apparaît plus longue. Ceci doit être un signe d'alerte pour consulter un dentiste ;
- mobilités dentaires anormales. C'est souvent le signe le plus inquiétant ;
- apparition de « trous noirs » entre les dents ;
- parfois d'hypersensibilité dentaire aux collets des dents.
Étiologie
La parodontite semble d'abord due à la plaque dentaire, constituée de bactéries[5], de protozoaires, de cellules inflammatoires et parfois de champignons[7] - [8] - [9].
La parodontite correspond à un changement dans la population microbienne de la bouche, associée à sa formation d'une lésion inflammatoire.
Ce changement est caractérisé par le passage d'un microbiote de type Gram-positif sain, à un microbiote de type Gram-négatif hautement pathogène[5]. Si ce microbiote gram négatif comprend au moins 300 espèces différentes de microbes, seules quelques espèces microbiennes semblent impliquées dans les maladies de destruction parodontale. On soupçonne en particulier les membres des genres Porphyromonas, Bacteroides, Fusobacterium, Wolinella, Actinobacillus, Capnocytophaga et Eikenella. Des microbes appartenant aux genres Actinomyces et Streptococcus peuvent être impliqués dans la progression microbiennes, mais ne semblent pas essentiels à la production d'une matrice (plaque) sous-gingivale pathogène.
On observe une fluctuation temporelle des membres du microbiote pathogène et lésionnel. Elle semble liée aux interactions physiques entre les microbes habitant les poches parodontales, ainsi qu'au devenir des produits métaboliques finaux des espèces correspondantes. Ces métabolites seraient intimement impliqués dans la progression de la parodontite, qui semble à la fois résulter de l'action des produits finaux du métabolisme des procaryotes et de la destruction des tissus de l'hôte par des enzymes protéolytiques excrétés par plusieurs des espèces parodontopathogènes. Ces dernières peuvent attaquer directement les tissus hôtes par digestion protéolytique. Mais elles disposent aussi d'autres de « facteurs de virulence ». Leurs lipopolysaccharides (endotoxines), certaines protéines (dont peut être certaines lipoprotéines de Bacteroides forsythus[10]) de la membrane externe, des vésicules, des toxines, des enzymes agissent (directement et indirectement) en activation diverses macromolécules destructrices pour l'hôte.
Plusieurs de ces facteurs de virulence semblent étroitement contrôlés par l'expression de facteurs de l'hôte (par exemple, l'hémine).
Ces phénomènes sont difficiles à modéliser et reproduire in vitro[11]. Si le nombre de microbes nécessaires à la maladie est faible, on peut imaginer un vaccin (qui fait l'objet de recherche[12]).
Dans la bouche, une tréponème (bactérie spirochète), Treponema denticola (autrefois classée anaérobie obligatoire, mais qui s'est avéré être aérobie facultatif) est un pathogène parodontal reconnu. Il est capable (y compris in vitro) de constituer et entretenir des micromilieux anaérobies qui lui sont favorables ainsi qu'à d'autres pathogènes de la bouche[13].
Une forte corrélation a aussi été documentée en microscopie optique dans le biofilm parodontal avec les protozoaires Entamoeba gingivalis et Trichomonas tenax pendant la maladie parodontale[14].
C'est donc en éliminant la plaque dentaire par une bonne hygiène bucco-dentaire (brossage très minutieux et adapté) que l'on peut le mieux prévenir la parodontite. Cependant, c'est l'association de plusieurs facteurs de risque, probablement encore incomplètement connus, qui va favoriser l'apparition des premières lésions.
Facteurs de risque
- Facteurs génétiques (héréditaire) : défauts de fibroblastes et anomalies des tissus épithéliaux et conjonctifs ; déficience de la phosphatase alcaline ; défaut fonctionnel des polymorphonucléaires ; excès de production des cytokines ;
- facteurs hormonaux : au cours de la vie génitale de la femme, de nombreuses variations hormonales liées à la grossesse peuvent avoir des répercussions au niveau de la cavité buccale en général et au niveau du parodonte en particulier[5] - [15] - [16] ;
- facteurs environnementaux
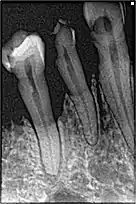 La perte osseuse chez un fumeur
La perte osseuse chez un fumeur
- tabac : facteur de risque majeur. Le tabac, en entraînant une mauvaise vascularisation de la gencive, va énormément influencer l'apparition des premières lésions en diminuant les défenses immunitaires. La consommation du tabac intervient sur la prévalence et la sévérité des parodontites de l'adulte, ainsi que sur les parodontites réfractaires et la gingivite ulcéronécrotique[5] - [17],
- médicaments : certains médicaments ont des effets indésirables, par exemple certains anxiolytiques qui vont entraîner une sécheresse buccale,
- le stress[18] : depuis les années 1950, les facteurs émotionnels, et le stress psychologique survenant lors des différentes situations difficiles de la vie, ont été identifiés comme des facteurs de risque des maladies parodontales. En effet, il influe directement sur la qualité de la défense immunitaire,
- la malnutrition,
- certaines maladies systémiques ;
- facteurs locaux :
- restauration dentaire inadaptée : une couronne ou une obturation débordante favorisera l'accumulation de plaque dentaire et augmentera les risques d'agressions de la gencive,
- problèmes occlusaux,
- parafonctions,
- présence de tartre.
Classification
La classification des maladies parodontales a été révisée en 1999 par un groupe de travail international[19] :
- parodontite chronique (anciennement « parodontite de l'adulte ») :
elles sont caractérisées par la formation de poches et/ou par des rétractions gingivales. Elles sont reconnues comme la plus fréquente des formes de parodontites. Elles peuvent apparaître à n’importe quel âge, mais sont plus communes chez l’adulte. Leur prévalence et leur sévérité augmentent avec l’âge. Elles peuvent affecter un nombre variable de dents et présenter différentes vitesses de progression. Les parodontites chroniques sont initiées et entretenues par le biofilm bactérien dentaire, cependant, les mécanismes de défense de l’organisme jouent un rôle prépondérant dans leur pathogenèse. Les caractéristiques cliniques suivantes participent au diagnostic des parodontites chroniques :- prévalence plus importante chez l’adulte, mais peut affecter les enfants et les adolescents,
- ampleur de la destruction en accord avec la présence de facteurs locaux,
- fréquente présence de tartre,
- associées avec divers tableaux microbiens,
- progression lente à modérée, mais possibilités de périodes de progression rapide,
- peuvent aussi être classées selon l’étendue et la sévérité,
- peuvent être associées avec des facteurs locaux prédisposant (en rapport avec les dents ou des facteurs iatrogènes),
- peuvent être modifiées par et/ou associées à des maladies systémiques (diabète, infection VIH),
- peuvent être modifiées par d’autres facteurs que systémiques comme le tabagisme et le stress émotionnel ;
- parodontite agressive (anciennement, « parodontite à progression rapide » ou « parodontite juvénile », « parodontite prépubertaire ») :
selon la classification des maladies parodontales, les parodontites agressives sont systématiquement caractérisées par une perte d’attache et une destruction osseuse rapides ainsi que par une agrégation familiale. Les facteurs suivants sont également généralement observés :- la quantité de dépôts microbiens ne correspond pas à la sévérité de la destruction parodontale,
- une grande quantité d’Aggregatibacter actinomycetemcomitans et, dans certaines populations, de Porphyromonas gingivalis,
- anormalité des cellules phagocytaires,
- la progression de la perte d’attache et de la perte osseuse peut s’arrêter d’elle-même,
- …
Microscopie du biofilm

Une autre ligne de pensée a été présentée au début des années 1900. Celle-ci veut qu’à partir de l’examen microscopique du biofilm existe une corrélation de 100% entre la présence de l’amibe Entamoeba gingivalis et la maladie parodontale active appelée alors pyorrhée[7]. Cette notion a été mise en valeur un demi-siècle plus tard et corroborée en démontrant que le biofilm de la santé gingivale est constitué en grande majorité de bactéries non motiles[20], que la gingivite présente en majorité des bactéries motiles de type bacilles, spirillés et vibrions, accompagnés par un nombre important de leucocytes PMN et enfin que la parodontite procède d’un état bactérien semblable à la gingivite en ajoutant la présence inconditionnelle du protozoaire Entamoeba gingivalis, parfois celle de Trichomonas tenax et un nombre plus qu'important de granulocytes[21]. Cette théorie appliquée dans les années 1980 par un dentiste canadien permet de confirmer selon lui la guérison parodontale en retrouvant, grâce à des méthodes d’hygiène et de pharmaceutique, un biofil commensal constitué en grande majorité de bactéries cocoides et divers filaments immobiles avec l’absence de leucocytes[22] - [23] - [14] - [8]. Cette corrélation microscopique a dernièrement été confirmée par les études de biologie moléculaire PCR sur la présence de ce protozoaire dans les cas de maladie parodontale et son absence dans la situation de santé gingivale, même locale[9]. Cette technique antiparasitaire proposée en tant que thérapie efficace pour vaincre la parodontite est fondée sur le processus de phagocytose du noyau du leucocyte PMN par l’amibe relarguant ainsi une cellule énuclée déversant son contenu d’enzymes protéolytiques sur les tissus environnants à l’image de l’abcès amibien du foie à la façon d’Entamoeba histolytica considéré pathogène dans la dysenterie amibienne[24]. Elle a l’avantage en même temps d’éliminer les bactéries pathogènes concomitantes aux protozoaires, puissent ils être a minima vus comme des cibles facile à visualiser par le praticien dentiste et le patient. Ce processus dit d'exonucleophagie serait à l'origine d'une détérioration locale hors contrôle du système immunitaire dans la poche parodontale et possiblement des péri-implantites, par suite de la présence systématique du protozoaire et de ces cellules fantômes évidées de leur noyau alors incapable de poursuivre leur activité de défense "NETS". Les premières données sur un tel traitement antiparasitaire semblent efficaces à pouvoir cicatriser le sillon parodontal[25].
Pronostic
L'évolution en l'absence de traitement est la perte des dents.
Les parodontites sont suspectés être des facteurs de risque pour des maladies systémiques. Par exemple il a été démontré que le risque d'accouchement prématuré était augmenté lorsque la mère avait des problèmes parodontaux. La présence d'une parodontite est également corrélée avec le risque d'infarctus du myocarde[26] sans qu'il soit clair s'il s'agit d'un réel facteur causal. Elle l'est également avec la maladie d'Alzheimer[27].
Traitement
Il faut consulter un dentiste[6]. Voir : traitement des maladies parodontales.
Notes et références
- Chapple IL, Time to take periodontitis seriously, BMJ, 2014;348:g2645
- Chapple ILC, Genco RJ, Diabetes and periodontal diseases: consensus report of the joint EFP/AAP workshop on periodontitis and systemic diseases, J Clin Periodontol, 2013;40:106-12
- DePablo P, Chapple ILC, Buckley CD, Dietrich T, Periodontitis and systemic rheumatic diseases, Nat Rev Rheumatol, 2009;5:218-24
- Dietrich T, Sharma P, Walter C, Weston P, Beck J, The epidemiological evidence behind the association between periodontitis and incident atherosclerotic cardiovascular disease, J Clin Periodontol, 2013;40:70-84
- Nicola U. Zitzmann, Christoph A. Ramseier, Roland Weiger, Clemens Walter, « Parodontite », Forum Med Suisse, vol. 13, no 09, , p. 183-186 (lire en ligne)
- Bechara Halabi et Stéphane Korngold, « Parodontite sévère généralisée, Approche conservatrice et pluridisciplinaire », L'Information Dentaire, no 8, , p. 24-26 (lire en ligne, consulté le )
- (en) Kofoid CA, Hinshaw HC et Johnstone HG, « Animal parasites of the mouth and their relation to dental disease », Journal of the American Dental Association, , p. 1436-1455.
- (en) Lyons T, Introduction to protozoa and fungi in periodontal infections, Ontario, Trevor Lyons publications, (ISBN 0-9693950-0-0).(disponible upon request at : http://www.parodontite.com)
- Trim RD, Skinner MA, Farone MB, Dubois JD, Newsome AL. Use of PCR to detect Entamoeba gingivalis in diseased gingival pockets and demonstrate its absence in healthy gingival sites. Parasitol Res. 2011 Sep;109(3):857-64.
- (en) « Biological Activities of Bacteroides forsythus Lipoproteins and Their Possible Pathological Roles in Periodontal Disease » Infection and Immunity DOI 10.1128/IAI.72.3.1318-1325.2004 Infect. Immun. March 2004 vol. 72 no 3 1318-25. (résumé)
- (en) Stanley C. Holt & Thomas E. Bramanti, « Factors in Virulence Expression and Their Role in Periodontal Disease Pathogenesis » CROBM (Critical Reviews in Oral Biology & Medicine) 1991 vol. 2 no 2 177-281 (résumé)
- Arg-Gingipain A DNA Vaccine Induces Protective Immunity against Infection by Porphyromonas gingivalis in a Murine Model Infection and Immunity 2001-05-01; 69: 2858-2864(résumé)
- (en) Yanlai Lai & Lianrui Chu « Novel Mechanism for Conditional Aerobic Growth of the Anaerobic Bacterium Treponema denticola » First published November 2007, Applied and environmental microbiology janvier 2008 vol. 74 no 1 p. 73-79 DOI 10.1128/AEM.01972-07 (résumé)
- Lyons T, Sholten T, Palmer JC, Stanfield E. Oral amebiasis: the role of Entamoeba gingivalis in periodontal disease. Quintessence Int. 1983 Dec;14(12): 1245-8.
- Répercussions de la grossesse sur les tissus paradontaux (1re partie) Le courrier du dentiste janvier 2001
- Répercussions de la grossesse sur les tissus paradontaux (2e partie) Le courrier du dentiste janvier 2001
- Incidence du tabac sur l'état parodontal
- Le stress : Nouveau facteur étiologique des maladies parodontales?
- Armitage, GC., « Development of a classification system for periodontal diseases and conditions », Ann Periodontol., vol. 4, no 1, , p. 1-6
- Nisengard RJ, Newman MG. Oral microbiology and immunology. Philadelphia: W.B. Saunders Company; 1994: 297.
- Keyes PH, Rogosa M, RamsTH, Sarfatti DE. Diagnosis of Creviculoradicular Infections : Disease-Associated Bacterial Patterns in Periodontal Lesions. Host-Parasite Interactions in Periodontal Diseases. Genco and Mergenhagen 1982. (ISBN 0-914826-37-9)
- Lyons T, Sholten T, Palmer JC. Oral amoebiasis: a new approach for the general practitioner in the diagnosis and treatment of periodontal disease. Oral Health 1980 Oct; 70(10) : 39-41,108,110.
- Lyons T, Sholten T, Palmer JC, Stanfield E. Oral amoebiasis: alternatives in oral disease. Ontario dentist 1982 Feb;59(2):16-20.
- Bonner M. Tant de bouches à guérir… des parasites qui les vampirisent. Vaincre la parodontite. Éditions Amyris 2009. (ISBN 978-2-9303-5375-3)
- Bonner M, Amard V, Amiot P, Ihler S, Marty M, Rochet JP, Verdy M. Antiparasitic treatment of periodontitis and peri-implantitis: 12-months multicentric follow-up. AOS Journal no 261 February 2013 (in French).
- (en) Rydén L., Buhlin K., Ekstrand E. et al., « Periodontitis increases the risk of a first myocardial infarction. a report from the PAROKRANK Study », Circulation, no 133, , p. 576-583 (DOI 10.1161/CIRCULATIONAHA.115.020324, lire en ligne)
- (en) Leira Y., Domínguez C., Seoane J., Seoane-Romero J., Pías-Peleteiro JM., Takkouche B., Blanco J. et Aldrey JM., « Is Periodontal Disease Associated with Alzheimer's Disease? A Systematic Review with Meta-Analysis. », Neuroepidemiology., vol. 48, nos 1-2, , p. 21-31 (DOI 10.1159/000458411)
Liens externes
- Ressources relatives à la santé :
- (en) Classification internationale des soins primaires
- (en) Diseases Ontology
- (en) DiseasesDB
- (en) ICD-10 Version:2016
- (en) Medical Subject Headings
- (en + es) MedlinePlus
- (en) NCI Thesaurus
- (no + nn + nb) Store medisinske leksikon
- (cs + sk) WikiSkripta
- Notices dans des dictionnaires ou encyclopédies généralistes :