Porphyromonas gingivalis
Porphyromonas gingivalis est une espèce de bactéries anaérobie, non mobiles, asaccharolytique, présente dans la cavité buccale, responsable de gingivite. Elle est un agent pathogène majeur de la parodontite sévère de l'adulte, maladie inflammatoire courante qui détruit les tissus de soutien de la dent, ce qui peut entraîner la perte des dents.
| Règne | Bacteria |
|---|---|
| Embranchement | Bacteroidota |
| Classe | Bacteroidia |
| Ordre | Bacteroidales |
| Famille | Porphyromonadaceae |
| Genre | Porphyromonas |
Elle serait un des facteurs favorisant de pathologies comme la maladie d'Alzheimer.
Action pathogène
Porphyromonas gingivalis est fortement corrélé à la parodontite chronique. La stratégie d'installation invasive du pathogène est décrite en 1995 chez les primates dont l'humain ; elle est transmissible[2]. Sa persistance chronique résulte de sa capacité à échapper à l'immunité de l'hôte sans inhiber la réponse inflammatoire et la nourriture qu'elle trouve dans l'exsudat inflammatoire (liquide créviculaire gingival). Elle contribue à la pathogenèse de la parodontite agressive en induisant des niveaux élevés de cytokines proinflammatoires. Les mécanismes complexes d'installation de la bactérie et de neutralisation des défenses naturelles sont décrits, elles produisent un grand nombre d'enzymes (protéases appelées gingipaïnes (en)[3]), de protéines qui leur permettent d'échapper aux défenses de l'hôte[4].
Dans le modèle murin P. gingivalis est la principale bactérie qui altère de la quantité et de la composition du microbiote oral normal et entraine la perte osseuse pathologique[5]. C'est un des pathogènes majeurs des parodontites[6]. Pathogène opportuniste bien adapté de la muqueuse buccale et important constituant des biofilms buccaux, elle est suspectée de favoriser le développement de maladies chroniques multifactorielles[7].
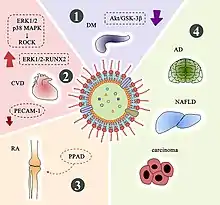
Elle est associée à de nombreuses maladies systémiques[8] : diabète sucré, maladies cardiovasculaires et athérosclérose[9], polyarthrite rhumatoïde, stéatose hépatique et cancers orodigestifs[7] ; chez la souris : inflammation gastrointestinale, colites[10]. In vitro, Porphyromonas gingivalis est associée à l'état cancéreux et corrélée à un mauvais pronostic, et un oncopathogène dans les modèles animaux[11].
Diverses études permettent de suspecter un lien causal entre cette bactérie la maladie d'Alzheimer. Carter (2017) a détecté sa présence dans les cerveaux atteints de cette dégénérescence. Le blocage des gingipaïnes qu'elle produit réduit la neuroinflammation dans l'hippocampe et préserve les neurones (2019). Le lien entre les produits de la membrane externe de P. gingivalis et l'induction d'une inflammation cérébrale est établi en 2018[8]. Les maladies parodontales sont un facteur de risque d'aggravation des maladies dégénératives chez la population âgée écrit une revue des publications académiques en 2021[12].
Bactéricides et prévention
L'hygiène buccodentaire joue un rôle capital dans la parodontopathogenèse[13]. Une étude coréenne (2021) sur 109 sujets humains a montré qu'un nettoyage interdentaire et un brossage professionnel des dents une fois toutes les 3 semaines est plus efficace que le traitement parodontal dans la diminution de P. gingivalis[14]. Chez les patients guéris du SRAS-CoV-2 la mauvaise hygiène buccale et la prévalence d'agents pathogènes buccaux liés au développement de maladies inflammatoires gingivales ou parodontales est démontrée[15] (l'hypothèse que les bactéries parodontopathiques sont impliquées dans l'aggravation du COVID-19 a été émise[16]).
Le digluconate de chlorhexidine présent dans le dentifrice et les bains de bouche réduit considérablement la charge de P. gingivalis[17]. Des mutants résistants ont été signalés après une exposition prolongée à la chlorhexidine[18].
In vitro, la myrrhe mélangée à des nanoparticules d'argent est un antimicrobien contre P. gingivalis[19].
En 2022, une thèse indonésienne a montré que l'extrait de feuille de combava (Citrus Hystrix) à une concentration minimale de 12.5 % a une action antibactérienne contre la croissance des bactéries Porphyromonas gingivalis in vitro[9].
Notes et références
- Integrated Taxonomic Information System (ITIS), www.itis.gov, CC0 https://doi.org/10.5066/F7KH0KBK, consulté le 24 août 2019
- (en) Christopher W. Cutler, John R. Kalmar et Caroline A. Genco, « Pathogenic strategies of the oral anaerobe, Porphyromonas gingivalis », TRENDS INMICROBIOLOGY 45 VOL. 3, , p. 7 (lire en ligne [PDF])
- (en) Ignacio Lunar Silva et Eric Cascales, « Molecular Strategies Underlying Porphyromonas gingivalis Virulence », Journal of Molecular Biology, vol. 433, no 7, , p. 166836 (ISSN 0022-2836, DOI 10.1016/j.jmb.2021.166836, lire en ligne, consulté le )
- (en) STANLEY C.HOLT, LAKSHMYYA KESAVALU, STEPHEN WALKER et CAROLINE ATTARDO GENCO, « Virulence factors of Porphyrornonas gingivali », Periodontology 2000, Vol. 20, , p. 168-238 (lire en ligne [PDF])
- (en) R.P. Darveau, G. Hajishengallis et M.A. Curtis, « Porphyromonas gingivalis as a Potential Community Activist for Disease », Journal of Dental Research, vol. 91, no 9, , p. 816–820 (ISSN 0022-0345 et 1544-0591, PMID 22772362, PMCID PMC3420389, DOI 10.1177/0022034512453589, lire en ligne, consulté le )
- « Accéder aux archives de l'UNESS », sur unsof.org (consulté le ).
- (en) Jaroslav Mysak, Stepan Podzimek, Pavla Sommerova et Yelena Lyuya-Mi, « Porphyromonas gingivalis: Major Periodontopathic Pathogen Overview », Journal of Immunology Research, vol. 2014, , e476068 (ISSN 2314-8861, DOI 10.1155/2014/476068, lire en ligne, consulté le )
- Zhiying Zhang, Dongjuan Liu, Sai Liu et Shuwei Zhang, « The Role of Porphyromonas gingivalis Outer Membrane Vesicles in Periodontal Disease and Related Systemic Diseases », Frontiers in Cellular and Infection Microbiology, vol. 10, (ISSN 2235-2988, DOI 10.3389/fcimb.2020.585917/full, lire en ligne, consulté le )
- (id) Umar, Chairat, « Efektivitas Antibakteri Ekstrak Daun Jeruk Purut (Citrus hystrix D.C) terhadap Bakteri Porphyromonas gingivalis secara in vitro », Université du nord de Sumatra Thèse de premier cycle, , p. 68 pages (lire en ligne)
- (en) Takahiro Tsuzuno, Naoki Takahashi, Miki Yamada‐Hara et Mai Yokoji‐Takeuchi, « Ingestion of Porphyromonas gingivalis exacerbates colitis via intestinal epithelial barrier disruption in mice », Journal of Periodontal Research, vol. 56, no 2, , p. 275–288 (ISSN 0022-3484 et 1600-0765, DOI 10.1111/jre.12816, lire en ligne, consulté le )
- (en) Richard J. Lamont, Zackary R. Fitzsimonds, Huizhi Wang et Shegan Gao, « Role of Porphyromonas gingivalis in oral and orodigestive squamous cell carcinoma », Periodontology 2000, vol. 89, no 1, , p. 154–165 (ISSN 0906-6713 et 1600-0757, DOI 10.1111/prd.12425, lire en ligne, consulté le )
- (en) Moan Jéfter Fernandes Costa, Isabela Dantas Torres de Araújo, Luana da Rocha Alves et Romerito Lins da Silva, « Relationship of Porphyromonas gingivalis and Alzheimer’s disease: a systematic review of pre-clinical studies », Clinical Oral Investigations, vol. 25, no 3, , p. 797–806 (ISSN 1436-3771, DOI 10.1007/s00784-020-03764-w, lire en ligne, consulté le )
- G. Dahlén, F. Manji, V. Baelum et O. Fejerskov, « Putative periodontopathogens in "diseased" and "non-diseased" persons exhibiting poor oral hygiene », Journal of Clinical Periodontology, vol. 19, no 1, , p. 35–42 (ISSN 0303-6979, PMID 1346265, DOI 10.1111/j.1600-051x.1992.tb01146.x, lire en ligne, consulté le )
- Mi-Young Jin, Byeng-Chul Yu et Hyen Suk Kwon, « Changes in the number of P. gingivalis bacteria before and after professional periodontal prevention care in periodontal disease patients », Journal of Korean Dental Hygiene Science, vol. 4, no 2, , p. 99–111 (ISSN 2635-456X, DOI 10.22753/JKDHS/2021.4.2.99, lire en ligne, consulté le )
- (es) Janeth Lizett Rodr�guez-Cardona, Wendy J �lvarez-Fern�ndez, Jany A. Jim�nez-Del Valle et M. Elisa S�nchez-Dorado, « Hygiene level and prevalence of Porphyromona gingivalis and Fusobacterium nucleatum in recovered SARS-CoV-2 patients. », Revista de la Asociaci�n Dental Mexicana, vol. 78, no 6, , p. 309–313 (ISSN 0001-0944, lire en ligne, consulté le )
- Yuwa Takahashi, Norihisa Watanabe, Noriaki Kamio et Ryutaro Kobayashi, « Aspiration of periodontopathic bacteria due to poor oral hygiene potentially contributes to the aggravation of COVID-19 », Journal of Oral Science, vol. 63, no 1, , p. 1–3 (DOI 10.2334/josnusd.20-0388, lire en ligne, consulté le )
- (en) Simonetta D’Ercole, Gianmaria D’Addazio, Silvia Di Lodovico et Tonino Traini, « Porphyromonas Gingivalis Load is Balanced by 0.20% Chlorhexidine Gel. A Randomized, Double-Blind, Controlled, Microbiological and Immunohistochemical Human Study », Journal of Clinical Medicine, vol. 9, no 1, , p. 284 (ISSN 2077-0383, DOI 10.3390/jcm9010284, lire en ligne, consulté le )
- (en) Eva M. Kulik, Tuomas Waltimo, Roland Weiger et Irene Schweizer, « Development of resistance of mutans streptococci and Porphyromonas gingivalis to chlorhexidine digluconate and amine fluoride/stannous fluoride-containing mouthrinses, in vitro », Clinical Oral Investigations, vol. 19, no 6, , p. 1547–1553 (ISSN 1436-3771, DOI 10.1007/s00784-014-1379-y, lire en ligne, consulté le )
- (en) Shatha Subhi ALHarthi, Munerah BinShabaib, Najla Saad AlMasoud et Heba Ahmed Shawky, « Myrrh mixed with silver nanoparticles demonstrates superior antimicrobial activity against Porphyromonas gingivalis compared to myrrh and silver nanoparticles alone », The Saudi Dental Journal, vol. 33, no 8, , p. 890–896 (ISSN 1013-9052, DOI 10.1016/j.sdentj.2021.09.009, lire en ligne, consulté le )
Liens externes
- (en) Référence Catalogue of Life : Porphyromonas gingivalis (Coykendall et al., 1980) Shah & Collins, 1988 (consulté le )
- (fr+en) Référence ITIS : Porphyromonas gingivalis (Coykendall & al., 1980) Shah & Collins, 1988 (consulté le )
- (en) Référence NCBI : Porphyromonas gingivalis Bacteroides gingivalis Coykendall & al. 1980 (taxons inclus) (consulté le )
- (en) Référence uBio : site déclaré ici indisponible le 7 avril 2023