Phytochélatine
Les phytochélatines (PCs) sont (comme les métallothionéines (MT) et certains acides organiques) des agents de chélation naturels, c'est-à-dire capables de fixer les métaux et métalloïdes. Les phytochélatines sont responsables de la tolérance des plantes aux ions métalliques notamment au cadmium (Cd2+), ainsi que de certaines algues ou bactéries photosynthétiques présentes dans le plancton ou dans certains biofilms[1].
Elles participent à l'autoépuration des milieux (phytoépuration en particulier, à la séquestration géologique de métaux, mais aussi aux phénomènes de bioturbation et de bioconcentration de métaux et radionucléides dans le réseau trophique et la chaîne alimentaire.
Les phytochélatines ont été isolées pour la première fois en 1985 à partir de cellules des cultures en suspension.
Nature des phytochélatines
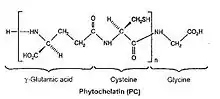
Biochimiquement parlant, les phytochélatines sont des polypeptides. Leur poids moléculaire est compris entre 1,5 et 4 kDa et leur chaîne principale possède une répétition du dipeptide γ-Glu-Cys suivi par le terminal Gly donc, la structure de base des phytochélatines est (γ-Glu-Cys)n-Gly où n varie entre deux et onze.
Synthèse des phytochélatines
Elle est réalisée à partir d’une enzyme, la gamma-glutamylcystéine dipeptidyl transpeptidase, communément appelée la phytochélatine synthase (PCS, identifiée et caractérisée pour la première fois en 1999).
Cette enzyme utilise le glutathion (GSH), qui fournit des groupements γ-Glu-Cys-Gly, afin de synthétiser la phytochélatine.
En résumé, cette synthèse peut être décrite comme :
PCS
γ-Glu-Cys-Gly + (γ-Glu-Cys)n-Gly ─────▷ (γ-Glu-Cys)n+1-Gly + Gly
(GSH) (phytochélatine)
Une quantité importante d’ions métalliques change la conformation de la PCS en une conformation la rendant active.
L’expression de cette enzyme est régulée selon la toxicité métallique du milieu auquel l’organisme est exposé (ici, il s'agit de phytotoxicité).
Les métaux qui induisent la synthèse de phytochélatines sont des métaux lourds tels que Cd, Ag, Pb, As, Cu.
La reconnaissance d’ions métalliques se fait dans la partie C-terminale des phytochélatines alors que la partie N-terminale agit comme un domaine catalytique.
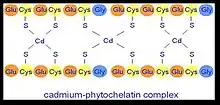
La chélation se fait à partir de liaisons formées entre les unités sulfure de la cystéine et l’ion métallique comme nous l'indique la figure 1.
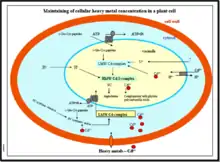
La phytochélatine (PC) possède des domaines de reconnaissances qui sont reconnus par les vacuoles d’une cellule. Ainsi, le complexe PC-Ion métallique est capté et transporté dans la vacuole par le biais d’un transport actif utilisant un transporteur spécifique aux phytochélatines et l’ATP. Dans la vacuole, les phytochélatines sont dégradées en acides aminés et les ions métalliques sont alors fixés par liaison à des acides organiques.
Ainsi, en empêchant l’excès d’ions métalliques à circuler librement dans le cytoplasme par formation de complexes avec ces derniers et en s’engageant à leur séquestration vacuolaire, les phytochélatines participent à la tolérance aux ions métalliques, qui peut être élevée pour certaines plantes dites métallophytes (certaines fougères, Armeria maritima haleeri pour le plomb par ex).
Techniques analytiques
Plusieurs techniques analytiques permettent la détermination des phytochélatines (Cf. tableau ci-dessous). Le choix de la méthode varie selon la « matrice ».

La technique analytique la plus sensible pour détecter les phytochélatines dans les phytoplanctons des eaux naturelles est celle de HPLC couplée d'un détecteur de fluorescence dont sa limite de détection est de l’ordre de pM.
Détection des phytochélatines dans les phytoplanctons des eaux naturelles
Pour faire l'analyse des phytochélatines, on doit passer par les étapes suivantes : échantillonnage, filtration de l'échantillon, extraction des thiols, réduction des groupements thiol, dérivatisation des thiols, analyse des dérivées thiol par HPLC.
- Échantillonnage
Doit se faire avec des bouteilles (2 - 4L) en polycarbonate, lavées à l'acide (1 M HCl), puis rincées au minimum trois fois par l'eau Milli-Q. Le prélèvement de l’échantillon se fait à 0.3 m de profondeur d’une eau naturelle.
- Filtration de l'échantillon
Une filtration sous vide doit être nécessaire avec une pression (<5psi) et cela en utilisant des filtres en nitrocellulose 47mm de diamètre dont la taille des pores est de 0.8µM. Ensuite, ces filtres (contenant les phytoplanctons) seront placés dans des microtubes.
- Extraction des thiols
L’extraction se fait par un ajout (aux microtubes) de 1.2 mL HCl 0.1M (dénature les enzymes capables de dégrader les groupements thiol des peptides) contenant 5mM DTPA (diminue l'oxydation des groupements thiol par le métal), ensuite placé dans un ultrasonicateur (0 °C ; 5 minutes), puis les cellules extraites seront centrifugées (20 min ; 13 000 g ; 4 °C).
- Réduction des groupements thiol
Le TCEP est le réactif réducteur utilisé, une addition au surnageant (250µL) un volume de 25µL de TCEP 20mM (préparé dans 200mM HEPES/ 5mM DTPA (pH=8.2)) peut réduire les thiols oxydés selon la réaction suivante :
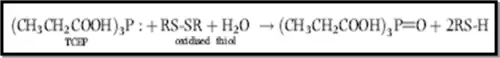
- Dérivatisation des thiols
Plusieurs réactifs peuvent être utilisés pour la dérivatisation des thiols tels que le DTNP (n’est pas sensible pour la détection des PCs dans les phytoplanctons), OPA (stable pour une courte durée), NPM (formation des diastérioisomères), SBD-F et MBrB.

Seuls les SBD-F et MBrB sont utilisés pour la dérivatisation des thiols des phytoplanctons. Dans cette expérience, ils ont choisi le MBrB (1 mM dans l’acétonitrile), après 15 minutes on arrête la réaction en ajoutant MSA (0.1M) et l’échantillon sera mis dans le froid (4 °C) et à l’abri de la lumière.
Analyse des thiols par HPLC

La HPLC en phase inversée (colonne C-18) est la meilleure technique pour la séparation des PCs dont les deux pompes (Merck-Hitachi Models L-6200 et L-6000), la valve d’injection(100-µL), le détecteur à fluorescence (FD-300, Dionex), la longueur d’onde d’excitation est 380nm et celle d’émission 470nm, la phase mobile est formée par un gradient de concentration (solvant A est l’eau, solvant B est l’acetonitrile): 0–13 min, 10–21% B; 13–33 min, 21–35% B;33–40 min, 35–100% B; 40–50 min, isocratique 100% B;50–65 min, 100–10% B. finalement le débit est de 1.0 mL/min. Toutes ces conditions chromatographiques sont produites par un « single run » dont le chromatogramme obtenu est le suivant :
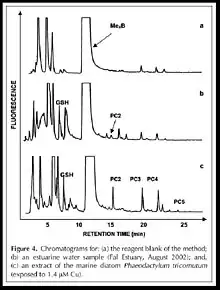
La limite de détection pour le GSH et le PC2 sont respectivement 1.0 et 0.9 pM pour un volume d’injection de 100µL.
Voir aussi
Articles connexes
Références
- Renata Behra, "Influence des métaux sur les biofilms d’algues", Eawag News 60f/Juillet 2006
Liens externes
Bibliographie
- (fr) Séverine Le Faucheur, Laura Sigg et R. Behra Les phytochélatines: indicateur d’exposition aux métaux, Eawag News 60f/, consulté 2012-08-01
- (fr) Mason A.Z., Jenkins K.D. (1995): Metal detoxification in aquatic organisms. In: Tessier A., Turner D.R. (Eds.) Metal speciation and bioavailability in aquatic systems. John Wiley & Sons: Chichester, p. 479– 608.
- (fr) Le Faucheur S., Behra R., Sigg L. (2005): Thiol and metal content in periphyton exposed to elevated copper and zinc concentrations : a field and microcosm study. Environmental Science and Technology 39, 8099– 8107.
- (fr) Le Faucheur S., Behra R., Sigg L. (2005): Phytochelatin induction, cadmium accumulation and algal sensitivity to free cadmium ion in Scenedesmus vacuolatus. Environmental Toxicology and Chemistry 24, 1731–1737.
- Silvia K. Kawakami, Martha Gledhill, Eric P. Achterberg, Trends Anal. Chem. vol 25, No 2 (2006).
- J.M. Rosenfeld, Trends Anal. Chem. 22 (2003) 785.
- Nyberg, L.Z. Zhou, Ecotoxicol. Environ, Safety 32 (1995) 147.
- V. Vacchina, K. Polec, J. Szpunar, Journal of Anal. Atom., Spectrom 14 (1999) 1557.
- V. Vacchina, R. Lobinski, M. Oven, M.H. Zenk, Journal of Anal. Atom., Spectrom. 15 (2000) 529.
- W.A. Kleinman, J.P. Richie, Journal of Chromatography, B 672 (1995)73.
- Mun’delanji Vestergaard, Sachiko Matsumoto, Masahiro Takagi, Chelation of Cadmium Ions by Phytochelatin Synthase: Role of the Cystein-rich C-Terminal, Analytical Science February 2008, VOL. 24 277, The Japan Society for Analytical Chemistry.
- Rakesh Minocha, P. Thangavel, Om Parkash Dhankher, Stephanie Long, Separation and quantification of monothiols and phytochelatins from a wide variety of cell cultures and tissues of trees and other plants using high performance liquid chromatography, Journal of Chromatography A, 1207 (2008), p.72–83
- Yuko Osaki, Tomoo Shirabe, Shun Tamura, Etsuro Yoshimura, A Functional putative phytochelatin synthase from the primitive Red Alga, Bioscience Biotechnology Biochemistry, 72 (12), 3306-3309, 2008
- Saul Vasquez, Peter Goldsbrough, Ramon O. Carpena, Comparative Analysis of the contribution of phytochelatins to cadmium and arsenic tolerance in soybean and white lupin, Plant Physiology and Biochemistry 47 (2009), p. 63-67