Oseltamivir
L’oseltamivir (Belgique et Suisse) ou oséltamivir (France) est un médicament antiviral, délivré oralement, utilisé pour le traitement, la prévention des grippes A et B. Il est distribué sous la marque Tamiflu. Selon une étude publiée en 2015, ce médicament réduit aussi les risques de complication[2]. Il est produit à partir d'acide shikimique, un inhibiteur de la neuraminidase, l'enzyme présente en surface du virus qui attaque les parois des cellules à contaminer.
| Oseltamivir | |
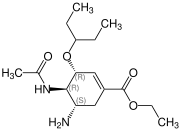
| |
| Identification | |
|---|---|
| Nom UICPA | (3R,4R,5S)- 4-acétylamino-5-amino-3-(1-éthylpropoxy)- 1-cyclohexène-1-carboxylate d'éthyle |
| No CAS | |
| Code ATC | J05 |
| PubChem | 65028 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C16H28N2O4 [Isomères] |
| Masse molaire[1] | 312,404 5 ± 0,016 4 g/mol C 61,51 %, H 9,03 %, N 8,97 %, O 20,49 %, |
| Données pharmacocinétiques | |
| Biodisponibilité | 75 % |
| Métabolisme | Hépatique |
| Excrétion | |
| Considérations thérapeutiques | |
| Classe thérapeutique | Antiviral antigrippal |
| Unités du SI et CNTP, sauf indication contraire. | |
Production
Il a été développé un peu avant 1996 par Gilead Sciences qui possède le brevet et vend la molécule (pour cinquante millions de dollars et 10 % du chiffre d’affaires) au groupe suisse Hoffman La Roche qui possède la licence exclusive sous la marque commerciale Tamiflu. Depuis , la société Gilead dénonce le contrat qui le lie au laboratoire Roche, accusant cette dernière de sous-estimer ses royalties.
Le processus de fabrication était très long, de l’ordre d’une année en 2006[3]. Or, de très nombreux pays qui cherchent à se constituer des stocks importants ont passé commande dès le premier semestre 2005. En , Roche annonce pouvoir produire plus de quatre cents millions de traitements par an[4], soit beaucoup plus que les commandes effectives des gouvernements.
Selon une étude publiée en 2015, un nouveau procédé de fabrication, plus rapide et plus efficient, a été mis au point, à partir de la molécule D-glucose[5].
En France
Dans le cadre du plan de lutte contre une éventuelle pandémie grippale, la France constitue des stocks sur son territoire et met en place, en lien avec le service de santé des armées, une capacité de production d'antiviraux sous forme de comprimés, à partir du principe actif oseltamivir qu'elle achète en vrac aux laboratoires Roche[6].
Aspect et caractéristiques
- Forme : poudre de phosphate d’oseltamivir (en gros), conditionné en formes buvables ou gélules (de 30 mg, 45 mg et 75 mg)
- Apparence : solide cristallin blanc
- Délivré à la France en vrac et en grandes quantités sous forme de poudre (à conditionner en gélules ou à diluer dans de l’eau)
Origine
Autour de 2005, il a été révélé que le phosphate d'oseltamivir était produit à partir de l'acide shikimique contenu dans la badiane chinoise (Illicium verum)[7], aussi appelée anis étoilé et cultivée dans le sud de la Chine entre le Yunnan et la frontière vietnamienne. Cet acide qui ne présente aucune activité anti-virale subit de multiples transformations avant de devenir le phosphate d'oseltamivir[8], molécule active du Tamiflu.
À présent, l'oseltamivir est également obtenu à partir d'autres procédés :
- la biofermentation de la bactérie Escherichia coli[9] ;
- la synthèse chimique[10].
D'autres plantes comme le liquidambar ou le ginkgo sont des sources potentielles d'acide shikimique .
Utilisation
| Phosphate d’oseltamivir (ou d’oséltamivir) | |
| Informations générales | |
|---|---|
| Princeps |
|
| Classe | Antiviral |
| Identification | |
| DCI | 7793 |
| No CAS | |
| Code ATC | J05AH02 |
| DrugBank | 00198 |
Il est réputé efficace en ingestion orale contre la grippe de type A et B, contre le(s) nouveau(x) A-H5N1 TP ou HP (bien qu’un nouveau variant résistant soit déjà apparu au Viêt Nam en 2005), et qu’en laboratoire, des résistances sont apparues dès le test du médicament.
Il est depuis peu autorisé ou recommandé chez les enfants (pas avant l’âge de 1 an) par le fabricant. Il peut donner des effets secondaires comme : maux de tête, douleurs abdominales, diarrhées ou encore des hallucinations.
Il a d’abord été recommandé en curatif ou en préventif, puis à partir de l’automne 2005, les autorités sanitaires et le fabricant ont insisté sur le fait que le Tamiflu ne devait être pris préventivement que sous surveillance médicale car un usage exagéré ou anarchique pourrait permettre au virus de développer une résistance au médicament[11].
Principes d'action
L’oseltamivir est un précurseur, en général administré sous forme de phosphate d’oseltamivir. Au niveau hépatique, il est converti in vivo en son métabolite actif, le GS4071 avec un bon taux de conversion et une bonne diffusion dans l’organisme. Le produit une fois ingéré et passé au travers de la barrière intestinale, 75 % au moins de la dose orale sont transformés dans l’organisme par des enzymes essentiellement hépatiques (estérases) en carboxylate d’oseltamivir (le principe actif).
La molécule ne semble guère être dégradée par la suite et peut se retrouver intacte dans les eaux usées ce qui comporte un risque théorique de provoquer des résistances à cette dernière[12]. Une étude suédoise de 2011 souligne de nouveau le risque d'apparition de virus résistants à l'Oseltamivir par le biais de canards évoluant dans des eaux polluées avec cette substance[13].
Comme le zanamivir, l’oseltamivir agit comme inhibiteur analogue des états de transition de l’antigène de neuraminidase présente à la surface du virus. Autrement dit, il bloque les fonctions de la neuraminidase, l’enzyme de surface des virus A et B de la grippe, qui détache des glycoconjugués les résidus acide N-acétyl neuraminique (= acide sialique). Cette hydrolyse dont la fonction est peut-être incomplètement comprise, est une étape nécessaire à la diffusion de l’infection virale.
Efficacité
Selon Jean Thierry Aubin du centre national de la grippe à l’Institut Pasteur : « En traitement préventif, en période de circulation du virus, il permet de ne faire qu’une grippe bénigne. En traitement curatif, il est efficace à la condition d’être administré dans les 24 à 48 heures après les premiers symptômes, et idéalement dans les toutes premières heures, car il bloque alors mieux la réplication du virus », mais son efficacité contre la grippe commune reste modérée avec une diminution des symptômes et de la durée de la maladie dans moins de la moitié des cas.
Son utilisation dans les cas de grippe aviaire a été proposée, mais il n’a pu éviter un certain nombre de décès et avec des preuves d'efficacité considérées comme faibles[14] d'autant que les données de huit études sur les dix attestant du bien-fondé de sa prescription ne sont toujours pas publiées en 2012, ce qui est un sujet de polémique, relayé par le journal British Medical Journal[15] - [16].
En 2008, le taux de résistance du virus grippal atteignait près de 10 % et semblait en forte croissance pour la grippe saisonnière dans certaines régions.
On manque de recul, mais sur la base du modèle animal, on estime généralement que dans la grippe habituelle, le Tamiflu réduit de 24 h la durée des symptômes, et de 30 à 70 % le taux de complications (otites, sinusites, pneumonies).
- En prévention, l’efficacité serait de 60 à 85 % s’il est administré dans les 48 h, mais les chiffres varient (ex. : les complications sont réduites de 50 à 60 % si l’oseltamivir est pris dans les 48 h après les premiers symptômes, selon le Dr Guy Boivin, chercheur au Centre hospitalier de l’Université Laval, à Québec).
- En curatif, il permettrait de réduire de 30 % la mortalité chez les malades.
On sait que des personnes en contact avec la maladie qui ont pris le médicament dans les 48 heures n’ont pas développé les symptômes, mais cela restera-t-il vrai si le virus change en s’humanisant (on connaît déjà un premier variant H5N1 HP résistant à l’oseltamivir découvert au Viêt Nam).
Selon l'Organisation Mondiale de la Santé, le Tamiflu aurait des effets sur le virus de grippe H1N1 apparu au Mexique en [17] - [18] mais il est trop tôt pour évaluer avec précision son efficacité.
Les auteurs d'une étude publiée le par le British Medical Journal appellent le département de la santé britannique à reconsidérer de façon urgente leur politique dans le cadre de la pandémie du nouveau virus A (H1N1). En effet, les effets néfastes d'une prescription systématique comme les vomissements chez certains enfants pouvant conduire à une déshydratation et d'autres complications, l'emportent sur les bienfaits d'une réduction d'un jour et demi de la durée des symptômes. L'étude repose sur l'analyse de données disponibles issues d'essais comparatifs des inhibiteurs de la neuraminidase chez les enfants.
Stratégie de distribution en cas de pandémie
Elle vise à protéger en premier lieu tous ceux qui seraient mobilisés pour faire face à une éventuelle pandémie, soit le personnel hospitalier, les pompiers, les forces de sécurité, etc. Le traitement préventif est réalisé à raison d’un comprimé par jour durant toute la période de circulation du virus.
Pour le reste de la population, la distribution de capsules pourrait se faire seulement en traitement curatif, car de toute façon selon l’Institut Pasteur, « l’organisme a la possibilité de fabriquer des anticorps dans un délai de quinze jours, permettant ainsi à la personne d’être immunisée par la suite naturellement » en attendant la mise au point d’un futur vaccin, spécifiquement efficace contre le virus H5 N1. D’autre part, l’AFSSA (Agence française) recommande de se faire vacciner contre la grippe commune ce qui protège en moyenne 60 à 70 % des individus[19] et leur permet d’échapper aux symptômes de la grippe classique, permettant ainsi en cas d’épidémie de repérer plus vite les symptômes de la grippe aviaire et de donner plus rapidement aux malades un antiviral efficace.
Usage vétérinaire
Il est utilisé pour l’animal contre la grippe, mais semble aussi être actif contre le parvovirus canin, la panleucopénie féline et le complexe respiratoire canin connu sous le nom de la toux de chenil. Des études vétérinaires[20] à ce sujet sont en cours, mais de nombreux cliniciens vétérinaires ont rapporté de grands succès lors de son emploi dans les premières phases de ces maladies.
Effets secondaires
Selon le fabricant, des maux de tête, nausées, vomissements, diarrhées, douleurs abdominales ou encore des hallucinations peuvent survenir chez certains patients.
Il est à souligner que Tamiflu est contre-indiqué en cas d'allergie à l'oseltamivir, ou en cas de problèmes rénaux. Aucun effet délétère chez le fœtus ou le nouveau-né de la femme allaitante n'a été retrouvé[21].
Soupçons sur des effets secondaires psychiatriques potentiellement mortels
Des soupçons pèsent sur la sûreté de ce produit, accusé d’avoir des effets secondaires psychiatriques potentiellement mortels.
De 2004 à 2007, quinze adolescents japonais ont eu un comportement suicidaire pendant le traitement, notamment par défenestration[22]. Même en l’absence de preuve directe de la responsabilité de l’oseltamivir dans ces accidents, le gouvernement japonais a recommandé en 2007 de ne pas prescrire cette molécule chez les enfants et adolescents[23].
La FDA a signalé en 2005 des effets indésirables neuropsychiatriques chez des enfants et adolescents : délires, hallucinations, convulsions et troubles du comportement.
En 2006, 103 notifications ont été signalées, dont trois décès[22], de même en 2007 pour la revue BMJ[24].
Chez l’animal, contre le H5N1
L’efficacité de l’oseltamivir a été testée, par exemple sous l’autorité du Dr Anthony FAUCI, chef de l’institut national de l’allergie et des maladies infectieuses, aux États-Unis par l’équipe du St. Jude Children’s Research Hospital de Memphis, Tennessee, États-Unis.
- On a infecté 80 souris, dont une partie a été traitée avec de l’oseltamivir.
- Aucune des souris traitées avec un placebo et exposées au H5N1 du Viêt Nam n’a survécu.
- Cinq parmi 10 souris traitées avec la dose quotidienne la plus élevée d’oseltamivir durant cinq jours ont survécu.
- 8 sur 10 ayant reçu un traitement durant 8 jours ont survécu.
- Les chercheurs notent au passage que le variant 2005 du H5N1 vietnamien est « beaucoup plus virulent » que le variant connu de 1997 qui avait tué six personnes à Hong Kong[25].
Résistance virale
En 2004, on pensait que les résistances acquises par des virus aux antiviraux étaient rares parmi les souches grippales circulantes, mais sur la base d'études datant de 10 ans. Roche, le fabricant de l’oseltamivir n’a pas caché ce risque et a fait savoir — depuis au moins — qu’en présence de la molécule active du Tamiflu (le carboxylate d’oseltamivir), des variants mutants du virus de l’Influenza A sont apparus lors des expérimentations du médicament. La résistance semble liée à des changements moléculaires des acides aminés au sein de la neuraminidase ou de l’hémagglutinine ou de ces deux glyco-protéines à la fois.
- Plusieurs mécanismes de résistance au virus étaient déjà identifiés par le fabricant chez des patients atteints de grippe A :
- Chez 1,3 % de 301 patients adultes et adolescents et chez 8,6 % de 105 patients de 1 à 12 ans ont été trouvés des types de neuraminidases moins sensibles au principe actif in vitro. Ces résistances sont brièvement décrites dans un document de par le fabricant ; pour la grippe « humaine » mais aussi pour un virus réassorti aviaire-humain (H1N9) ;
- Le fabricant estime alors ne pas disposer d’informations suffisantes pour caractériser le risque d’apparition de résistance (et de résistances croisées) des virus au médicament en utilisation clinique.
Des résistances croisées ont aussi été observées in vitro entre des virus Influenza mutants devenus résistants au zanamivir et avec d’autres devenus résistants à l’oseltamivir ; 3 cas observés à l’époque de la rédaction du document ().
Le myxovirus de type B, plus rare que sa forme A, comporte également des variants résistants (moins de 2 %) mais qui sont transmissibles[26].
La proportion de souches résistantes tend à augmenter fortement, passant de 1 % à 14 % en 2007[27]. Des souches du virus grippal saisonnier résistantes au Tamiflu ont été trouvées l’hiver 2007-2008 en Scandinavie, puis au Québec. Le laboratoire de Guy Boivin[28] a détecté en sur 25 souches testées deux souches résistantes au Tamiflu (soit un taux de résistance de 10 %). Ce taux est de 40 % et de 20 % dans l’ensemble de l’Europe.
Résistance au H5N1
Le H5N1 est le variant, dit aviaire, du virus grippal. Il est beaucoup plus pathogène que la grippe saisonnière, et il attaque parfois tous les organes et non seulement les poumons, avec une mortalité de très loin supérieure.
Il semble que l’efficacité de l’oseltamivir soit très limitée si le médicament est pris tardivement, et qu’elle puisse être améliorée par une augmentation des doses et/ou de la durée du traitement, mais les retours d’expérience en 2005-2006 ne sont pas encore clairs.
En 2004, une mutation de la neuraminidase était constatée conférant une résistance du virus grippal à l'oseltamivir. Ce type de mutation semble toutefois plus rare que celles qui confèrent une résistance du virus à d'autres antiviraux tels que l'amantadine ou la rimantadine[29]. Début , une étude[30] confirme qu’en chez une Vietnamienne de 14 ans infectée par le virus H5N1, un variant du virus résistant à l’oseltamivir a été détecté.
Ce virus mutant a été cloné. Il a servi à infecter expérimentalement des volailles pour étudier chez elles la sensibilité de ce nouveau variant du virus aux antiviraux. Heureusement, dans ce cas, la souche résistante à l’oseltamivir est restée sensible à l’autre antiviral de la même famille, le zanamivir (Relenza), mais dans le passé, des résistances croisées à plusieurs médicaments ont déjà été observées chez des virus infectant l’homme. D’autres études ont confirmé la présence de souches résistantes à l’oseltamivir[31].
De nombreux experts, dont Yi Guan et Kawaoka estiment que la plupart des variants du virus A H5N1HP restent toujours sensibles à l’oseltamivir, mais une utilisation à mauvais escient d’antiviraux pourrait faciliter l’apparition rapide de souches résistantes (comme les antibiotiques avec les bactéries).
En 2005, l’essentiel de la stratégie médicamenteuse repose sur le stockage de grandes quantités d’oseltamivir. Elle pourrait être insuffisante. Les experts conseillent donc d’aussi stocker du Relenza et surtout de suivre de très près les évolutions du virus au fur et à mesure de sa propagation dans l’espace et dans le temps.
Les résistances obligeraient à augmenter les doses et/ou à changer de molécules ou de passer par une bi ou trithérapie qui finissent aussi parfois aussi par échouer (ex : résistances apparaissant pour le VIH/SIDA).
Selon un communiqué de Roche du , l’incidence de la résistance détectée chez des patients traités reste stable avec 0,32 % des adultes concernés et 4,1 % des enfants et aucun nouveau cas de résistance du H5N1 n’a été repéré. Roche surveille l’apparition d’éventuelles résistances avec le réseau Neuraminidase Inhibitor Susceptibility Network (NISN).
: l’OMS signale une mutation génétique du H5N1 détectée en Égypte le rendant moins sensible à l’oseltamivir, trouvée chez deux malades égyptiens morts du H5N1 : une jeune fille de 16 ans et son oncle âgé de 26 ans. L’OMS ne modifie pas ses recommandations de sur le traitement du virus H5N1.
Selon l’InVS (Bulletin Hebdomadaire International ), la sensibilité in vitro du virus A/H5N1 à l’oseltamivir semble avoir diminué d’un facteur 5 à 30 entre 2004 et 2005[32].
En , J. McKimm-Breschkin a alerté la communauté scientifique sur la résistance de certains variants du H5N1 à l’oseltamivir (souches isolées en Asie du Sud-Est[33]), ce qui a incité l’InVS à faire un point pour les souches isolées en 2007. Ce bilan montre que la rapidité de la prise en charge médicale est importante (elle pourrait expliquer la différence de mortalité constatée entre l’Indonésie et l’Égypte (où la prise en charge est plus rapide)[34].
Résistance au H1N1
L'oseltamivir a été très utilisé contre la grippe pandémique (H1N1) de 2009[35]. Rien qu'aux États-Unis, d' à , 8,2 millions d'ordonnances ont été délivrées contre le H1N1 (antiviraux inhibiteurs de neuraminidase. Ils ont selon une étude américaine évité lors de la saison grippale 2009-2010 de 8 400 à 12 600 hospitalisations (60 % de ces hospitalisations évitées l'ont été pour des adultes de 18-64 ans et le reste presque à parts égales pour les enfants de 0-17 ans et les adultes de plus de 65 ans)). Des recommandations[36] cherchent à limiter ce risque, mais des effets adverses de traitements en masse existent[37], et l'apparition de souches résistantes est toujours à craindre.
Selon les statistiques disponibles, au , 285 cas de résistance du H1N1 avaient été signalés dans le monde, dont 45 au Royaume-Uni où une étude cas-témoins a été conduite avec des malades hospitalisés (en Angleterre ou en Écosse du au [35]). Sur vingt-huit cas-patients avec des informations disponibles, vingt et un (75 %) étaient immunodéprimés ; trente et un des trentre-trois cas-patients (94 %) ont reçu des médicaments antiviraux, avant qu'on ait fourni un échantillon de virus. L'étude a montré que les immunodéprimés ont un risque plus élevé de complications respiratoires. Une pression médicamenteuse sélective explique probablement le développement de la résistance à l'oseltamivir, notamment chez les malades immunodéprimés. Les auteurs recommandent donc un suivi de la résistance aux antiviraux dans ce groupe[35]. D'autres recommandent aussi un meilleur ciblage de la vaccination vers les groupes à risque[38].
Stratégies d’utilisation de l’Oseltamivir (et des antigrippaux)
Proposition d'un fonds commun d’antiviraux
Les antiviraux sont très peu disponibles pour les pays pauvres ou le sont en quantité insuffisante. L’OMS et le groupe Roche ont dès l’été 2005 émis l’idée d'un stock d’un million de doses d’antigrippal oseltamivir (il en faudrait trois, rien que pour l’Asie du Sud-est). Roche s’est engagé à tenir le stock à disposition de l’OMS pendant cinq ans. L’OMS était aussi en 2005 en discussion avec un autre groupe pour obtenir d’autres médicaments antiviraux. Le , la France a proposé à l’Union Européenne que chaque État-Membre mette au pot commun 1 à 3 % de ses stocks d’antiviraux, sans parler encore d’un lieu de stockage et du conditionnement ou des modes d’attribution. À cette date, il y a 130 millions de traitements d’oseltamivir pour environ 2 % de la population mondiale (6,5 milliards de personnes). On en espère trois cents millions pour .
Évaluation du stock nécessaire
L’OMS recommande un stock pour au moins 25 % de la population (pour une vague grippale, mais souvent il y en a deux, voire trois). Il s’agit surtout de freiner et limiter la pandémie en attendant le vaccin qui ne pourra être produit en moins de six mois.
- Exemple : la Suisse pouvait en traiter deux millions de personnes.
- Elle justifie qu’il n’est pas utile d’acheter plus ou trop d’oseltamivir par le fait qu’« il n’y a jamais eu d’épidémie de grippe ayant touché 1⁄4 de la population ».
On lit souvent que la grippe espagnole s’était approchée d’un taux de 25 % de malades (quarante à cinquante millions de morts en 1918-1919 selon l’OMS). Mais en réalité ce chiffre est une moyenne qui ne doit pas cacher que certaines populations et/ou certains lieux ont été touchés à 100 %, et d’autres ont été quasi-épargnés. De plus, chaque pandémie se fait généralement en deux ou trois vagues, pour chacune desquelles on aimerait disposer d’un stock d’antiviraux si le vaccin n’est pas disponible ou si le virus a muté entre deux vagues.
La France possède ainsi un stock pour plus de 50 % de sa population. Le ministre français de la santé a en effet indiqué en , que le pays détenait suffisamment de médicaments antiviraux (dont Tamiflu) pour traiter trente-trois millions de malades.
Risques de « surprescription »
Des souches virales de H5N1 plus ou moins résistantes au Tamiflu sont déjà apparues en Asie. En 2007, des chercheurs[39] suédois ont suggéré de ne pas trop prescrire de Tamiflu, car un pourcentage significatif des molécules d’oseltamivir éliminées via l’urine ou les excréments dans les réseaux d’assainissement n’est pas — d’après leurs tests — dégradé lors du traitement des eaux usées par les stations d’épuration. Dans certains pays, dont le Japon, où le Tamiflu est très utilisé, les taux susceptibles d’être présents dans les égouts et eaux des milieux naturels ne sont plus négligeables selon les chercheurs.
Il y a un risque que les virus grippaux excrétés par des animaux ou des humains grippés, et éliminés dans les eaux de surface en aval des stations d’épuration, en contact avec le Tamiflu puissent contribuer au développement de résistances à l’oseltamivir. Roche estime de son côté qu’une telle résistance est improbable, mais des études[40] récentes ou en cours montrent que les hormones ou certains polluants perdus par les stations d’épuration ont un impact très significatif en aval de leurs émissaires.
En cas d’apparition de souches résistantes, outre que des cas difficiles de grippe saisonnière pourraient être plus difficiles à soigner, le risque serait qu’une pandémie puisse ne pas pouvoir être jugulée par le Tamiflu, si la souche en cause était résistante et le virus très contagieux (en , les cas humains de H5N1 repérés restent rares, mais ce sont presque tous des jeunes, et 201 malades sur 239 en sont morts, malgré le traitement au Tamiflu dans la plupart des cas).
Questions éthiques
- Comment déterminer à l’avance et en en débattant avec la société civile à qui sera attribué l’oseltamivir (ou d’autres antiviraux) disponible si une pandémie advenait, et dans quelle mesure il pourrait être utilisé en préventif. Il est aussi utilisé pour des animaux (chiens aux États-Unis).
- Faut-il le réserver à l’homme ?
- Quelle est l’influence de Donald Rumsfeld (actionnaire et ancien Chairman de Gilead Sciences (voir chapitre 1 : production du Tamiflu) sur la constitution des stocks de ce médicament ?
- Ne faut-il pas en offrir aux pays qui en ont le plus besoin pour bloquer l’épidémie à sa naissance, ou en faire un stock mondial commun ?
Les modes de diffusion jusqu’au destinataire final sont aussi une question importante (envoyé aux médecins, aux pharmacies, aux mairies, envoyé par la poste.. ?).
Certains médicaments traditionnels et huiles essentielles ont des effets antiviraux, mais n’ont pas été testés en tant que médicament. Quelle attitude avoir vis-à-vis de ces produits ?
L’engouement général des années 2004-2005 pour l’oseltamivir a été tempéré :
- même avec assez d’oseltamivir pour 10, 20 voire 30 % de la population, il y aura toujours des gens infectés, des gens à hospitaliser, dont « un certain nombre décèderont ».
Selon des études OMS de 2001 et 2002, ce médicament a permis de réduire les symptômes de grippe saisonnière de 38 %, mais même si 70 % de ceux qui ont pris de l’oseltamivir à titre préventif ne sont pas tombés malade de la grippe saisonnière, fin 2005 on manquait encore de statistiques sur la réduction de la mortalité dans le cas d’infection par le H5N1 pour les personnes traitées, faute d’essais cliniques et d’un nombre suffisant de retours d’expérience.
Chronologie
Le , le gouvernement du Royaume-Uni a annoncé qu’il constituerait un stock d’oseltamivir afin de pouvoir traiter un quart de la population du pays, en préparation d’une pandémie de grippe aviaire de sous-type H5N1. Cependant, les réserves devraient s’épuiser rapidement au niveau mondial en cas d’émergence pandémique. Vers la fin , Roche Holding AG a confirmé que l’énorme demande de Tamiflu avait saturé les limites de production actuelles, les nouveaux clients ayant alors à faire face à des délais pouvant monter à deux ans.
Afin de satisfaire la demande américaine, Roche a annoncé qu’il devrait ouvrir une nouvelle usine de production en Amérique du Nord durant la fin 2005.
Le , le laboratoire Roche a indiqué qu’il offrait à l’OMS trente millions de capsules d’oseltamivir permettant de soigner trois millions de personnes. Ce stock sera en priorité disponible pour les populations des pays pauvres incapables d’acheter rapidement un stock de ce médicament très coûteux en cas de menace épidémique. Le premier lot de dix millions de capsules devrait être livré début 2006 et le complément vers le milieu de l’année. Sous la pression de l’OMS et de l’OMC, le , il a annoncé vouloir négocier avec d’autres laboratoires pour autoriser la production d’oseltamivir sous licence. La production du médicament sera multipliée par dix d’ici fin 2006 par rapport aux chiffres de 2003.
Recherche
En , Roche dit poursuivre ses études sur :
- aspects virologiques précliniques (optimisation des doses aux souches ou variants du H5N1 ;
- registre de la grippe aviaire, pour collecter les données cliniques et virologiques utiles ;
- études de cas de prophylaxie post-exposition, pour produire des données rétrospectives et prospectives ;
- collaboration avec les NIH (National Institutes of Health) des États-Unis sur la comparaison de dosages doublés (150 mg deux fois par jour) comparés au traitement standard (75 mg deux fois par jour) pour la grippe saisonnière ou pandémique ;
- prophylaxie de long terme (26 semaines) contre H5N1 chez les travailleurs de secteurs essentiels : hôpitaux, sécurité… ;
- surveillance de la résistance de la grippe au Tamiflu ;
- possibilité de formulation intraveineuse ;
- capsule faiblement dosée pour les jeunes enfants ;
- rôle du Tamiflu et évaluation de son innocuité lors des vagues saisonnières de grippe.
Divers
L'oseltamivir fait partie de la liste des médicaments essentiels de l'Organisation mondiale de la santé (liste mise à jour en )[41].
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Kmietowicz Z (2015) Tamiflu reduces complications of flu, new review finds. BMJ, 350, h537 (résumé).
- Information Hospitalière, .
- « Roche prêt à fabriquer 400 millions de boîtes d'antigrippaux », Challenges, 4⁄05 / 2 009.
- (en) Kongkathip B, Akkarasamiyo S et Kongkathip N, « A new and efficient asymmetric synthesis of oseltamivir phosphate (Tamiflu) from d-glucose » Tetrahedron, 2015;71(16), 2393-2399 (résumé).
- Réponse du Ministre de la Santé et de la Solidarités à la question no 85689, Journal Officiel, .
- à ne pas confondre avec la badiane japonaise qui pousse principalement au Japon et en Thaïlande et contenant de la shikimine toxique (qui provoque des troubles allant jusqu’aux convulsions) dont l’utilisation interdite en France.
- OMS - Grippe aviaire.
- Cyril Hofstein, « Itineraire d'un remède à usage planétaire », Le Figaro Magazine, (lire en ligne).
- Matthieu Rosenberg, « La molécule du Tamiflu plus facile à produire », Bulletins Electroniques, Ambassade de France au Japon / ADIT, vol. Japon, no 396/BIO/2234, (lire en ligne).
- (en) Flu Treatment and Flu Prevention .
- (en) Fick J, Lindberg RH, Tysklind M, Haemig PD, Waldenström J, et al. (2007) Antiviral Oseltamivir Is not Removed or Degraded in Normal Sewage Water Treatment: Implications for Development of Resistance by Influenza A Virus, PLoS One 2(10): e986. DOI 10.1371/journal.pone.0000986.
- (en) Josef D. Järhult1 et al., « Environmental Levels of the Antiviral Oseltamivir Induce Development of Resistance Mutation H274Y in Influenza A/H1N1 Virus in Mallards », PLOS One, vol. 6, no 9, (lire en ligne).
- (en) Jefferson T, Neuraminidase inhibitors for preventing and treating influenza in healthy adults: systematic review and meta-analysis, BMJ, 2009;339:b5106.
- (en) Payne D, Tamiflu: the battle for secret drug data, BMJ, 2012;345:e7303.
- (en) BMJ open data campaign.
- « Foire aux questions sur la grippe porcine » [archive du ], sur who.int.
- « Éviter de prendre des médicaments pour rien » [archive du ], sur lefigaro.fr, (consulté le ).
- Pour les souches utilisées en 2007/2008, l'efficacité vaccinale est estimée à 72 % chez les moins de 65 ans, mais elle tombe à 57 % chez les plus de 65 ans. Bulletin du Réseau Sentinelles de l'INSERM, 10 au ).
- (en) Christie Keith, « Oseltamivir: Is There a New Treatment for Parvo? » [archive du ], sur Vet Tech, .
- (en) Graner S, Svensson T, Beau AB et al. Neuraminidase inhibitors during pregnancy and risk of adverse neonatal outcomes and congenital malformations: population based European register study, BMJ, 2017;356:j629.
- Revue Prescrire, no 284, .
- (en) New concerns about oseltamivir, Lancet, 2007, 369, 1056.
- (en) S.R. Maxwell, Tamiflu and neuropsychiatric disturbance in adolescents, BMJ, 2007, 334(7606), 1232-1233 (résumé).
- « Journal of Infectious Diseases », repris par Reuter (http://thanhniennews.com/healthy/?catid=8&newsid=7955).
- (en) Shuji Hatakeyama, Norio Sugaya, Mutsumi Ito et al. Emergence of Influenza B viruses with reduced sensitivity to neuraminidase inhibitors. JAMA. 2007 ; 297:1435-1442.
- (en) Dyer O, European agencies find 14% of flu isolates are resistant to oseltamivir, BMJ, 2008;336:298.
- spécialiste des virus grippaux au Québec.
- (en) Maki Kiso DVM et al. ; Resistant influenza A viruses in children treated with oseltamivir: descriptive study; DOI 10.1016/S0140-6736(04)16934-1, The Lancet, vol. 364, no 9436, p. 759-765, 2004-08-28 (Résumé).
- (en) Q. Mai Le, Maki Kiso, Kazuhiko Someya et al., Avian fluIsolation of drug-resistant H5N1 virus, Nature, 2005, no 437, p. 1108-1108.
- (en) de Jong MD, Tran TT, Truong HK, et al. Oseltamivir resistance during treatment of influenza A (H5N1) infection. N Engl J Med. 2005;353:2667-2672.
- InVS, Asie du Sud-Est. Résistance de A(H5N1) à l’oseltamivir[PDF], Bulletin Hebdomadaire International, 2007.
- (en) Jennifer McKimm-Breschkin, Paul Selleck, Tri Usman et Michael Johnson, Indonesian H5N1 isolates demonstrate decreased sensitivity to oseltamivir. VIth conference on Options for the Control of Influenza, 17-, Toronto, Ontario, Canada.
- InVS « Résistance à l’Oseltamivir de souches A(H5N1) Asie du Sud-est, Égypte[PDF] », .
- (en) Calatayud L, Lackenby A, Reynolds A, McMenamin J, Phin NF, Zambon MC, et al. Oseltamivir-resistant pandemic (H1N1) 2009 virus infection in England and Scotland, 2009–2010. Emerg Infect Dis. 2011 Oct; Lire l'article (en anglais)[PDF].
- (en)Centers for Disease Control and Prevention. Updated interim recommendations for the use of antiviral medications in the treatment and prevention of influenza for the 2009–2010 season [cited 2010 Dec 18].
- (en) Strong M, Burrows J, Stedman E, Redgrave P. Adverse drug effects following oseltamivir mass treatment and prophylaxis in a school outbreak of 2009 pandemic influenza A(H1N1) in June 2009, Sheffield, United Kingdom. Euro Surveill (en) 2010;15:pii:19565.
- (en) CDC, M.F. Ducatez et al. Vaccination campaigns and public health response should focus on high-risk groups. - Multiple Reassortment between Pandemic (H1N1) 2009 and Endemic Influenza Viruses in Pigs, United States Résumé.
- (en) « Researchers warn about overprescribing Tamiflu », Reuters, .
- Colloque Agence de l’eau Artois-Picardie, Les perturbateurs endocriniens et la qualité des milieux aquatiques, Lille, .
- (en) WHO Model List of Essential Medicines, 18th list[PDF], .
Voir aussi
Articles connexes
- Synthèse totale de l'oseltamivir
- Influenza (grippe), H5N1, pandémie, risque pandémique
- Amantadine (autre médicament dans le traitement de l’influenza)
- Zanamivir (autre inhibiteur de la neuraminidase)
Liens externes
- Compendium suisse des médicaments : spécialités contenant Oseltamivir
- RCP Tamiflu 75 sur le site du laboratoire Roche[PDF]
- Notice du Tamiflu sur le site du laboratoire Roche[PDF]
Bibliographie
- M. Gerson, « Liens d’intérêts et conclusions de revues systématiques », Médecine, 2015, 11(1), 8-8 (résumé).
- (en) Y. K. Gupta, M. Meenu et P. Mohan, « The Tamiflu fiasco and lessons learnt », Indian Journal of Pharmacology (en), 2015, 47(1), 11.
- (en) M. Long, « Side effects of Tamiflu: clues from an Asian single nucleotide polymorphism », Cell Research, 2007, 17(4), 309-310.
- (en) W. L. Wang, Q. Y. Wu,Z. M. Wang, H. Y. Hu, N. Negishi et M. Torimura, Photocatalytic degradation of the antiviral drug Tamiflu by UV-A/TiO 2: Kinetics and mechanisms, Chemosphere, 2015, 131, 41-47 (résumé).
- (en) B. Clinch et J. Smith, Review Roche perspectives on Tamiflu[PDF], .