Acide N-glycolylneuraminique
L'acide N-glycolylneuraminique, ou Neu5Gc, est l'un des deux types fondamentaux d'acides sialiques, avec l'acide N-acétylneuraminique dont il dérive, qui sont rencontrés dans le règne animal. Il est toutefois absent chez l'homme et chez les oiseaux. Son existence a d'abord été détectée en tant que xéno-antigène provoquant une réaction immune forte chez l'homme à la suite d'une sérothérapie. La cible des anticorps, appelés hétérophiles, a finalement été identifiée à des épitopes contenant l'acide N-glycolylneuraminique situés à l'extrémité non-réductrice des chaînes oligosaccharidiques des glycosphingolipides et des glycoprotéines.
| Acide N-glycolylneuraminique | |
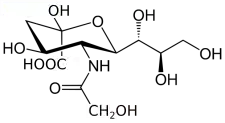
| |
| Structure de l'acide N-glycolyl-α-D-neuraminique | |
| Identification | |
|---|---|
| No CAS | |
| PubChem | 123802 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C11H19NO10 |
| Masse molaire[1] | 325,269 3 ± 0,013 3 g/mol C 40,62 %, H 5,89 %, N 4,31 %, O 49,19 %, |
| Unités du SI et CNTP, sauf indication contraire. | |
L'acide N-glycolylneuraminique n'est autre que l'acide hydroxy-acétyl-neuraminique. L'absence de Neu5Gc chez l'homme provient donc d'un défaut d'hydroxylation de Neu5Ac. Après plusieurs années de tâtonnement pour savoir à quelle étape de la biosynthèse des oligosaccharides se situait l'hydroxylation, il a été découvert qu'elle s'effectue au niveau du précurseur donneur des sialyltransférases, la cytidine monophosphate Neu5Ac. Le gène de la CMP-Neu5Ac hydroxylase a été cloné et il est apparu que, effectivement, il est déficient chez l'homme.
Histoire de la découverte
Tout comme les groupes sanguins ABO, le rôle de l'acide N-glycolylneuraminic a été découvert fortuitement par des observations de sérologie. En 1924, Marius Hanganutziu, médecin biologiste au laboratoire de l'hôpital de Cluj, constate une forte agglutination des globules rouges de Mouton au cours d'un test de Bordet-Wassermann. Il constate que le même sérum contient un titre élevé d'anticorps qui agglutinent aussi les globules rouges de Cheval, de Lapin, de Veau ou de Porc. Après enquête, il apprend que le patient s'est blessé avec un outil 10 jours auparavant, qu'il a reçu un sérum anti-tétanique et qu'il a développé une maladie sérique 5 jours plus tard. Supposant que les agglutinines avaient été produites en réaction au sérum anti-tétanique de Cheval, il a examiné le sérum d'autres individus ayant reçu un sérum de Cheval à titre thérapeutique ou expérimental. Tous les sérums contenaient des agglutinines dirigés contre les globules rouges de multiples espèces sauf de l'espèce humaine et parmi les 100 sérums humains contrôles, seuls quatre contenaient des agglutinines à un titre faible[2].
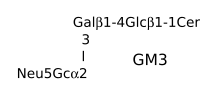
Deux ans plus tard, le docteur Deicher, à Berlin, a aussi observé que les sérums étrangers provoquaient l'apparition d'anticorps hétérospécifiques. Il a noté que les sérums de Poule ne donnaient pas naissance au même type d'anticorps[3]. À la suite de ces deux publications, l'antigène inconnu, qui suscitait ces anticorps, a été appelé antigène de Hanganutziu-Deicher
Il a fallu attendre un demi-siècle pour que le mystère s'éclaircisse. En 1977, une équipe japonaise découvre que les immonuglobulines de patients immunisés avec un sérum de Cheval se fixent sur les gangliosides GM3 et sialyl-paragloboside contenant un acide N-glycolylneuraminique[4]. Le résultat a été confirmé un groupe américain[5].
CMP-Neu5Ac hydroxylase
Chez l'homme, l'acide N-acétylneuraminique est le seul acide sialique produit, car la CMP-acide N-acétylneuraminique hydroxylase, qui convertit l'acide N-acétylneuraminique en acide N-glycolylneuraminique par hydroxylation, n'est pas fonctionnelle chez les humains[6], contrairement par exemple aux singes. Le gène qui code cette enzyme est bien présent dans le génome humain sous la forme du pseudogène CMAH[7], devenu inactif à la suite d'une mutation survenue après la divergence entre humains et singes[8] mais juste avant l'apparition du genre Homo[9]. Il est possible que cette mutation ait été favorisée par la prévalence d'une forme de paludisme causée par un Plasmodium virulent se liant préférentiellement à des érythrocytes riches en acide N-glycolylneuraminique plutôt qu'à ceux riches en acide N-acétylneuraminique ; cet avantage aurait cependant disparu avec l'apparition de parasites se liant également aux globules rouges riches en acide N-acétylneuraminique[9].
Répartition
On trouve l'acide N-glycolylneuraminique chez la plupart des mammifères à l'exception par exemple des humains, des furets, des ornithorynques, des certaines races de chiens, ou encore des singes du Nouveau Monde[10]. On en trouve des traces chez l'homme, qui proviennent de l'alimentation, notamment des animaux consommés, particulièrement de la viande rouge telles que l'agneau, le porc et le bœuf. On en trouve également dans les produits laitiers, mais en moindre quantité. On n'en trouve pas dans les volailles, et seulement des traces dans les poissons.
Neu5Gc et cancers
Chez l'homme, l'acide N-glycolylneuraminique est présent en quantité plus élevée dans les cancers et les selles, provenant du régime alimentaire. Les cellules du corps humain absorberaient ce composé par macropinocytose et le transféreraient dans leur cytosol par une sialine. Il est possible — mais cela reste à confirmer[9] — que l'acide N-glycolylneuraminique soit reconnue comme antigène par le système immunitaire et que sa liaison à des anticorps anti-Neu5Gc déclenche des inflammations chroniques ; les humains possèdent des niveaux souvent élevés d'anticorps anti-Neu5Gc[7]. Alimenter des souris knock-out Neu5Gc avec une alimentation riche en acide N-glycolylneuraminique et en anticorps anti-Neu5Gc pour simuler un système humain conduit à une inflammation systémique chez l'animal, qui a une probabilité cinq fois plus élevée de développer un carcinome hépatocellulaire[11]. Une autre étude n'a cependant révélé aucune corrélation positive entre des niveaux élevés d'anticorps anti-Neu5Gc et l'accroissement d'un risque de cancer du côlon[12].
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Marius Hanganutziu, « Hémagglutinines hétérogénétiques après injection de sérum de cheval », Comptes rendus de la Société roumaine de biologie, , p. 1457-1459
- (de) H. Deicher, « Über die Erzeugung heterospezifischer Hämagglutinine durch Injektion artfremden Serums (Sur la production d'hémagglutinines hétérospécifiques à la suite de l'injection de sérums étrangers) », Z Hyg InfektKrankh Vol.106, , p. 561-579
- (en) H Higashi, M Naiki, S Matuo, K Ōkouchi, « Antigen of “serum sickness” type of heterophile antibodies in human sera: identification as gangliosides with N-glycolylneuraminic acid », Biochem. Biophys. Res. Commun. Vol.79, , p. 388-395
- (en) JM Merrick, K Zadarlik, F Milgrom, « Characterization of the Hanganutziu-Deicher (serum-sickness) antigen as gangliosides containing N-glycolylneuraminic acid », Int. Arch. Allergy Appl. Immun. Vol.57, , p. 477-480
- (en) Ajit Varki, « Loss of N‐glycolylneuraminic acid in humans: Mechanisms, consequences, and implications for hominid evolution », American Journal of Physical Anthropology, vol. 116, no 533, , p. 54-69 (PMID 11786991, DOI 10.1002/ajpa.10018, lire en ligne)
- (en) Darius Ghaderi, Rachel E Taylor, Vered Padler-Karavani, Sandra Diaz et Ajit Varki, « Implications of the presence of N-glycolylneuraminic acid in recombinant therapeutic glycoproteins », Nature Biotechnology, vol. 28, no 8, , p. 863-867 (PMID 20657583, PMCID 3077421, DOI 10.1038/nbt.1651, lire en ligne)
- (en) Hsun-Hua Chou, Hiromu Takematsu, Sandra Diaz, Jane Iber, Elizabeth Nickerson, Kerry L. Wright, Elaine A. Muchmore, David L. Nelson, Stephen T. Warren et Ajit Varki, « A mutation in human CMP-sialic acid hydroxylase occurred after the Homo-Pan divergence », Proceedings of the National Academy of Sciences of the United States of America, vol. 95, no 20, , p. 11751-11756 (PMID 9751737, PMCID 21712, DOI 10.1073/pnas.95.20.11751, JSTOR 49259, Bibcode 1998PNAS...9511751C, lire en ligne)
- (en) Ajit Varki, « Uniquely human evolution of sialic acid genetics and biology », Proceedings of the National Academy of Sciences of the United States of America, vol. 107, no 2, , p. 8939-8946 (PMID 20445087, PMCID 3024026, DOI 10.1073/pnas.0914634107, Bibcode 2010PNAS..107.8939V, lire en ligne)
- (en) Preston S. K. Ng, Raphael Böhm, Lauren E. Hartley-Tassell, Jason A. Steen, Hui Wang, Samuel W. Lukowski, Paula L. Hawthorne, Ann E. O. Trezise, Peter J. Coloe, Sean M. Grimmond, Thomas Haselhorst, Mark von Itzstein, Adrienne W. Paton, James C. Paton et Michael P. Jennings, « Ferrets exclusively synthesize Neu5Ac and express naturally humanized influenza A virus receptors », Nature Communications, vol. 5, , p. 5750 (PMID 25517696, PMCID 4351649, DOI 10.1038/ncomms6750, lire en ligne)
- (en) Annie N. Samraj, Oliver M. T. Pearce, Heinz Läubli, Alyssa N. Crittenden, Anne K. Bergfeld, Kalyan Banda, Christopher J. Gregg, Andrea E. Bingman, Patrick Secrest, Sandra L. Diaz, Nissi M. Varki et Ajit Varki, « A red meat-derived glycan promotes inflammation and cancer progression », Proceedings of the National Academy of Sciences of the United States of America, vol. 112, no 2, , p. 542-547 (PMID 25548184, PMCID 4299224, DOI 10.1073/pnas.1417508112, JSTOR 49259, lire en ligne)
- (en) Jean-Paul Soulillou, Caner Süsal, Bernd Döhler et Gerhard Opelz, « No Increase in Colon Cancer Risk Following Induction with Neu5Gc-Bearing Rabbit Anti-T Cell IgG (ATG) in Recipients of Kidney Transplants », Cancers, vol. 10, no 9, , p. 324 (PMID 30213027, PMCID 6162487, DOI 10.3390/cancers10090324, lire en ligne)