Acide hyaluronique
L'acide hyaluronique est un type de polysaccharide (plus précisément une glycosaminoglycane) non fixé à une protéine centrale et largement réparti parmi les tissus conjonctifs, épithéliaux et nerveux animaux.
| Acide hyaluronique | |

| |
| Identification | |
|---|---|
| No CAS | |
| No ECHA | 100.029.695 |
| No CE | 232-678-0 |
| Code ATC | D03, M09, R01, S01 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C14H21NO11 |
| Masse molaire[1] | 379,316 6 ± 0,016 2 g/mol C 44,33 %, H 5,58 %, N 3,69 %, O 46,4 %, |
| Composés apparentés | |
| Autres composés | |
| Unités du SI et CNTP, sauf indication contraire. | |
Il se trouve notamment dans l'humeur vitrée et le liquide synovial. Il est l'un des principaux composants de la matrice extracellulaire ainsi que de certaines mucoprotéines lorsqu'il est associé à une fraction protéique.
Depuis les années 1990, il est très utilisé dans divers dispositifs médicaux, médicamenteux et cosmétiques (présenté dans ce dernier cas comme « antistatique, humectant, hydratant, conditionneur cutané, anti-âge, etc. »), bénéficiant d'un effet de mode grandement soutenu par une large publicité commerciale.
Contribuant de façon significative à la prolifération et à la migration des cellules, l'acide hyaluronique est aussi impliqué dans la progression de certains cancers.
Étymologie
Le mot « hyaluronique » provient du grec hyalos (traduit par « vitreux », cet acide ayant été isolé de l'humeur vitrée), accompagné du suffixe « uronique » (du fait de son importante teneur en acide uronique).
Structure et aspects biochimiques
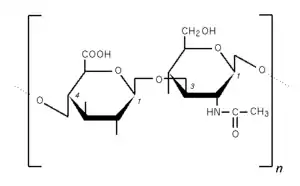
La structure chimique de l'acide hyaluronique a été déterminée dans les années 1930 dans le laboratoire du chercheur en ophtamologie américain Karl Meyer.
La chaîne hyaluronique est un polymère de disaccharides (des sucres composés d'acide D-glucuronique et de D-N-acétylglucosamine et liés entre eux par des liaisons glycosidiques alternées β-1,4 et β-1,3)[2].
Les polymères de cette unité récurrente (monomère) ont in vivo une masse moléculaire comprise entre 105 et 107 Da[2].
L'acide hyaluronique est stable du point de vue énergétique, en partie à cause des aspects stéréochimiques des disaccharides qui le composent.
L'acide hyaluronique est le plus simple glycosaminoglycane (GAG) et est le seul d'entre eux à ne pas être sulfaté. Il se retrouve dans tous les tissus (essentiellement embryonnaires), possède une chaîne très longue (des milliers de sucres) et n'a qu'un seul type d'unité disaccharidique. Il est lié à la protéine de façon non covalente. C'est le GAG le plus phylogénétiquement précoce.
Dans l'organisme
Il est synthétisé par les hyaluronanesynthases (HAS), formées dans les cellules mésenchymateuses, épithéliales et immunitaires ainsi que dans les cellules souche mésenchymateuse et hématopoïétique[2].
Comme il est naturellement présent dans le corps humain, certains en ont déduit qu'il était sans danger et adapté à de nombreuses applications biomédicales ou cosmétiques visant ces tissus.
Le premier produit biomédical à base d'acide hyaluronique, Healon, développé dès les années 1970, a été approuvé pour des usages en chirurgie ophtalmique : transplantation de cornée, cataracte, glaucome, etc.
De nombreux et différents types d'acide hyaluronique (d'un poids moléculaire variant entre 105 et 5 × 106 Da) sont trouvés dans les organismes animaux (une estimation a donné environ 15 grammes chez l’adulte humain, avec un turnover de l’ordre de 1/3 (soit 1/3 de l’acide hyaluronique de l’organisme dégradé et synthétisé chaque jour), pour une teneur sérique variant d'un « facteur 10 » (de 10 à 100 microgrammes par litre de sang, toujours très élevée dans le derme (200 mg/L en moyenne). L'acide hyaluronique est naturellement présent dans divers tissus tels que la peau (essentiellement dans l'espace intercellulaire de l'épiderme[3]) et le cartilage. Sa teneur est anormalement élevée dans le sérum de patients porteurs de certaines maladies (dont la cirrhose, l'arthrite rhumatoïde et la sclérodermie)[4].
Fonctions
Dans les articulations, l'acide hyaluronique participe à la lubrification et à la protection des zones de frottement, en augmentant la viscosité du liquide synovial et en maintenant l'élasticité du cartilage.
Dans la peau, il comble les espaces intercellulaires et participe à l'hydratation et la cohésion des tissus. Il contrôle l'angiogenèse[5].
Il joue aussi un rôle dans l'inflammation et la cicatrisation[6], mais aussi dans la prolifération de certains cancers[7] et les réactions immunitaires[8].
L'acide hyaluronique est impliqué dans la croissance cellulaire. Dans les années 1980, sur des cultures cellulaires in vitro de fibroblastes de murins, on démontre une corrélation positive entre le taux d'acide hyaluronique et le degré et la vitesse de prolifération cellulaire : en phase de croissance logarithmique des cellules cutanées, la quantité d’acide hyaluronique endogène augmente[9]. Des essais in vitro sur le fibroblaste humain montrent aussi que l’acide hyaluronique favorise la synthèse de tubuline (une protéine majeure du cycle cellulaire)[10]. Certains en déduisent que des acides hyaluroniques non endogènes (apportés par des crèmes ou des injections) pourraient contribuer à supprimer des rides ou à retendre des tissus devenus mous ou flasques avec l'âge.
Turn-over : à la manière des tissus osseux, la chaîne hyaluronique est produite en permanence, mais aussi dégradée en permanence. Ses produits de dégradation ont des propriétés spécifiques : ils se fixent à la protéine CD44, activant les récepteurs de type Toll 4 et 2[11] intervenant dans l'inflammation.
Histoire médicale
En 1934, deux chercheurs américains en ophtalmologie (Karl Meyer et John Palmer) s'intéressent à un mucopolysaccharide associant la de N-glucosamine et l'acide glucuronique en proportions équimolaires, qu'on a d'abord trouvé dans l’humeur vitrée, le cordon ombilical et la synovie, les reins et la peau de bovins et des porcins mais aussi chez les humains[12]. Dans les années 1950, on s'interroge encore sur ses fonctions physiologiques[13]
On retrouve aussi la molécule chez certaines bactéries (dont les dangereux streptocoques hémolytiques de type A et C)[12]. Il apparaît que, selon sa localisation, la molécule d’acide hyaluronique présente un poids moléculaire variable, témoin d’un degré de polymérisation plus ou moins élevé[14].
On note aussi que des taux importantes d'acide hyaluronique dans certains fluides biologiques peuvent indiquer des pathologies très différentes (par exemple dans les sécrétions pulmonaires des asthmatiques et de certains patients en train de développer certains cancers du poumon (mésothéliomes)[15].
Histoire économique
Dans les pays riches où le baby boom est suivie par une phase de vieillissement de la population, l'acide hyaluronique suscite de nombreux espoirs médicaux et commerciaux de la part de l'industrie pharmaceutique et des cosmétiques (principalement de la chirurgie reconstructrice).
Ceci en a fait un sujet travaillé par de nombreux laboratoires dans le monde, avec plus de 3000 articles médicaux publiés sur le sujet, selon Pubmed, entre 2019 et 2020)[16].
En 2012, le marché de l'acide hyaluronique en pharmacie a été estimé à 135 M€.
Histoire industrielle et fabrication
L'acide hyaluronique est principalement issu de deux procédés :
- Extraction de crêtes de coq (obtenues à bas prix en tant que déchet d'abattoir recyclé), après broyage, traitement chimique et purification[17] ;
- Fermentation bactérienne : les filaments d'acide hyaluronique sont synthétisés par des bactéries programmées pour cela. Novozymes (Danemark) a finalisé en 2012 la construction en Chine d'une unité de production d'acide hyaluronique, par fermentation de bactéries Bacillus subtilis. Les risques de contamination par des impuretés virales ou des endotoxines (fabrications à partir des crêtes de coq ou par fermentation de bactéries streptococcus) sont ainsi réduits[18].
- Actuellement, l'acide hyaluronique est obtenu par fermentation de végétaux qui en contiennent naturellement, tels que le blé, le maïs ou le soja.
L'avènement du génie génétique et des OGM utilisés en fermenteur a permis que l’acide hyaluronique soit ensuite plutôt produit par des cellules bactériennes[16].
Viscosité
La viscosité du gel est proportionnelle au poids moléculaire (exprimé en daltons) et à la longueur des chaînes du polymère. La viscosité détermine aussi la vitesse de dégradation du produit après implantation.
Dégradation
Des études ont montré une influence des processus inflammatoires et la productions de radicaux libres dans la dégradation des chaînes d'acide hyaluronique au sein des articulations dans le cadre de pathologies inflammatoires articulaires[19] - [20]. L'influence de l'exposition au soleil et la production de radicaux libres qui en résulte[21] pourrait avoir le même effet sur sa dégradation.
in vivo, l'acide hyaluronique est dégradé par une enzyme dédiée : l’hyaluronidase, présente au sein de tout organisme et permettant le renouvellement constant des chaînes d'acide hyaluronique dans l'organisme. Un humain moyen de 70 kg contiendrait environ 15 g d'acide hyaluronique dont 5 g serait renouvelé chaque jour. La peau contient à elle seule 50 % de cette quantité d'acide hyaluronique[22].
Efficacité, échecs et effets secondaires
Cet acide a été promu au nom du fait qu'il est naturellement présent dans le corps. La communication de l'industrie des cosmétique omet souvent de dire qu'il est également détruit dans le corps humain, faisant que ses effets ne sont pas durables (selon une étude prospective (2011), certains acides hyaluroniques de poids moléculaire moyen sont efficaces contre la douleur liée à l’hypertrophie synoviale avec aussi un effet anti-inflammatoire (sur le critère de l’activité doppler), mais l'effet ne perdurera pas plus que jusqu’à moins de 25 semaines.
On l'a introduit dans de nombreuses crèmes de beauté et produits similaires supposés faire disparaitre les rides ou d'autres imperfections du corps, développé à grand renfort de publicité depuis la fin du XXe siècle.
Les médecines esthétique et prétendument anti-âge se sont aussi largement approprié l'acide hyaluronique, alors souvent utilisé en injections de comblement, parfois associé à la chirurgie esthétique. Mais des effets secondaires, parfois graves son apparus :
- apparition d'irrégularités cutanées ou sous-cutanées, inesthétiques ;
- injections mal réalisées (par exemple dans le cas d'infiltrations non échoguidées dans les poches synoviales des articulations (sans échoguidage, selon les études, le produit serait administré hors de l'articulation jusqu'à 42 % des cas) ;
- graves nécroses tissulaires induites par les injections intra-vasculaires, potentiellement à risque de provoquer[23] a imposé la nécessité de formaliser la procédure à suivre en cas de survenue de complication[24] ;
- survenue de cécité (complication la plus grave, avec le risque nécrotique)[25].
Concernant la viscosupplémentation, dans de nombreux cas, il ne se montre pas plus efficace qu'un placebo ou un corticoïde, mais son effet semble parfois plus prolongé dans le temps (par rapport à celui du corticoïde ou du placebo[26]).
Tolérance
L’hyaluronidase, qu'elle soit d'origine humaine recombinante ou ovine, si elle est pure, utilisée à ce type de fins ne présente généralement pas à ce jour de problème de tolérance (même à forte dose), mais des cas de réactions allergiques sont documentés, imposant un test préalable[27]. Le profil de réaction de l'acide hyaluronique à l’hyaluronidase dépend du type d'acide hyaluronique utilisé[28] mais aussi de l’hyaluronidase utilisée[29].
Applications médicales
Viscosupplémentation
Ce sont les usages qui visent à diminuer le frottement des cartilages dans la capsule synoviale (qui renferme le liquide lubrifiant l'articulation et aidant le cartilage à constamment se régénérer). Des acides hyaluroniques sont ainsi utilisés pour soulager certaines formes d'arthrose, alors administrés sous forme d'injections dans certaines articulation (du genou en général). Ces traitements devraient théoriquement augmenter la viscosité du liquide synovial et ainsi améliorer la lubrification de l'articulation, mais en 2015, leur efficacité sur les douleurs n'était toujours pas démontrée[30], et le rapport bénéfices/risque d'effets secondaires a finalement été jugé défavorable[31].
Insémination artificielle, FIV/ICSI
Ces acides étant très présents dans le cordon ombilical et l'embryon, on s'est demandé s'il serait utile d'enrichir le milieu de transfert embryonnaire en certains acides hyaluroniques (en laboratoire ou lors de réalisations de FIV/ICSI) pour peut-être augmenter la probabilité de survenue de grossesses cliniques (GC) et d’implantation (comparativement aux résultats obtenus sur des milieux de transfert traditionnel)[32] ; les résultats des études et expériences sont contradictoires. Une légère efficacité est constatée pour les taux de grossesse et d'implantation, mais l'amélioration n'est décelable que chez les femmes de plus de 35 ans et/ou ayant connu au moins un échec d’implantation précédent[32].
Cancérologie
- Une corrélation positive a été démontrée entre l'augmentation des taux de produits de dégradation de l'acide hyaluronique dans le sang, et le degré de malignité de certains cancers (ex. : cancer du sein[33] - [34]). Ceci fait de ces produits de dégradation des bioindicateurs en cancérologie (permettant de suivre l'évolution de la maladie).
Ophtalmologie
Certains acides hyaluroniques favorisent la reconstitution et la cicatrisation des tissus (principalement après une opération de la cataracte). En collyre, ils peuvent aussi favoriser l'hydratation de la cornée.
Dans la sphère ORL et digestive
On trouve des pastilles adoucissantes destinées à calmer l'extinction de voix, ou utilisées dans les traitements d'atteintes aphteuses de la muqueuse buccale (application locale).
Des acides hyaluroniques sont utilisés pour limiter les frottements entre aliments érosifs et/ou acides et la muqueuse gastro-œsophagienne ; pour atténuer certaines douleurs et accélère la cicatrisation.
À température corporelle, ils forment un hydrogel naturellement bio-adhésif se répartissant sur la paroi œsophagienne[37], la protégeant ainsi des dommages causés par les acides gastriques et la pepsine[38]. L'acide hyaluronique et le sulfate de chondroïtine soulagent des symptômes du reflux[38] - [39] - [40] et contribuent à la régénération et à la cicatrisation de la muqueuse endommagée[41] - [42] - [43].
Il est utilisé sous forme liquide pour atténuer les effets du reflux gastro-œsophagien ; alors combiné à du sulfate de chondroïtine et de poloxamère 407[38].
Applications esthétiques
Contre les rides
Depuis le début des années 2000, l'acide hyaluronique est utilisé en médecine esthétique, dont [liste incomplète] comme produit injectable de comblement de rides. Des produits à base d'acide hyaluronique [tels que Teosyal (du laboratoire Teoxane), Restylane (du laboratoire Galderma-Q-Med), Captique (produit par Genzyme/Inamed), Juvederm (par Inamed/Allergan), Hylaform (de Biomatrix), Belotero (de Merz pharmaceuticals), Varioderm (de Adoderm GmbH/Medical Aesthetics group), Emervel (de Galderma), Teosyal (de Lifestyle Aesthetics/Teoxane Laboratories), HydraFill (de Allergan), Surgiderm (de Allergan), Hyaluderm (de LCA Pharmaceutical), Stylage (de Vivace Laboratories), Perlane (de Medicis Aesthetics)][44] - [45] - [46] tendent à supplanter les injections de collagène, car l'acide hyaluronique a sur eux plusieurs avantages, dont :
- une bonne tolérance biologique : les cas d'allergies sont exceptionnels[47] ;
- des formulations variées, permettent d'obtenir des propriétés différentes selon le degré de réticulation du produit et une adaptabilité importante en fonction de la zone à traiter. Un produit fluide est plus hydratant qu'un gel épais formateur de volume (produit très réticulé) ;
- propriétés hydratantes (même à faible dose). Certains laboratoires ont mis au point des crèmes anti-rides à base d'acide hyaluronique, dont l'efficacité est par ailleurs discutée[48] - [49].
Les usages de l'acide hyaluronique en médecine esthétique peuvent être catégorisés selon le but recherché par les injections.
Correction de volume du visage
La correction des volumes du visage permet de redonner du volume à une zone qui aurait perdu de la projection par les processus normaux du vieillissement (la perte de masse osseuse, musculaire et graisseuse), ou la correction de volumes physiologiquement insuffisants.
Pour ces corrections de volume les produits choisis sont plutôt fortement réticulés, et injectés en profondeur, parfois directement au contact de l'os sous-jacent pour pouvoir projeter au maximum les volumes.
Ce type de procédure est adapté à[50] :
- la correction de tempes creuses ;
- la projection des pommettes ;
- la masculinisation d'une mâchoire ;
- la projection du menton ;
- certains défauts d'aspect du nez sont accessibles aux injections ;
- les joues creuses.
D'autre défauts de volumes sont plus superficiels et nécessitent un acide hyaluronique modérément réticulé, en effet plus un produit est réticulé et plus il aura tendance à conserver sa forme, si le produit est injecté à proximité de la surface de la peau, on aura facilement tendance à le voir sous forme d'une boule visible à la surface de la peau. Pour ces défauts, l'injection est sous-cutanée, et est adaptée à :
- la correction de cernes creux ;
- le comblement de sillons-nasogéniens ;
- le comblement de plis d'amertume ;
- l'augmentation du volume des lèvres.
La séance d’injections d’acide hyaluronique dure environ quinze minutes. Le spécialiste injecte l’acide hyaluronique dans le derme, à quelques millimètres de profondeur. Les effets de l’acide hyaluronique sont immédiats après injection et ont une durée de vie d’environ six à neuf mois. Par ailleurs, l’acide hyaluronique est résorbable, les effets non-désirés sont donc transitoires[51].
Correction des volumes du corps
On utilise également, non sans risques, un gel d'acide hyaluronique (ex. : Macrolane) pour l'augmentation de certains volumes corporels (fesses, mollets, pectoraux, pénis) ou contre la lipoatrophie induite par le VIH/Sida.
Les propriétés des acides hyaluroniques permettent théoriquement de redonner du volume à toutes les parties du corps qui en manqueraient[52], par exemple au niveau des fesses.
Ses effets transitoires et les quantités parfois importantes à injecter ne font toutefois pas des injections d'acide hyaluronique la technique de référence pour la correction des volumes du corps.
Dans la sphère génitale, des injections d'acide hyaluronique sont parfois utilisées chez l'homme ou la femme pour :
- augmenter le volume du gland du pénis[53], parfois dans le but de traiter l'éjaculation précoce[54]. Le résultat imite souvent mal une forme naturelle (bourrelets autour de la zone d'injection), mais avec des résultats moins inesthétiques qu'en cas d'injection de graisse autologue, opération souvent compliquée par la formation de nodules, de graisse calcifiée, de déformations du pénis, voire de lipogranulome sclérosant[55] ;
- augmenter le volume/diamètre du pénis[56].
Pour cet usage (parfois auto-pratiqué avec alors des risques plus ou moins graves (comme pour l'injection de silicone fluide, d'huiles, de paraffine, de certaines pommade, de vaseline, ou de collagène, etc.), selon les produits, le receveur, et le type d'injection), l'utilisation de gel d'hyaluronate (Perlane, Juvederm, Surederm)[57], des effets secondaires différés désastreux sont possibles, nécessitant parfois l'ablation du pénis ou de complexes opérations de reconstruction[46].
L'injection de gel d'acide hyaluronique directement dans la couche fasciale de la tige du pénis a été utilisée. Elle a permis à Kwak et al. (2011), par exemple, de faire passer une circonférence pénienne de 7,48 ± 0,35 cm à 11,41 ± 0,34 cm, avec encore un diamètre de 11,26 ± 0,33 cm jusqu'à 18 mois après, sans complication lors de la période de suivi dans ce cas[58].
La méthode est a priori moins dangereuse que celle consistant à injecter de la paraffine (source de Paraffinoma[59] et d'ulcère du pénis[60]) ou du silicone liquide par exemple entre la peau du pénis et le corps caverneux sur les côtés dorsal et latéral de la tige du pénis[61], moyen très controversé de donner une impression de pénis plus épais, signalé pour la première fois en 1973 par Arthaud (qui a eu à traiter un lipogranulome et une sclérose du pénis induits par une telle injection)[62] - [63]. Cet usage a été décrit comme méthode d'élargissement de la circonférence du pénis, mais non recommandée en raison de nombreuses complications, dont douleur, ecchymoses, altération mentale, ou, plus gravement pneumonite[64] ou embolie[65] (si le silicone est injecté directement dans le système vasculaire). De plus, l'injection de silicone liquide dans le pénis augmente la possibilité d'endommager les vaisseaux sanguins et les nerfs, provoquant ainsi une perte de sensation et une dysfonction érectile[66]. En 2007, au moins 327 cas de séries d'expériences d'amélioration de la circonférence du pénis à l'aide de silicone liquide avaient déjà été rapportées par la littérature médicale[67] ;
- réduire le diamètre vaginal (ce qui est notamment supposé aider la stimulation du point G) et/ou pour corriger certains aspects cosmétiques du vagin[68].
Lissage de surface cutané
Au cours de la vie, des rides se forment naturellement sur la peau, et notamment sur le front, entre les yeux (ride du lion), au coin externe des yeux (ride de la patte d'oie), autour de la bouche, sur les joues, sur le cou, etc. Elles sont liées au vieillissement cutané, à l'effet du soleil notamment, et à des mécanismes de perte musculaires (y compris quand on mâche moins).
Un traitement fréquent est l'injection de toxine botulique (pour bloquer le mécanisme basal) ; l'injection d'acide hyaluronique est parfois proposée après ou avant ce traitement, pour venir, plus ou moins, lisser la surface cutanée en apportant du volume sous le pli de la ride à traiter[69]. Les injections sont dans ce cas préférentiellement intra dermiques et utilisent des acides hyaluroniques peu réticulés.
Hydratation de la peau
Cet acide a un effet dit hydratant[70] à faible dose (1 % suffit dans une crème)[71], et la communication publicitaire des laboratoires de cosmétiques ont entretenu un effet psychologique associé à des effets prétenduement quasi-magiques et spectaculaires de cette molécule active très utilisée dans les matériels dits de comblement.
Par l'utilisation de techniques de mésothérapie, l'utilisation d'acide hyaluronique permet d'apporter de l'hydratation de la peau en profondeur à la peau pour lui permettre d'améliorer ses propriétés en termes de ridules et de présence de pores[72]. L'acide hyaluronique agit comme une éponge moléculaire : il est une des biomolécules ayant des propriétés hygroscopiques exceptionnelles (elle est capable de retenir jusqu'à mille fois son poids en eau) qui contribuent à l'hydratation de la peau[73].
Contre-indications aux injections d'acide hyaluronique
Ce sont :
- infection en cours ;
- grossesse ;
- maladie auto-immune[74] / maladies inflammatoire ;
- herpès labial ;
- antécédent d'allergie.
Pratique réglementée
Tout médecin pratiquant les injections d'acide hyaluronique doit être inscrit au tableau du conseil de l'Ordre, être autorisé à pratiquer sur le territoire où il exerce et justifier d'une formation spécifique[75].
La pratique du « Hyaluron Pen » est interdite en France. Ceci est couramment utilisé par les esthéticiens qui pratiquent illégalement la médecine.
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- B.-V. Nusgens, « Acide Hyaluronique et matrice extracellulaire : une molécule primitive ? », Annales de dermatologie, vol. 137, (lire en ligne).
- Tammi R, Ripellino JA, Margolis RU, Tammi M, Localization of epidermal hyaluronic acid using the hyaluronate binding region of cartilage proteoglycan as a specific probe, J Invest Dermatol, 1988;90:412–414
- W. Manuskiatti et H. I. Maibach, « Hyaluronic acid and skin: wound healing and aging », International Journal of Dermatology, vol. 35, no 8, , p. 539–544 (ISSN 0011-9059, PMID 8854147, DOI 10.1111/j.1365-4362.1996.tb03650.x, lire en ligne, consulté le ).
- Slevin M., Krupinski J., Gaffney J. et al., Hyaluronan-mediated angiogenesis in vascular disease: uncovering RHAMM and CD44 receptor signaling pathways, Matrix Biol., 2007, 26:58–68
- Shibnath Ghatak, Edward V. Maytin, Judith A. Mack et Vincent C. Hascall, « Roles of Proteoglycans and Glycosaminoglycans in Wound Healing and Fibrosis », International Journal of Cell Biology, vol. 2015, , p. 834893 (ISSN 1687-8876, PMID 26448760, PMCID PMC4581578, DOI 10.1155/2015/834893, lire en ligne, consulté le ).
- Toole B.P., Hyaluronan: from extracellular glue to pericellular cue, Nat. Rev. Cancer, 2004;4:528–539
- Termeer C., Sleeman J.P. et Simon J.C., Hyaluronan — magic glue for the regulation of the immune response?, Trends Immunol., 2003;24:112–114
- M. Yoneda et M. Yamagata, « Hyaluronic acid modulates proliferation of mouse dermal fibroblasts in culture », sur Journal of Cell Science, (ISSN 0021-9533, PMID 2854541, DOI 10.1242/jcs.90.2.265, consulté le ), p. 265–273.
- R. M. Greco et J. A. Iocono, « Hyaluronic acid stimulates human fibroblast proliferation within a collagen matrix », sur Journal of Cellular Physiology, (ISSN 0021-9541, PMID 9808154, DOI 10.1002/(SICI)1097-4652(199812)177:3<465::AID-JCP9>3.0.CO;2-5, consulté le ), p. 465–473.
- Jiang D., Liang J. et Noble P., Hyaluronan in tissue injury and repair, Annu. Rev. Cell. Dev. Biol., 2007, 23:435–496.
- S. E. Dicker et C. S. Franklin, « The isolation of hyaluronic acid and chondroitin sulphate from kidneys and their reaction with urinary hyaluronidase », The Journal of Physiology, vol. 186, no 1, , p. 110–120 (ISSN 0022-3751, PMID 5914246, PMCID 1395904, DOI 10.1113/jphysiol.1966.sp008023, lire en ligne, consulté le ).
- (en) Karl Meyer, « The biological significance of hyaluronic acid and hyaluronidase », Physiological Reviews, vol. 27, no 3, , p. 335–359 (ISSN 0031-9333, PMID 20262017, DOI 10.1152/physrev.1947.27.3.335)
- T. C. Laurent, « Studies on hyaluronic acid in the vitreous body », The Journal of Biological Chemistry, vol. 216, no 1, , p. 263–271 (ISSN 0021-9258, PMID 13252026, lire en ligne, consulté le ).
- S. Sahu et W. S. Lynn, « Hyaluronic acid in the pulmonary secretions of patients with asthma », The Biochemical Journal, vol. 173, no 2, , p. 565–568 (ISSN 0264-6021, PMID 697736, PMCID 1185810, DOI 10.1042/bj1730565, lire en ligne, consulté le ).
- « Acide hyaluronique, du coq (du moins sa crête) à l’âne (celui qui lui trouve des défauts) ! », Regards sur les cosmétiques, (lire en ligne, consulté le ).
- « Up cycling », sur La Cosmétothèque, (consulté le ).
- AF, « Acide hyaluronique, Novozymes ouvre en Chine », Chimie Pharma Hebdo, , p. 13.
- W. H. Betts et L. G. Cleland, « Effect of metal chelators and antiinflammatory drugs on the degradation of hyaluronic acid », Arthritis and Rheumatism, vol. 25, no 12, , p. 1469–1476 (ISSN 0004-3591, PMID 6816249, lire en ligne, consulté le ).
- (en) Robert A. Greenwald et Wai W. Moy, « Effect of oxygen-derived free radicals on hyaluronic acid », Arthritis & Rheumatism, vol. 23, no 4, , p. 455–463 (ISSN 0004-3591 et 1529-0131, DOI 10.1002/art.1780230408).
- Gabriella Emri, Irén Horkay et Eva Remenyik, « [The role of free radicals in the UV-induced skin damage. Photo-aging] », Orvosi Hetilap, vol. 147, no 16, , p. 731–735 (ISSN 0030-6002, PMID 16711258, lire en ligne, consulté le ).
- (en) Hosami Harada et Masaaki Takahashi, « CD44-dependent Intracellular and Extracellular Catabolism of Hyaluronic Acid by Hyaluronidase-1 and -2 », Journal of Biological Chemistry, vol. 282, no 8, , p. 5597–5607 (ISSN 0021-9258 et 1083-351X, PMID 17170110, DOI 10.1074/jbc.M608358200, lire en ligne, consulté le ).
- « L’injection d’acide hyaluronique : dangers liés », sur antiage-nord.fr, .
- Martyn King, Cormac Convery et Emma Davies, « This month's guideline: The Use of Hyaluronidase in Aesthetic Practice (v2.4) », The Journal of Clinical and Aesthetic Dermatology, vol. 11, no 6, , E61–E68 (ISSN 1941-2789, PMID 29942426, PMCID PMC6011868, lire en ligne, consulté le ).
- Lee Walker et Martyn King, « This month's guideline: Visual Loss Secondary to Cosmetic Filler Injection », The Journal of Clinical and Aesthetic Dermatology, vol. 11, no 5, , E53–E55 (ISSN 1941-2789, PMID 29785240, PMCID PMC5955635, lire en ligne, consulté le ).
- Salmon C. et Loeuille D. (2007), Acide hyaluronique dans la hanche : pour ou contre ?, Arthritis Rheum., 56, 2278-87.
- Maurizio Cavallini, Riccardo Gazzola, Marco Metalla et Luca Vaienti, « The role of hyaluronidase in the treatment of complications from hyaluronic acid dermal fillers », Aesthetic Surgery Journal, vol. 33, no 8, , p. 1167–1174 (ISSN 1527-330X, PMID 24197934, DOI 10.1177/1090820X13511970, lire en ligne, consulté le ).
- Rodrigo Moraes Ferraz, Ulrika Sandkvist et Björn Lundgren, « Degradation of Hylauronic Acid Fillers Using Hyaluronidase in an In Vivo Model », Journal of drugs in dermatology: JDD, vol. 17, no 5, , p. 548–553 (ISSN 1545-9616, PMID 29742187, lire en ligne, consulté le ).
- Gabriela Casabona, Paula Barreto Marchese, José Raúl Montes et Carl S. Hornfeldt, « Durability, Behavior, and Tolerability of 5 Hyaluronidase Products », Dermatologic Surgery: Official Publication for American Society for Dermatologic Surgery [et Al.], (ISSN 1524-4725, PMID 29894436, DOI 10.1097/DSS.0000000000001562, lire en ligne, consulté le ).
- Hunter D.J., Viscosupplementation for osteoarthritis of the knee, N. Engl. J. Med., 2015, 372:1040-1047.
- « Arthrose du genou : éviter l'acide hyaluronique intra-articulaire », sur prescrire.org (consulté le ).
- C. Sifer, P. Mour, S. Tranchant et E. Visentin, « Y a-t-il un intérêt à utiliser un milieu de transfert embryonnaire enrichi en acide hyaluronique lors de tentatives de FIV/ICSI ? », Gynécologie Obstétrique & Fertilité, vol. 37, nos 11-12, , p. 884-889 (DOI 10.1016/j.gyobfe.2009.09.017, lire en ligne, consulté le ).
- Raida S. Yahya, Ashraf A. El-Bindary, Hatem A. El-Mezayen et Hanaa M. Abdelmasseh, « Biochemical evaluation of hyaluronic acid in breast cancer », Clinical Laboratory, vol. 60, no 7, , p. 1115–1121 (ISSN 1433-6510, PMID 25134379, lire en ligne, consulté le ).
- Hatem A. El-Mezayen, El-Shahat A. Toson, Hossam Darwish et Fatheya M. Metwally, « Development of a novel metastatic breast cancer score based on hyaluronic acid metabolism », Medical Oncology (Northwood, London, England), vol. 30, no 1, , p. 404 (ISSN 1559-131X, PMID 23275142, DOI 10.1007/s12032-012-0404-8, lire en ligne, consulté le ).
- « Cancer : le rat taupe nu fait renaître l'espoir » sur pourquoi-docteur.nouvelobs.com
- « L'étonnant rat-taupe nu révèle quelques-uns de ses secrets » sur allodocteurs.fr
- (en) Massimo Di Simone, Fabio Baldi, Valentina Vasina et Maria Laura Bacci, « Barrier effect of Esoxx on esophageal mucosal damage: experimental study on ex-vivo swine model », Clinical and Experimental Gastroenterology, , p. 103 (ISSN 1178-7023, PMID 22767997, PMCID PMC3387832, DOI 10.2147/CEG.S31404, lire en ligne, consulté le ).
- (en) V. Savarino, F. Pace, C. Scarpignato et the Esoxx Study Group, « Randomised clinical trial: mucosal protection combined with acid suppression in the treatment of non-erosive reflux disease - efficacy of Esoxx, a hyaluronic acid-chondroitin sulphate based bioadhesive formulation », Alimentary Pharmacology & Therapeutics, vol. 45, no 5, , p. 631–642 (PMID 28116754, PMCID PMC5347926, DOI 10.1111/apt.13914).
- B. Palmieri, A. Merighi, D. Corbascio et V. Rottigni, « Fixed combination of hyaluronic acid and chondroitin-sulphate oral formulation in a randomized double blind, placebo controlled study for the treatment of symptoms in patients with non-erosive gastroesophageal reflux », European Review for Medical and Pharmacological Sciences, vol. 17, no 24, , p. 3272–3278 (ISSN 1128-3602, PMID 24379055, lire en ligne, consulté le ).
- Eliseo Carrasco Esteban, « How Efficacious is Ziverel for Symptomatic Relief of Acute Radiation-Induced Esophagitis? Retrospective Study of Patients Receiving Oncologic Treatment », Cancer Therapy & Oncology International Journal, vol. 7, no 5, (DOI 10.19080/CTOIJ.2017.07.555724, lire en ligne, consulté le ).
- (en) Patrick du Souich, Antonio G. García, Josep Vergés et Eulàlia Montell, « Immunomodulatory and anti-inflammatory effects of chondroitin sulphate », Journal of Cellular and Molecular Medicine, vol. 13, no 8a, , p. 1451-1463 (PMID 19522843, PMCID PMC3828858, DOI 10.1111/j.1582-4934.2009.00826.x).
- (en) M. Schnabelrauch et D. Scharnweber, « Sulfated Glycosaminoglycans As Promising Artificial Extracellular Matrix Components to Improve the Regeneration of Tissues », sur ingentaconnect.com, (consulté le ).
- (en) Kessiena L. Aya et Robert Stern, « Hyaluronan in wound healing: Rediscovering a major player: Hyaluronan in wound healing », Wound Repair and Regeneration, vol. 22, no 5, , p. 579–593 (DOI 10.1111/wrr.12214).
- Richard G. Glogau, « Fillers: From the Past to the Future », Seminars in Cutaneous Medicine and Surgery, vol. 31, no 2, , p. 78–87 (ISSN 1085-5629, DOI 10.1016/j.sder.2012.03.004).
- Tatjana Pavicic et David Funt, « Dermal fillers in aesthetics: an overview of adverse events and treatment approaches », Clinical, Cosmetic and Investigational Dermatology, , p. 295 (ISSN 1178-7015, DOI 10.2147/ccid.s50546).
- Park N.C., Kim S.W. et Moon D.G. (2016), Penile augmentation, Berlin/Heidelberg, Springer Berlin Heidelberg (ISBN 978-3-662-46752-7), DOI 10.1007/978-3-662-46753-4 (ISBN 978-3-662-46753-4) (eBook) ; Library of Congress Control Number: 2016931276.
- Ora Bitterman-Deutsch, Leonid Kogan et Faris Nasser, « Delayed Immune Mediated Adverse Effects to Hyaluronic Acid Fillers: Report of Five Cases and Review of the Literature », Dermatology Reports, vol. 7, no 1, (ISSN 2036-7392, PMID 25918619, PMCID PMC4387334, DOI 10.4081/dr.2015.5851, lire en ligne, consulté le ).
- (en) Pavicic T, Gauglitz GG, Lersch P, Schwach-Abdellaoui K, Malle B, Korting HC, Farwick M, « Efficacy of cream-based novel formulations of hyaluronic acid of different molecular weights in anti-wrinkle treatment », J Drugs Dermatol, vol. 10, no 9, , p. 990-1000. (PMID 22052267).
- (en) Jegasothy SM, Zabolotniaia V, Bielfeldt S, « Efficacy of a New Topical Nano-hyaluronic Acid in Humans », J Clin Aesthet Dermatol, vol. 7, no 3, , p. 27-9. (PMID 24688623, PMCID PMC3970829).
- « Notre dossier sur l'injection d’acide hyaluronique », sur antiage-nord.fr.
- « Injection acide hyaluronique cernes et visage », sur CSHP Paris (consulté le ).
- CSHP Paris, « Injection acide hyaluronique cernes et visage - CSHP Paris », CSHP Paris, (lire en ligne, consulté le ).
- Du Geon Moon, Tae Il Kwak et Je Jong Kim, « Glans Penis Augmentation Using Hyaluronic Acid Gel as an Injectable Filler », The World Journal of Men's Health, vol. 33, no 2, , p. 50–61 (ISSN 2287-4208, PMID 26331121, PMCID PMC4550597, DOI 10.5534/wjmh.2015.33.2.50, lire en ligne, consulté le ).
- A. Littara, B. Palmieri, V. Rottigni et T. Iannitti, « A clinical study to assess the effectiveness of a hyaluronic acid-based procedure for treatment of premature ejaculation », International Journal of Impotence Research, vol. 25, no 3, , p. 117–120 (ISSN 1476-5489, PMID 23552577, PMCID PMC3655259, DOI 10.1038/ijir.2013.13, lire en ligne, consulté le ).
- Gyung-woo Jung, Penile Girth Enhancement with Allograft, Springer Berlin Heidelberg, , 83–92 p. (ISBN 978-3-662-46752-7, DOI 10.1007/978-3-662-46753-4_11).
- Giuseppe Sito, Sergio Marlino et Adriano Santorelli, « Use of Macrolane VRF 30 in emicircumferential penis enlargement », Aesthetic Surgery Journal, vol. 33, no 2, , p. 258–264 (ISSN 1527-330X, PMID 23388646, DOI 10.1177/1090820X12472337, lire en ligne, consulté le ).
- D.G. Moon, T.I. Kwak, H.Y. Cho et J.H. Bae, « Augmentation of glans penis using injectable hyaluronic acid gel », International Journal of Impotence Research, vol. 15, no 6, , p. 456-460 (ISSN 0955-9930 et 1476-5489, DOI 10.1038/sj.ijir.3901058).
- (en) Tae Il Kwak, MiMi Oh, Je Jong Kim et Du Geon Moon, The Effects of Penile Girth Enhancement using Injectable Hyaluronic Acid Gel, a Filler, vol. 8, (DOI 10.1111/j.1743-6109.2010.01748.x, lire en ligne), p. 3407–3413.
- Tack Lee, Hak Ryong Choi, Young Tae Lee et Yong Hui Lee, « Paraffinoma of the penis », Yonsei Medical Journal, vol. 35, no 3, , p. 344 (ISSN 0513-5796, DOI 10.3349/ymj.1994.35.3.344).
- Emre Akkus, Aydin Iscimen, Levent Tasli et Halim Hattat, « Paraffinoma and Ulcer of the External Genitalia after Self‐Injection of Vaseline », The Journal of Sexual Medicine, vol. 3, no 1, , p. 170–172 (ISSN 1743-6095, DOI 10.1111/j.1743-6109.2005.00096.x).
- (en) Paul E. Chasan, « The History of Injectable Silicone Fluids for Soft-Tissue Augmentation: », Plastic and Reconstructive Surgery, vol. 120, no 7, , p. 2034–2040 (ISSN 0032-1052, DOI 10.1097/01.prs.0000267580.92163.33, lire en ligne, consulté le ).
- Arthaud J.B., Silicone-induced penile sclerosing lipogranuloma, J. Urol., 1973, 110(2):210.
- Lucio Dell'Atti, « Ultrasonographic study of subcutaneous penile granuloma secondary to silicone injection », Archivio Italiano di Urologia e Andrologia, vol. 88, no 3, , p. 241 (ISSN 2282-4197 et 1124-3562, DOI 10.4081/aiua.2016.3.241).
- (en) Grigoriy E. Gurvits, « Silicone Pneumonitis after a Cosmetic Augmentation Procedure », New England Journal of Medicine, vol. 354, no 2, , p. 211–212 (ISSN 0028-4793 et 1533-4406, DOI 10.1056/NEJMc052625, lire en ligne, consulté le ).
- Maria Angeles Rodríguez, Maria del Carmen Martínez, Miguel Lopez-Artíguez et Maria Luisa Soria, « Lung Embolism with Liquid Silicone », Journal of Forensic Sciences, vol. 34, no 2, , p. 12667J (ISSN 0022-1198, DOI 10.1520/jfs12667j).
- (en) Rhoda S. Narins et Kenneth Beer, « Liquid Injectable Silicone: A Review of Its History, Immunology, Technical Considerations, Complications, and Potential: », Plastic and Reconstructive Surgery, vol. 118, no Suppl, , p. 77S–84S (ISSN 0032-1052, DOI 10.1097/01.prs.0000234919.25096.67, lire en ligne, consulté le ).
- (en) Yacov Yacobi, Alexander Tsivian, Roman Grinberg et Oded Kessler, « Short-term results of incremental penile girth enhancement using liquid injectable silicone: words of praise for a change », Asian Journal of Andrology, vol. 9, no 3, , p. 408–413 (ISSN 1008-682X et 1745-7262, DOI 10.1111/j.1745-7262.2007.00262.x).
- Giussy Barbara, Federica Facchin, Laura Buggio et Daniela Alberico, « Vaginal rejuvenation: current perspectives », International Journal of Women's Health, vol. 9, , p. 513–519 (ISSN 1179-1411, PMID 28860864, PMCID PMC5560421, DOI 10.2147/IJWH.S99700, lire en ligne, consulté le ).
- « Traitement d'une ride du lion », sur antiage-nord.fr, .
- Syed Nasir Abbas Bukhari, Nur Liyana Roswandi, Muhammad Waqas et Haroon Habib, « Hyaluronic acid, a promising skin rejuvenating biomedicine: A review of recent updates and pre-clinical and clinical investigations on cosmetic and nutricosmetic effects », International Journal of Biological Macromolecules, vol. 120, no Pt B, , p. 1682–1695 (ISSN 1879-0003, PMID 30287361, DOI 10.1016/j.ijbiomac.2018.09.188, lire en ligne, consulté le ).
- Massimo Milani et Adele Sparavigna, « The 24-hour skin hydration and barrier function effects of a hyaluronic 1%, glycerin 5%, and Centella asiatica stem cells extract moisturizing fluid: an intra-subject, randomized, assessor-blinded study », Clinical, Cosmetic and Investigational Dermatology, vol. 10, , p. 311–315 (ISSN 1178-7015, PMID 28860834, PMCID 5560567, DOI 10.2147/CCID.S144180, lire en ligne, consulté le ).
- « Soins de mésothérapie », sur antiage-nord.fr.
- (en) Marek J. Los, Andrzej Hudecki et Emilia Wiechec, Stem cells and biomaterials for regenerative medicine, Academic Press, , p. 180.
- N. Ghariani Fetoui, L. Boussofara, D. Ammar et W. Saidi, « Des nodules inflammatoires compliquant les injections d’acide hyaluronique sur un terrain auto-immun : à propos de 2 observations », La Revue de Médecine Interne, 78e congrès français de médecine interne, Grenoble, du 12 au 14 décembre 2018, vol. 39, , A200 (ISSN 0248-8663, DOI 10.1016/j.revmed.2018.10.188, lire en ligne, consulté le ).
- Skin Marceau, « Poursuite de la promotion des injections illégales » (consulté le )
Voir aussi
Articles connexes
- Hyaluronate de sodium
- Glycosaminoglycane (GAG)
- Protéoglycane
- Aggrécane, un protéoglycane qui se lie avec l'acide hyaluronique dans le cartilage.
- Produit d'augmentation mammaire
- Dermatologie