Cellule mésenchymateuse
Les cellules mésenchymateuses sont des cellules souches, stromales et multipotentes.
Elles sont présentes dans le mésenchyme de l'embryon, dans le sang de cordon ombilical et plus encore dans la gelée de Wharton (qui entoure le cordon). Elles sont aussi présentes chez l'adulte, mais en très faibles quantités.
Depuis la fin des années 1990, la démonstration de la capacité unique des cellules souches (SC) à s'auto-renouveler a suscité d'importants espoirs d'usages thérapeutiques nouveaux.
Il y a un consensus sur leur potentiel de traitement futur de diverses maladies auparavant incurables[1] - [2] - [3], encore à pondérer par le fait que la recherche médicale est confrontée au fait que ces cellules très particulières obéissent à des règles et déterminants hautement complexes et encore très mal compris[4]. Des scientifiques et régulateurs du secteur de la santé ont récemment (2018) alerté sur le nombre croissant de cliniques privées qui depuis le début des années 2000 promeuvent et vendent des interventions basées sur les cellules souches (SC) en promettant de traiter des problèmes cosmétiques et médicaux, voire de guérir certaines maladies (HIV/SIDA notamment), selon des méthodes qui en réalité sont non-éprouvées, se basent sur des allégations douteuses et n'ont pas fait la preuve scientifique ni de leur efficacité ni de leur innocuité, avec un « risque grave pour les patients vulnérables » et des méthodes qui risquent indirectement de ternir les valeurs éthiques[5] et légitimes des projets de thérapies en cours de tests précliniques et cliniques rigoureux[6] - [7] - [8] - [9] - [10] - [11] - [12] - [13] - [14] - [15] - [4].
Histoire
En 1924, le morphologiste d'origine russe Alexander A. Maximov (russe: Александр Александрович Максимов), à partir d'observations histologiques approfondies, identifie dans le mésenchyme un type singulier de cellule précurseur, qui se développe en différents types de cellules sanguines[16].
Dans les années 1960, les scientifiques Ernest A. McCulloch et James E. Till révèlent pour la première fois la nature clonale des cellules médullaires[17] - [18].
Dans les années 1970, un essai ex vivo porte sur le potentiel clonogénique des cellules multipotentes de la moelle, rapporté par Friedenstein et ses collègues[19] - [20]. Dans leur système d'observation, ces cellules stromales étaient appelées fibroblastes unitaires formant des colonies (CFU-f pour Colony-forming unit-fibroblasts).
Le terme de cellules souches mésenchymateuses (CSM) a été formulé par Arnold Caplan en 1991.
Les premiers essais cliniques des CSM ont été achevés en 1995 après que 15 patients aient reçu une injection de CSM (issues de culture) pour tester l'innocuité du traitement.
En 2012, plus de 200 essais cliniques avaient déjà été lancés mais la plupart étaient encore au stade de la sécurité des tests[21].
Une expérimentation ultérieure a révélé la plasticité des cellules de la moelle osseuse et comment leur sort est déterminé par des signaux « environnementaux ». La culture de cellules stromales médullaires en présence de stimuli ostéogéniques tels que l'acide ascorbique, le phosphate inorganique ou la dexaméthasone peut par exemple favoriser leur différenciation en ostéoblastes. En revanche, l'ajout de facteur de croissance transformant bêta (TGF-b) pourrait induire des marqueurs chondrogéniques.
Au début des années 2010, malgré de nombreuses expérimentations, on ne dispose toujours pas de preuves robustes de bénéfices thérapeutiques[2].
En 2020, la recherche d'usages thérapeutiques est porteuse de grands espoirs pour de nombreux soignants, patients et leur entourage, mais avec des attentes encore souvent exagérées en ce qui concerne les maladies actuellement répertoriées dans les « besoins médicaux non satisfaits »[22] - [23]. La recherche médicale ne peut en effet qu'avancer avec précaution sur ces sujets car les cellules souches obéissent à des règles et déterminants très complexes et encore mal compris ; et leur délivrance sans précaution peut avoir des effets adverses inattendus et indésirables voire contreproductifs[4]. Certains espèrent pouvoir restaurer les fonctions de tissus complexes voire d'organes entiers mais des limites biologiques persistent encore dans cette voie et les thérapies innovantes doivent faire leurs preuves lors d'essais cliniques contrôlés avant autorisation de mise sur le marché ou de mise en pratique[4]. Certains patients font donc appel dans certains pays à des interventions médicales très coûteuses, illégales, non-validées et non-éprouvées et généralement sans guérison fiable à partir de cellules souches (SCI) ; une étude récente (2018) a porté sur l'essor récent et mondial d'un « tourisme des cellules souches ». La même étude fait un bilan des cas signalés par la littérature médicale d'échecs ou d'incidents de sécurité associés à une LME non prouvée[4]. Une étude précédente avait métaphoriquement comparé l'utilisation de thérapies à base de cellules souches proposées sur Internet à un espoir de guérison situé entre la croyance au miracle et la pratique de la roulette russe[24]. Entre 2000 et 2015, les cliniques proposant ces interventions, via internet notamment, ont « des buts lucratifs à peine déguisés et continuent d'exploiter une large base de patients vulnérables, en utilisant des allégations thérapeutiques non prouvées, en suscitant de faux espoirs de fournir de nouveaux traitements efficaces. Comme les interventions à base de cellules souches non-éprouvées ne bénéficient pas de remboursement par une sécurité sociale ou mutuelle, les patients sont aussi exploités financièrement en étant facturés des milliers de dollars pour recevoir ces interventions non-éprouvées »[4].
Face à ces dérives éthiques et commerciales (qui se sont épanouies y compris aux États-Unis)[25], des lignes directrices et recommandations ont été proposées[23] - [26] - [27] - [28] - [29] - [30] - [31] - [32], et des groupes de défense de patients se sont constitués, de concert avec des sociétés médicales, des agences et organismes de contrôle et de réglementation, pour notamment sensibiliser et éduquer les médecins et les patients à différencier les thérapies à base de cellules souches correctement testées de celles qui n'ont pas été éprouvées[33] - [34]. Malgré ceci, profitant de vides réglementaires et juridiques, le phénomène du « tourisme des cellules souches » a encore progressé dans les années 2000 à 2015[4].
Éléments de définition
Les expressions « cellule souche mésenchymateuse » (CSM) et « cellule stromale médullaire » (qui signifie « cellule du tissu conjonctif de la moelle ») sont considérées comme synonymes depuis de nombreuses années, mais aucune n'est totalement descriptive de ce qu'elles recouvrent :
- Le mésenchyme est un tissu conjonctif embryonnaire dérivé du mésoderme, qui se différencie en tissu hématopoïétique (les cellules qui fabriquent et renouvellent en permanence le sang) et conjonctif, alors que les CSM ne se différencient pas en cellules hématopoïétiques[35].
- Les cellules stromales sont aussi des cellules du tissu conjonctif, qui forment la structure de soutien dans laquelle résident les cellules fonctionnelles du tissu.
- L’expression ne transmet qu'une des fonctions des CSM et non tous les rôles qu'on leur a découvert depuis quelques décennies dans la réparation des tissus[36].
L’expression englobe les cellules multipotentes dérivées d'autres tissus non médullaires, tels que le placenta[36] le sang du cordon ombilical, le tissu adipeux, le muscle adulte, le stroma cornéen de l'oeil[37] ou la pulpe dentaire des dents de lait.
Ces cellules n'ont pas la capacité de reconstituer un organe entier.
Spécificités
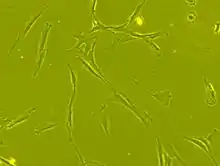
Ce sont des cellules souches d'origine mésodermique présentes dans divers tissus de l'organisme adulte tels que la moelle osseuse ou le tissu adipeux, généralement le long des vaisseaux sanguins ou dans le sang de cordon.
Elles peuvent se différencier en de nombreux types cellulaires : dont les ostéoblastes (cellules osseuses), les chondrocytes (cellules du cartilage), les myocytes (cellules musculaires) et les adipocytes (cellules adipeuses qui donnent naissance au tissu adipeux de la moelle)[38].
Morphologie
Les CSM ont un corps cellulaire petit, avec quelques éléments cellulaires longs et minces.
Ce corps cellulaire contient un gros noyau rond avec un nucléole proéminent, entouré de fines particules de chromatine dispersées, donnant au noyau une apparence claire.
Le reste du corps cellulaire contient une petite quantité d'appareils de Golgi, un réticulum endoplasmique rugueux, des mitochondries et des polyribosomes.
Ces cellules, longues et minces, sont largement dispersées, et la matrice extracellulaire adjacente est peuplée de quelques fibrilles réticulaires mais dépourvue d’autre types de fibrilles de collagène[39] - [36].
Emplacement
Moelle osseuse
La moelle osseuse était la première source de CSM et est toujours la plus utilisée. Ces cellules souches de la moelle osseuse ne contribuent pas à la formation des cellules sanguines et n'expriment donc pas le marqueur des cellules souches hématopoïétiques CD34.
Elles sont parfois dites « cellules souches stromales de la moelle osseuse »[40].
Cellules du cordon et de la gelée de Wharton
Le cordon ombilical est disponible après la naissance et ne présente pas a priori de risques particuliers de collecte. Les CSM les plus jeunes et les plus primitives peuvent en être extraites ; à partir de la gelée de Wharton (qui en est la source la plus riche)[41] ou du sang du cordon ombilical. Les CSM sont cependant bien plus concentrées dans la gelée de Wharton que dans le sang de cordon, qui lui est une riche source de cellules souches hématopoïétiques (CSH, infime fraction du tissu hématopoïétique, mais à l'origine de toutes les lignées de cellules sanguines du corps).
Ces MSC sont une source utile de MSC pour certaines applications cliniques en raison de leurs propriétés primitives (il a par exemple en mars 2020 été proposé de tester leur utilisation pour soigner les malades de la COVID-19)[42].
Tissu adipeux
Le tissu adipeux est également une riche source de MSC (ou « cellules souches mésenchymateuses dérivées de l’adipose », AdMSC)[36].
Cellules de molaire
Le bourgeon dentaire en développement de la troisième molaire mandibulaire est une riche source de CSM.
Bien qu'elles soient décrites comme « multipotentes », il est possible qu'elles soient en réalité « pluripotentes ». Elles contribuent à la formation de l'émail, de la dentine, des vaisseaux sanguins, de la pulpe dentaire et des tissus nerveux.
Ces cellules souches se sont montrées capables de produire des hépatocytes.
Liquide amniotique
Des cellules souches sont aussi trouvées dans le liquide amniotique (Jusqu'à 1 cellule sur 100 collectées pendant l’amniocentèse est une cellule souche mésenchymateuse pluripotente)[43]
Fonction
Capacité de différenciation
Les MSC ont une grande capacité d'auto-renouvellement tout en conservant leur multipotence.
Des travaux récents suggèrent que la β-caténine, via la régulation de l'EZH2 (en), est une molécule centrale dans le maintien de la "tige" des MSC[36].
Le test standard pour confirmer la multipotence est la différenciation des cellules en ostéoblastes, adipocytes et chondrocytes ainsi qu'en myocytes.
Les MSC se différencient même en cellules de type neuronal[44] mais on n'est pas certain que les neurones ainsi dérivés soient bien fonctionnels[45]. Le degré de différenciation de la culture varie selon les individus et la façon dont la différenciation est induite, par exemple chimique par rapport à la mécanique[46], et il n'est pas clair si cette variation est due à une quantité différente de «vraies» cellules progénitrices dans la culture ou à ou des capacités de différenciation variables des progéniteurs individuels.
La capacité des cellules à proliférer et à se différencier diminue avec l'âge du donneur, et avec le temps de culture. On ignore si cela est dû à une diminution du nombre de MSC ou à une modification des MSC existants.
Effets immunomodulateurs
Tout en ayant des effets antibiotiques, es CSM ont paradoxalement un effet de régulation voire de déplétion sur les cellules immunitaires innées et spécifiques ; elles produisent de nombreuses molécules ayant des effets imunosupresseur[47] ou immunomodulateurs. Il s'agit notamment de la prostaglandine E2 (PGE2)[48], de l'oxyde nitrique[49], de l'Indoleamine 2,3-dioxygénase (IDO), de l'IL-6 et d'autres marqueurs de surface - FasL[50], PD-L1/2.
Les CSM ont un effet sur les macrophages, les neutrophiles, les cellules NK, les mastocytes et les cellules dendritiques dans l'immunité innée.
Les MSC sont capables de migrer vers les plaies, où elles se polarisent à travers les macrophages PGE2 dans le phénotype M2 qui se caractérise par un effet anti-inflammatoire[51].
De plus, la PGE2 inhibe la capacité des mastocytes à se dégranuler et à produire du TNF-α[52] - [53]. La prolifération et l’activité cytotoxique des cellules NK sont inhibées par PGE2 et IDO. Les MSC réduisent également l'expression des récepteurs des cellules NK - NKG2D, NKp44 et NKp30[54]. Les CSM inhibent les poussées respiratoires et l'apoptose des neutrophiles par la production de cytokines IL-6 et IL-8[55]. La différenciation et l'expression des marqueurs de surface des cellules dendritiques sont inhibées par l'IL-6 et la PGE2 des MSC[56].
Les effets immunosuppresseurs du MSC sont encore mal compris, ils dépendent au moins de l'IL-10, mais il n'est pas certain que l'IL-10 le produise seul ; peut-être stimulent-ils uniquement d'autres cellules pour le produire[57].
La MSC exprime les molécules d'adhésion VCAM-1 et ICAM-1, qui permettent aux lymphocytes T d'adhérer à leur surface. Ensuite, le MSC peut les affecter par des molécules qui ont une courte demi-vie avec un effet limité au voisinage immédiat de la cellule[49]. Ceux-ci incluent l'oxyde nitrique[58], PGE2, HGF[59], et l'activation du récepteur PD-1[60]. Les MSC réduisent la prolifération des cellules T entre les phases du cycle cellulaire G0 et G1[61] et diminuent l'expression de l'IFNγ des cellules Th1 tout en augmentant l'expression de l'IL-4 des cellules Th2[62].
Les CSM inhibent également la prolifération des lymphocytes B entre les phases du cycle cellulaire G0 et G1[63].
Propriétés antimicrobiennes
Les CSM peuvent aussi produire des peptides antimicrobiens (AMP).
Il s'agit notamment de la cathélicidine humaine LL-37[64], de β-défensine humaine[65], de la lipocaline 2[66] et d'hepcidine[67].
Les CSM diminuent efficacement le nombre de colonies de bactéries à Gram négatif et à Gram positif en produisant ces AMP.
De plus, un même effet antimicrobien de l'enzyme IDO produite par les CSM a aussi été constaté[68].
Signification clinique

Les cellules souches mésenchymateuses du corps humain peuvent être activées et mobilisées si nécessaire, mais à ce jour avec une faible efficacité (ainsi les dommages aux muscles guérissent très lentement). Une étude meilleure compréhension des mécanismes d'action du MSC pourrait fournir des moyens d'augmenter leur capacité de réparation tissulaire[69] - [70].
Maladie auto-immune
Des études cliniques sur l'efficacité des cellules souches mésenchymateuses dans le traitement de maladies auto-immunes sont en cours de développement, en particulier pour les comprendre (ex : maladie du greffon contre l'hôte, maladie de Crohn, sclérose en plaques, lupus érythémateux disséminé et sclérodermie systémique[71] - [72].
Depuis 2014, aucune recherche clinique de haute qualité n'a prouvé son efficacité, et de nombreuses incohérences et problèmes existent dans les méthodes de recherche[72].
Autres maladies
Beaucoup des premiers succès cliniques de la transplantation intraveineuse ont concerné des maladies systémiques telles que la maladie du greffon contre l'hôte et la septicémie.
L'injection directe ou le placement de cellules dans un site nécessitant d'être réparé peut être préféré, car la délivrance par la voie vasculaire souffre d'un inconvénient dit "effet de premier passage pulmonaire" où les cellules injectées par voie intraveineuse sont séquestrées dans les poumons[73].
Détection
La Société internationale de thérapie cellulaire (ISCT) a proposé des critères de définition les CSM = une cellule peut être classée MSC si elle présente des propriétés d'adhérence plastique dans des conditions de culture normales et si elle a une morphologie de type fibroblaste.
En fait, certains soutiennent que les CSM et les fibroblastes sont fonctionnellement identiques[74].
De plus, les CSM peuvent subir une différenciation ostéogénique (produisant des cellules osseuses), adipogène (produisant des cellules graisseuses) et chondrogène (produisant du cartilage) ex vivo.
Biomoléculairement parlant, les MSC en culture expriment également sur leur surface les marqueurs de surface CD73, CD90 et CD105, tout en manquant de l'expression des marqueurs de surface CD11b, CD14, CD19, CD34, CD45, CD79a et HLA-DR[75].
Techniques de culture de cellules mésenchymateuses
Elles adoptent presque toutes aujourd'hui une approche passant par des cultures de fibroblastes formant des colonies (CFU-F), où de la moelle osseuse brute non purifiée ou de la moelle osseuse purifiée au ficoll sont directement plaquées (sur des plaques ou dans des flacons de culture cellulaire). Les cellules souches mésenchymateuses, mais pas les globules rouges ni les progéniteurs hématopoïétiques, adhèrent au plastique des cultures tissulaire dans les 24 à 48 heures.
Cependant, au moins une publication a identifié une population de CSM non adhérents non obtenus par la technique de placage direct[76].
D'autres méthodes basées sur la cytométrie en flux permettent le tri des cellules de moelle osseuse pour des marqueurs de surface spécifiques, tels que STRO-1[77] (Nota : STRO fait référence à Stroma qui désigne le réseau conjonctif, dit mésenchyme, soutenant les cellules ; Et STRO-1+ est le nom donné au premier anticorps monoclonal isolé à partir de cellules souches mésenchymateuses. Le terme "STRO-1" a ensuite été appliqué à l'antigène de cet anticorps. Dans le corps humain STRO-1 est retrouvé dans de nombreux organes dont le poumon et le foie[78] - [79]. Les cellules STRO-1 sont généralement plus homogènes et ont des taux d'adhésion et des taux de prolifération plus élevés, mais les différences exactes entre les cellules STRO-1+ et les CSM ne sont pas encore claires.
La supplémentation des milieux basaux avec du sérum de fœtus de bovin ou du lysat de plaquettes humaines est courante dans les cultures MSC.
Avant l'utilisation de lysats plaquettaires pour la culture MSC, un processus d'inactivation des agents pathogènes est recommandé pour empêcher la transmission d'agents pathogènes[80].
Recherche
Les cellules souches sont progressivement mieux comprises, mais comme pour la thérapie génique, le passage des connaissances de laboratoire à un usage thérapeutique sûr en application clinique est encore difficile. Les risques et les avantages de ces thérapies doivent être évalués et compris, le cadre réglementaire pourrait devoir être adapté[4].
- Des méthodes d'immunodéplétion utilisant des techniques telles que le tri cellulaire magnétique ont été utilisées dans la sélection négative des CSM[81] ;
- On sait maintenant que le vieillissement induit des changements fonctionnels et phénotypiques des sous-populations de CMS (cardiaques par exemple) expliquant une partie des dysfonctions de certains organes associées à l'âge[82]
- les liens entre arthroses et cellules souches mésenchymateuses sont en passe d'être mieux compris[83]
Une nouvelle recherche intitulée Transplantation de cellules souches mésenchymateuses dérivées de l'ESC humaine améliore l'arthrose spontanée chez les macaques rhésus[84] ; - Les cellules stromales mésenchymateuses ou CSM (pourrait favoriser la résistance (les rechutes) de certains cancers aux chimiothérapies (ex : Myélome Multiple, qui est une hémopathie à cellules B, caractérisée par une pullulation de plasmocytes malins dans la moelle osseuse) à cause de clones résiduels chimio-résistants, et en sécrétant des facteurs de croissance et cytokiniques[85]. On a comparé les transcriptomes de cellules stromales mésenchymateuses provenant de moelle de donneurs sains à ceux de patients à différents stades de ce cancer (stades du diagnostic, de la rechute et de rémission sur 2 ans). Des différences d’expression génique existent, mais avec - curieusement - un profil transcriptomique des cellules stromales mésenchymateuses très proche aux différents stades du myélome et plus particulièrement après le traitement (rechute et rémission), suggérant que l’altération d’expression génique des MSC, tout au long du développement du cancer, peut persister même en l’absence de signe clinique[85]. Le contact des plasmocytes cancéreux avec les MSC pourrait conduire à une modification pérenne du transcriptome des MSC. La valeur pronostique de cette variation d’expression génique des MSC lors du développement de ce cancer est encore à préciser[85] ;
- des cellules stromales mésenchymateuses (CSM), combinées à d'autres traitements, pourraient diminuer les séquelles de l'accident vasculaire cérébral (AVC) ischémique (non-hémorragique)[86].
- Enfin, les cellules souches mésenchymateuses extraites du cordon ombilical et de la gelée de Wharton (qui en contient encore plus)[41] ; cellules aussi dites UC-MSC (pour Umbilical Cord Tissue Mesenchymal Stem Cells) pourraient aider à combattre la COVID-19 grâce à leurs propriétés immunosuppressives[47] ou immunomodulatrices[47].
Des projets de biomédicaments sont à l'étude, visant à empêcher le système immunitaire du patient d'évoluer vers le choc cytokinique (tempête de cytokines, laquelle peut rapidement le tuer via des dommages irréversibles aux organes, un œdème, un dysfonctionnement des échanges d'air aboutissant à un syndrome de détresse respiratoire aiguë (SDRA), des lésions cardiaques aiguës... facilitant - si le patient a survécu jusque là - une infection secondaire, éventuellement nosocomiale.
En Chine, au moment où l'épidémie de COVID-19 se développait ; faute de médicaments efficaces disponibles, plusieurs patients ont été traités avec des UC-MSC.
Le Collège italien d'anesthésie, d'analgésie, de réanimation et de soins intensifs a ensuite publié des lignes directrices pour traiter les patients atteints de coronavirus avec des cellules souches dans l'espoir de réduire la surcharge des unités de soins intensifs.
Selon une étude américaine récente, des preuves limitées mais émergentes concernant l'UC MSC dans la gestion de COVID-19 suggèrent qu'il pourrait être envisagé, au moins pour une utilisation compassionnelle chez les patients gravement malades pour réduire la morbidité et la mortalité aux États-Unis.
Voir aussi
Articles connexes
Bibliographie
- Nagamura-Inoue T, He H. Umbilical cord-derived mesenchymal stem cells: Their advantages and potential clinical utility. World J Stem Cells; 6:195- 202.
- Neybecker P (2019) Caractérisation et étude des potentialités chondrogéniques des cellules souches mésenchymateuses d’origine synoviale pour le traitement des lésions focales et diffuses du cartilage (Doctoral dissertation, Université de Lorraine) (résumé).
- Villard O (2019) Effets des cellules stromales pancréatiques immortalisées humaines sur les cellules bêta humaines (Doctoral dissertation, Montpellier) (résumé)
- Weiss ML, Trover DL (2014) Stem cells in the umbilical cord. Stem Cell Rev 2006; 2:155.162.
Notes et références
- Fiona M. Watt et Ryan R. Driskell, « The therapeutic potential of stem cells », Philosophical Transactions of the Royal Society B: Biological Sciences, vol. 365, no 1537, , p. 155–163 (PMID 20008393, PMCID PMC2842697, DOI 10.1098/rstb.2009.0149, lire en ligne, consulté le )
- (en) George Q. Daley, « The Promise and Perils of Stem Cell Therapeutics », Cell Stem Cell, vol. 10, no 6, , p. 740–749 (PMID 22704514, PMCID PMC3629702, DOI 10.1016/j.stem.2012.05.010, lire en ligne, consulté le )
- (en) Mohamed Abou-El-Enein, Gerhard Bauer, Petra Reinke et Matthias Renner, « A roadmap toward clinical translation of genetically-modified stem cells for treatment of HIV », Trends in Molecular Medicine, vol. 20, no 11, , p. 632–642 (DOI 10.1016/j.molmed.2014.08.004, lire en ligne, consulté le )
- (en) Gerhard Bauer, Magdi Elsallab et Mohamed Abou‐El‐Enein, « Concise Review: A Comprehensive Analysis of Reported Adverse Events in Patients Receiving Unproven Stem Cell-Based Interventions », STEM CELLS Translational Medicine, vol. 7, no 9, , p. 676–685 (ISSN 2157-6580, PMID 30063299, PMCID PMC6127222, DOI 10.1002/sctm.17-0282, lire en ligne, consulté le )
- Arthur Caplan et Bruce Levine, « Hope, Hype and Help: Ethically Assessing the Growing Market in Stem Cell Therapies », The American Journal of Bioethics, vol. 10, no 5, , p. 24–25 (ISSN 1526-5161, PMID 20461638, DOI 10.1080/15265161.2010.481980, lire en ligne, consulté le )
- (en) Dominique S. McMahon, « The global industry for unproven stem cell interventions and stem cell tourism », Tissue Engineering and Regenerative Medicine, vol. 11, no 1, , p. 1–9 (ISSN 1738-2696 et 2212-5469, DOI 10.1007/s13770-013-1116-7, lire en ligne, consulté le )
- (en) Leigh Turner et Paul Knoepfler, « Selling Stem Cells in the USA: Assessing the Direct-to-Consumer Industry », Cell Stem Cell, vol. 19, no 2, , p. 154–157 (DOI 10.1016/j.stem.2016.06.007, lire en ligne, consulté le )
- (en) Israel Berger, Amina Ahmad, Akhil Bansal et Tanvir Kapoor, « Global Distribution of Businesses Marketing Stem Cell-Based Interventions », Cell Stem Cell, vol. 19, no 2, , p. 158–162 (DOI 10.1016/j.stem.2016.07.015, lire en ligne, consulté le )
- (en) Hermes Taylor-Weiner et Joshua Graff Zivin, « Medicine's Wild West — Unlicensed Stem-Cell Clinics in the United States », New England Journal of Medicine, vol. 373, no 11, , p. 985–987 (ISSN 0028-4793 et 1533-4406, DOI 10.1056/NEJMp1504560, lire en ligne, consulté le )
- (en) Moses Fung, Yan Yuan, Harold Atkins et Qian Shi, « Responsible Translation of Stem Cell Research: An Assessment of Clinical Trial Registration and Publications », Stem Cell Reports, vol. 8, no 5, , p. 1190–1201 (PMID 28416287, PMCID PMC5425617, DOI 10.1016/j.stemcr.2017.03.013, lire en ligne, consulté le )
- Ubaka Ogbogu, Christen Rachul et Timothy Caulfield, « Reassessing direct-to-consumer portrayals of unproven stem cell therapies: is it getting better? », Regenerative Medicine, vol. 8, no 3, , p. 361–369 (ISSN 1746-0751, DOI 10.2217/rme.13.15, lire en ligne, consulté le )
- (en) B. A. Liang et T. K. Mackey, « Stem Cells, Dot-Com », Science Translational Medicine, vol. 4, no 151, , p. 151cm9–151cm9 (ISSN 1946-6234 et 1946-6242, DOI 10.1126/scitranslmed.3004030, lire en ligne, consulté le )
- Kirsten A Ryan, Amanda N Sanders, Dong D Wang et Aaron D Levine, « Tracking the rise of stem cell tourism », Regenerative Medicine, vol. 5, no 1, , p. 27–33 (ISSN 1746-0751, DOI 10.2217/rme.09.70, lire en ligne, consulté le )
- Alison K. McLean, Cameron Stewart et Ian Kerridge, « Untested, unproven, and unethical: the promotion and provision of autologous stem cell therapies in Australia », Stem Cell Research & Therapy, vol. 6, no 1, , p. 33 (ISSN 1757-6512, PMID 25689404, PMCID PMC4364356, DOI 10.1186/s13287-015-0047-8, lire en ligne, consulté le )
- (en) Alan C. Regenberg, Lauren A. Hutchinson, Benjamin Schanker et Debra J. H. Mathews, « Medicine on the Fringe: Stem Cell-Based Interventions in Advance of Evidence », Stem Cells, vol. 27, no 9, , p. 2312–2319 (DOI 10.1002/stem.132, lire en ligne, consulté le )
- (en) Stewart Sell, Stem cells handbook, New York, Humana Press, (ISBN 978-1-4614-7696-2, lire en ligne)
- A. J. Becker, E. A. McCULLOCH et J. E. Till, « Cytological demonstration of the clonal nature of spleen colonies derived from transplanted mouse marrow cells », Nature, vol. 197, , p. 452–454 (ISSN 0028-0836, PMID 13970094, DOI 10.1038/197452a0, lire en ligne, consulté le )
- (en) L. Siminovitch, E. A. McCulloch et J. E. Till, « The distribution of colony-forming cells among spleen colonies », Journal of Cellular and Comparative Physiology, vol. 62, no 3, , p. 327–336 (ISSN 0095-9898 et 1553-0809, DOI 10.1002/jcp.1030620313, lire en ligne, consulté le )
- A. J. Friedenstein, U. F. Deriglasova, N. N. Kulagina et A. F. Panasuk, « Precursors for fibroblasts in different populations of hematopoietic cells as detected by the in vitro colony assay method », Experimental Hematology, vol. 2, no 2, , p. 83–92 (ISSN 0301-472X, PMID 4455512, lire en ligne, consulté le )
- A. J. Friedenstein, J. F. Gorskaja et N. N. Kulagina, « Fibroblast precursors in normal and irradiated mouse hematopoietic organs », Experimental Hematology, vol. 4, no 5, , p. 267–274 (ISSN 0301-472X, PMID 976387, lire en ligne, consulté le )
- Shihua Wang, Xuebin Qu et Robert Chunhua Zhao, « Clinical applications of mesenchymal stem cells », Journal of Hematology & Oncology, vol. 5, , p. 19 (ISSN 1756-8722, PMID 22546280, PMCID 3416655, DOI 10.1186/1756-8722-5-19, lire en ligne, consulté le )
- (en) Charles E. Murdoch et Christopher Thomas Scott, « Stem Cell Tourism and the Power of Hope », The American Journal of Bioethics, vol. 10, no 5, , p. 16–23 (ISSN 1526-5161 et 1536-0075, DOI 10.1080/15265161003728860, lire en ligne, consulté le )
- (en) T. Caulfield, D. Sipp, C. E. Murry et G. Q. Daley, « Confronting stem cell hype », Science, vol. 352, no 6287, , p. 776–777 (ISSN 0036-8075 et 1095-9203, DOI 10.1126/science.aaf4620, lire en ligne, consulté le )
- (en) Alan Petersen, Casimir MacGregor et Megan Munsie, « Stem cell miracles or Russian roulette?: patients’ use of digital media to campaign for access to clinically unproven treatments », Health, Risk & Society, vol. 17, nos 7-8, , p. 592–604 (ISSN 1369-8575 et 1469-8331, DOI 10.1080/13698575.2015.1118020, lire en ligne, consulté le )
- (en) Douglas Sipp, « Direct-to-Consumer Stem Cell Marketing and Regulatory Responses », STEM CELLS Translational Medicine, vol. 2, no 9, , p. 638–640 (PMID 23934911, PMCID PMC3754464, DOI 10.5966/sctm.2013-0040, lire en ligne, consulté le )
- (en) Douglas Sipp, Timothy Caulfield, Jane Kaye et Jan Barfoot, « Marketing of unproven stem cell–based interventions: A call to action », Science Translational Medicine, vol. 9, no 397, , eaag0426 (ISSN 1946-6234 et 1946-6242, DOI 10.1126/scitranslmed.aag0426, lire en ligne, consulté le )
- (en) Zubin Master et David B Resnik, « Stem‐cell tourism and scientific responsibility: Stem‐cell researchers are in a unique position to curb the problem of stem‐cell tourism », EMBO reports, vol. 12, no 10, , p. 992–995 (ISSN 1469-221X et 1469-3178, PMID 21799519, PMCID PMC3185342, DOI 10.1038/embor.2011.156, lire en ligne, consulté le )
- (en) Amy Zarzeczny, Timothy Caulfield, Ubaka Ogbogu et Peter Bell, « Professional Regulation: A Potentially Valuable Tool in Responding to “Stem Cell Tourism” », Stem Cell Reports, vol. 3, no 3, , p. 379–384 (DOI 10.1016/j.stemcr.2014.06.016, lire en ligne, consulté le )
- Laertis Ikonomou, Robert J. Freishtat, Darcy E. Wagner et Angela Panoskaltsis-Mortari, « The Global Emergence of Unregulated Stem Cell Treatments for Respiratory Diseases. Professional Societies Need to Act », Annals of the American Thoracic Society, vol. 13, no 8, , p. 1205–1207 (ISSN 2329-6933, DOI 10.1513/AnnalsATS.201604-277ED, lire en ligne, consulté le )
- (en) Kurt C. Gunter, Arthur L. Caplan, Chris Mason et Rachel Salzman, « Cell therapy medical tourism: Time for action », Cytotherapy, vol. 12, no 8, , p. 965–968 (DOI 10.3109/14653249.2010.532663, lire en ligne, consulté le )
- (en) Aaron D. Levine et Leslie E. Wolf, « The Roles and Responsibilities of Physicians in Patients' Decisions about Unproven Stem Cell Therapies », The Journal of Law, Medicine & Ethics, vol. 40, no 1, , p. 122–134 (ISSN 1073-1105 et 1748-720X, DOI 10.1111/j.1748-720X.2012.00650.x, lire en ligne, consulté le )
- Paul S Knoepfler et Leigh G Turner, « The FDA and the US direct-to-consumer marketplace for stem cell interventions: a temporal analysis », Regenerative Medicine, vol. 13, no 1, , p. 19–27 (ISSN 1746-0751, DOI 10.2217/rme-2017-0115, lire en ligne, consulté le )
- (en) Gerhard Bauer, Mohamed Abou-El-Enein, Alastair Kent et Brian Poole, « The path to successful commercialization of cell and gene therapies: empowering patient advocates », Cytotherapy, vol. 19, no 2, , p. 293–298 (DOI 10.1016/j.jcyt.2016.10.017, lire en ligne, consulté le )
- (en) Daniel J. Weiss, Leigh Turner, Aaron D. Levine et Laertis Ikonomou, « Medical societies, patient education initiatives, public debate and marketing of unproven stem cell interventions », Cytotherapy, vol. 20, no 2, , p. 165–168 (DOI 10.1016/j.jcyt.2017.10.002, lire en ligne, consulté le )
- (en) Adolfo Porcellini, « Regenerative medicine: a review », Revista Brasileira de Hematologia e Hemoterapia, vol. 31, (ISSN 1516-8484, DOI 10.1590/S1516-84842009000800017, lire en ligne, consulté le )
- (en) Garima Singh, Sri Krishna jayadev Magani, Rinku Sharma, Basharat Bhat, Ashish Shrivastava, Madhusudhan Chinthakindi et Ashutosh Singh, « Structural, functional and molecular dynamics analysis of cathepsin B gene SNPs associated with tropical calcific pancreatitis, a rare disease of tropics : Table 1: The Single Nucleotide Polymorphisms in cathepsin B protein mined from literature », PeerJ, (PMID 16492714, DOI 10.7717/peerj.7425, lire en ligne, consulté le )
- Matthew James Branch, Khurram Hashmani, Permesh Dhillon et D. Rhodri E. Jones, « Mesenchymal stem cells in the human corneal limbal stroma », Investigative Ophthalmology & Visual Science, vol. 53, no 9, , p. 5109–5116 (ISSN 1552-5783, PMID 22736610, DOI 10.1167/iovs.11-8673, lire en ligne, consulté le )
- Ranjeet Singh Mahla, « Stem Cells Applications in Regenerative Medicine and Disease Therapeutics », International Journal of Cell Biology, vol. 2016, , p. 6940283 (ISSN 1687-8876, PMID 27516776, PMCID 4969512, DOI 10.1155/2016/6940283, lire en ligne, consulté le )
- Netter, Frank H. (Frank Henry), 1906-1991., The Netter collection of medical illustrations, Icon Learning Systems, ©1959- (ISBN 0-914168-24-X, 978-0-914168-24-9 et 0-914168-11-8, OCLC 47032622, lire en ligne)
- (en) Carl A. Gregory, Darwin J. Prockop et Jeffrey L. Spees, « Non-hematopoietic bone marrow stem cells: Molecular control of expansion and differentiation », Experimental Cell Research, vol. 306, no 2, , p. 330–335 (DOI 10.1016/j.yexcr.2005.03.018, lire en ligne, consulté le )
- Arutyunyan I, Elchaninov A, Makarov A, Fatkhudinov T. Umbilical Cord as Prospective Source for Mesenchymal Stem Cell-Based Therapy. Stem Cells Int 2016; 2016:6901286 ; http://dx.doi.org/10.1155/2016/6901286
- Orleans, L. A., is Vice, H., & Manchikanti, L. (2020) Expanded Umbilical Cord Mesenchymal Stem Cells (UC-MSCs) as a Therapeutic Strategy In Managing Critically Ill COVID-19 Patients: The Case for Compassionate Use. Pain Physician, 23, E71-E83.
- [lire en ligne (page consultée le 2018-10-30)]
- (en) Yuehua Jiang, Balkrishna N. Jahagirdar, R. Lee Reinhardt et Robert E. Schwartz, « Pluripotency of mesenchymal stem cells derived from adult marrow », Nature, vol. 418, no 6893, , p. 41–49 (ISSN 0028-0836 et 1476-4687, DOI 10.1038/nature00870, lire en ligne, consulté le )
- (en) Ana Paula Franco Lambert, Aline Fraga Zandonai, Diego Bonatto et Denise Cantarelli Machado, « Differentiation of human adipose-derived adult stem cells into neuronal tissue: Does it work? », Differentiation, vol. 77, no 3, , p. 221–228 (DOI 10.1016/j.diff.2008.10.016, lire en ligne, consulté le )
- (en) Adam J. Engler, Shamik Sen, H. Lee Sweeney et Dennis E. Discher, « Matrix Elasticity Directs Stem Cell Lineage Specification », Cell, vol. 126, no 4, , p. 677–689 (DOI 10.1016/j.cell.2006.06.044, lire en ligne, consulté le )
- Tipnis S, Viswanathan C, Majumdar AS (2010) Immunosuppressive properties of human umbilical cord-derived mesenchymal stem cells: role of B7-H1 and IDO. Immunol Cell Biol; 88:795- 806.
- (en) Grazia Maria Spaggiari, Heba Abdelrazik, Flavio Becchetti et Lorenzo Moretta, « MSCs inhibit monocyte-derived DC maturation and function by selectively interfering with the generation of immature DCs: central role of MSC-derived prostaglandin E2 », Blood, vol. 113, no 26, , p. 6576–6583 (ISSN 0006-4971 et 1528-0020, DOI 10.1182/blood-2009-02-203943, lire en ligne, consulté le )
- (en) Guangwen Ren, Xin Zhao, Liying Zhang et Jimin Zhang, « Inflammatory Cytokine-Induced Intercellular Adhesion Molecule-1 and Vascular Cell Adhesion Molecule-1 in Mesenchymal Stem Cells Are Critical for Immunosuppression », The Journal of Immunology, vol. 184, no 5, , p. 2321–2328 (ISSN 0022-1767 et 1550-6606, PMID 20130212, PMCID PMC2881946, DOI 10.4049/jimmunol.0902023, lire en ligne, consulté le )
- (en) Kentaro Akiyama, Chider Chen, DanDan Wang et Xingtian Xu, « Mesenchymal-Stem-Cell-Induced Immunoregulation Involves FAS-Ligand-/FAS-Mediated T Cell Apoptosis », Cell Stem Cell, vol. 10, no 5, , p. 544–555 (PMID 22542159, PMCID PMC3348385, DOI 10.1016/j.stem.2012.03.007, lire en ligne, consulté le )
- (en) Jaehyup Kim et Peiman Hematti, « Mesenchymal stem cell–educated macrophages: A novel type of alternatively activated macrophages », Experimental Hematology, vol. 37, no 12, , p. 1445–1453 (PMID 19772890, PMCID PMC2783735, DOI 10.1016/j.exphem.2009.09.004, lire en ligne, consulté le )
- (en) J. M. Brown, K. Nemeth, N. M. Kushnir-Sukhov et D. D. Metcalfe, « Bone marrow stromal cells inhibit mast cell function via a COX2-dependent mechanism: Mast cell inhibition by BMSC », Clinical & Experimental Allergy, vol. 41, no 4, , p. 526–534 (PMID 21255158, PMCID PMC3078050, DOI 10.1111/j.1365-2222.2010.03685.x, lire en ligne, consulté le )
- (en) Linda J Kay, Wilfred W Yeo et Peter T Peachell, « Prostaglandin E 2 activates EP 2 receptors to inhibit human lung mast cell degranulation », British Journal of Pharmacology, vol. 147, no 7, , p. 707–713 (PMID 16432506, PMCID PMC1751511, DOI 10.1038/sj.bjp.0706664, lire en ligne, consulté le )
- (en) Grazia Maria Spaggiari, Andrea Capobianco, Stelvio Becchetti et Maria Cristina Mingari, « Mesenchymal stem cell-natural killer cell interactions: evidence that activated NK cells are capable of killing MSCs, whereas MSCs can inhibit IL-2-induced NK-cell proliferation », Blood, vol. 107, no 4, , p. 1484–1490 (ISSN 0006-4971 et 1528-0020, DOI 10.1182/blood-2005-07-2775, lire en ligne, consulté le )
- (en) Lizzia Raffaghello, Giordano Bianchi, Maria Bertolotto et Fabrizio Montecucco, « Human Mesenchymal Stem Cells Inhibit Neutrophil Apoptosis: A Model for Neutrophil Preservation in the Bone Marrow Niche », Stem Cells, vol. 26, no 1, , p. 151–162 (DOI 10.1634/stemcells.2007-0416, lire en ligne, consulté le )
- (en) Xiao-Xia Jiang, Yi Zhang, Bing Liu et Shuang-Xi Zhang, « Human mesenchymal stem cells inhibit differentiation and function of monocyte-derived dendritic cells », Blood, vol. 105, no 10, , p. 4120–4126 (ISSN 0006-4971 et 1528-0020, DOI 10.1182/blood-2004-02-0586, lire en ligne, consulté le )
- (en) S Ma, N Xie, W Li et B Yuan, « Immunobiology of mesenchymal stem cells », Cell Death & Differentiation, vol. 21, no 2, , p. 216–225 (ISSN 1350-9047 et 1476-5403, PMID 24185619, PMCID PMC3890955, DOI 10.1038/cdd.2013.158, lire en ligne, consulté le )
- (en) Guangwen Ren, Liying Zhang, Xin Zhao et Guangwu Xu, « Mesenchymal Stem Cell-Mediated Immunosuppression Occurs via Concerted Action of Chemokines and Nitric Oxide », Cell Stem Cell, vol. 2, no 2, , p. 141–150 (DOI 10.1016/j.stem.2007.11.014, lire en ligne, consulté le )
- (en) Massimo Di Nicola, Carmelo Carlo-Stella, Michele Magni et Marco Milanesi, « Human bone marrow stromal cells suppress T-lymphocyte proliferation induced by cellular or nonspecific mitogenic stimuli », Blood, vol. 99, no 10, , p. 3838–3843 (ISSN 1528-0020 et 0006-4971, DOI 10.1182/blood.V99.10.3838, lire en ligne, consulté le )
- (en) Andrea Augello, Roberta Tasso, Simone?Maria Negrini et Andrea Amateis, « Bone marrow mesenchymal progenitor cells inhibit lymphocyte proliferation by activation of the programmed death 1 pathway », European Journal of Immunology, vol. 35, no 5, , p. 1482–1490 (ISSN 0014-2980 et 1521-4141, DOI 10.1002/eji.200425405, lire en ligne, consulté le )
- (en) Sarah Glennie, Inês Soeiro, Peter J. Dyson et Eric W.-F. Lam, « Bone marrow mesenchymal stem cells induce division arrest anergy of activated T cells », Blood, vol. 105, no 7, , p. 2821–2827 (ISSN 0006-4971 et 1528-0020, DOI 10.1182/blood-2004-09-3696, lire en ligne, consulté le )
- (en) Sudeepta Aggarwal et Mark F. Pittenger, « Human mesenchymal stem cells modulate allogeneic immune cell responses », Blood, vol. 105, no 4, , p. 1815–1822 (ISSN 0006-4971 et 1528-0020, DOI 10.1182/blood-2004-04-1559, lire en ligne, consulté le )
- (en) Anna Corcione, Federica Benvenuto, Elisa Ferretti et Debora Giunti, « Human mesenchymal stem cells modulate B-cell functions », Blood, vol. 107, no 1, , p. 367–372 (ISSN 0006-4971 et 1528-0020, DOI 10.1182/blood-2005-07-2657, lire en ligne, consulté le )
- Anna Krasnodembskaya, Yuanlin Song, Xiaohui Fang et Naveen Gupta, « Antibacterial effect of human mesenchymal stem cells is mediated in part from secretion of the antimicrobial peptide LL-37 », Stem Cells (Dayton, Ohio), vol. 28, no 12, , p. 2229–2238 (ISSN 1549-4918, PMID 20945332, PMCID 3293245, DOI 10.1002/stem.544, lire en ligne, consulté le )
- Dong Kyung Sung, Yun Sil Chang, Se In Sung et Hye Soo Yoo, « Antibacterial effect of mesenchymal stem cells against Escherichia coli is mediated by secretion of beta- defensin- 2 via toll- like receptor 4 signalling », Cellular Microbiology, vol. 18, no 3, , p. 424–436 (ISSN 1462-5822, PMID 26350435, PMCID 5057339, DOI 10.1111/cmi.12522, lire en ligne, consulté le )
- Naveen Gupta, Anna Krasnodembskaya, Maria Kapetanaki et Majd Mouded, « Mesenchymal stem cells enhance survival and bacterial clearance in murine Escherichia coli pneumonia », Thorax, vol. 67, no 6, , p. 533–539 (ISSN 1468-3296, PMID 22250097, PMCID 3358432, DOI 10.1136/thoraxjnl-2011-201176, lire en ligne, consulté le )
- Francisca Alcayaga-Miranda, Jimena Cuenca, Aldo Martin et Luis Contreras, « Combination therapy of menstrual derived mesenchymal stem cells and antibiotics ameliorates survival in sepsis », Stem Cell Research & Therapy, vol. 6, , p. 199 (ISSN 1757-6512, PMID 26474552, PMCID 4609164, DOI 10.1186/s13287-015-0192-0, lire en ligne, consulté le )
- (en) R Meisel, S Brockers, K Heseler et Ö Degistirici, « Human but not murine multipotent mesenchymal stromal cells exhibit broad-spectrum antimicrobial effector function mediated by indoleamine 2,3-dioxygenase », Leukemia, vol. 25, no 4, , p. 648–654 (ISSN 0887-6924 et 1476-5551, DOI 10.1038/leu.2010.310, lire en ligne, consulté le )
- Asieh Heirani-Tabasi, Marzieh Hassanzadeh, Shabnam Hemmati-Sadeghi et Mina Shahriyari, « Mesenchymal Stem Cells; Defining the Future of Regenerative Medicine », Journal of Genes and Cells, vol. 1, no 2, , p. 34 (ISSN 2410-6887, DOI 10.15562/gnc.15, lire en ligne, consulté le )
- (en) Johnathon D. Anderson, Henrik J. Johansson, Calvin S. Graham et Mattias Vesterlund, « Comprehensive Proteomic Analysis of Mesenchymal Stem Cell Exosomes Reveals Modulation of Angiogenesis via Nuclear Factor-KappaB Signaling: MSC Exosomes Induce Angiogenesis via NFkB Pathway », STEM CELLS, vol. 34, no 3, , p. 601–613 (PMID 26782178, PMCID PMC5785927, DOI 10.1002/stem.2298, lire en ligne, consulté le )
- (en) Fernando E Figueroa, Flavio Carrión, Sandra Villanueva et Maroun Khoury, « Mesenchymal Stem Cell treatment for autoimmune diseases: a critical review », Biological Research, vol. 45, no 3, , p. 269–277 (ISSN 0716-9760, DOI 10.4067/S0716-97602012000300008, lire en ligne, consulté le )
- (en) Ratti Ram Sharma, Kathryn Pollock, Allison Hubel et David McKenna, « Mesenchymal stem or stromal cells: a review of clinical applications and manufacturing practices: MSC Clinical Applications and Manufacturing », Transfusion, vol. 54, no 5, , p. 1418–1437 (PMID 24898458, PMCID PMC6364749, DOI 10.1111/trf.12421, lire en ligne, consulté le )
- (en) Uwe M. Fischer, Matthew T. Harting, Fernando Jimenez et Werner O. Monzon-Posadas, « Pulmonary Passage is a Major Obstacle for Intravenous Stem Cell Delivery: The Pulmonary First-Pass Effect », Stem Cells and Development, vol. 18, no 5, , p. 683–692 (ISSN 1547-3287 et 1557-8534, PMID 19099374, PMCID PMC3190292, DOI 10.1089/scd.2008.0253, lire en ligne, consulté le )
- (en) Peiman Hematti, « Mesenchymal stromal cells and fibroblasts: a case of mistaken identity? », Cytotherapy, vol. 14, no 5, , p. 516–521 (DOI 10.3109/14653249.2012.677822, lire en ligne, consulté le )
- (en) M. Dominici, K. Le Blanc, I. Mueller et I. Slaper-Cortenbach, « Minimal criteria for defining multipotent mesenchymal stromal cells. The International Society for Cellular Therapy position statement », Cytotherapy, vol. 8, no 4, , p. 315–317 (DOI 10.1080/14653240600855905, lire en ligne, consulté le )
- (en) Chao Wan, Qiling He, Mervyn McCaigue et David Marsh, « Nonadherent cell population of human marrow culture is a complementary source of mesenchymal stem cells (MSCs) », Journal of Orthopaedic Research, vol. 24, no 1, , p. 21–28 (ISSN 0736-0266 et 1554-527X, DOI 10.1002/jor.20023, lire en ligne, consulté le )
- (en) S Gronthos, Se Graves, S Ohta et Pj Simmons, « The STRO-1+ fraction of adult human bone marrow contains the osteogenic precursors », Blood, vol. 84, no 12, , p. 4164–4173 (ISSN 0006-4971 et 1528-0020, DOI 10.1182/blood.V84.12.4164.bloodjournal84124164, lire en ligne, consulté le )
- (en) Guiting Lin, Gang Liu, Lia Banie et Guifang Wang, « Tissue Distribution of Mesenchymal Stem Cell Marker Stro-1 », Stem Cells and Development, vol. 20, no 10, , p. 1747–1752 (ISSN 1547-3287 et 1557-8534, PMID 21208041, PMCID PMC3182037, DOI 10.1089/scd.2010.0564, lire en ligne, consulté le )
- (en) Hongxiu Ning, Guiting Lin, Tom F. Lue et Ching-Shwun Lin, « Mesenchymal stem cell marker Stro-1 is a 75kd endothelial antigen », Biochemical and Biophysical Research Communications, vol. 413, no 2, , p. 353–357 (PMID 21903091, PMCID PMC3183308, DOI 10.1016/j.bbrc.2011.08.104, lire en ligne, consulté le )
- Paola Iudicone, Daniela Fioravanti, Giuseppina Bonanno et Michelina Miceli, « Pathogen-free, plasma-poor platelet lysate and expansion of human mesenchymal stem cells », Journal of Translational Medicine, vol. 12, , p. 28 (ISSN 1479-5876, PMID 24467837, PMCID 3918216, DOI 10.1186/1479-5876-12-28, lire en ligne, consulté le )
- T. Tondreau, L. Lagneaux, M. Dejeneffe et A. Delforge, « Isolation of BM mesenchymal stem cells by plastic adhesion or negative selection: phenotype, proliferation kinetics and differentiation potential », Cytotherapy, vol. 6, no 4, , p. 372–379 (ISSN 1465-3249, PMID 16146890, DOI 10.1080/14653240410004943, lire en ligne, consulté le )
- Martini H (2019) Impact du vieillissement sur les cellules stromales mésenchymateuses cardiaques (Doctoral dissertation, Université de Toulouse, Université Toulouse III-Paul Sabatier) (résumé).
- Tachikart Y (2019) Révéler le lien entre la sénescence cellulaire et la pathologie de l'arthrose: un rôle des cellules souches mésenchymateuses et du facteur Chi3L1 (Doctoral dissertation, Montpellier) (résumé).
- Bin Jiang, Xufeng Fu, Li Yan et Shanshan Li, « Transplantation of human ESC-derived mesenchymal stem cell spheroids ameliorates spontaneous osteoarthritis in rhesus macaques », Theranostics, vol. 9, no 22, , p. 6587–6600 (ISSN 1838-7640, PMID 31588237, PMCID 6771254, DOI 10.7150/thno.35391, lire en ligne, consulté le )
- Léa Lemaitre, « Analyse transcriptomique des cellules stromales mésenchymateuses au cours du traitement du Myélome Multiple », Université de Bordeaux (thése), , p. 84 (lire en ligne, consulté le )
- Gruel R (2019) Étude des mécanismes sous-tendant la récupération fonctionnelle post-AVC associée à la transplantation différée de cellules hADSC exprimant le neuropeptide PACAP (Doctoral dissertation, Normandie). (résumé)