Acide ascorbique
L'acide ascorbique, ou acide oxo-3-gulofuranolactone (forme énolique), est un acide organique ayant des propriétés antioxydantes. Il est présent sous une forme énantiomériquement pure (acide L-ascorbique ou vitamine C) dans les citrons, les jus de fruits et les légumes frais. Le nom « ascorbique » vient du préfixe grec a (privatif) et de scorbut, signifiant littéralement « anti-scorbut » qui est une maladie due à une déficience en vitamine C.
| Acide ascorbique | |
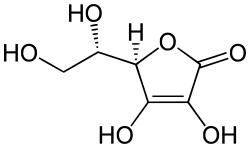
| |
| Structure de l'acide L-ascorbique | |
| Identification | |
|---|---|
| Nom UICPA | 5-(1,2-dihydroxyéthyl)-3,4-dihydroxyfuran-2-one |
| Synonymes |
acide DL-ascorbique |
| No CAS | (forme DL) |
| No CE | 263-644-3 |
| Code ATC | G01, S01, A11 |
| DrugBank | DB00126 |
| PubChem | 235 |
| No E | E300 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C6H8O6 [Isomères] |
| Masse molaire[1] | 176,124 1 ± 0,007 2 g/mol C 40,92 %, H 4,58 %, O 54,5 %, |
| pKa | 4,1 et 11,8 |
| Thermochimie | |
| Cp | |
| Précautions | |
| SIMDUT[3] | |
Produit non contrôlé |
|
| Directive 67/548/EEC | |
| Inhalation | Toux. Mal de gorge |
| Peau | Rougeur |
| Yeux | Rougeur. Douleur |
| Écotoxicologie | |
| DL50 | 3 367 mg·kg-1 (souris, oral) 518 mg·kg-1 (souris, i.v.) 10 000 mg·kg-1 (rat, s.c.) 643 mg·kg-1 (souris, i.p.)[4] |
| DJA | 1 050 mg pour une personne de 70 kg[5] |
| Données pharmacocinétiques | |
| Demi-vie d’élim. | 13 - 40 jours (humains), 3 jours (cochons d'Inde)[5] |
| Unités du SI et CNTP, sauf indication contraire. | |
Propriétés physico-chimiques
L'acide ascorbique est un diacide (pKa de 4,1 et 11,8) et un réducteur.
Stéréoisomérie
L'acide ascorbique ayant deux atomes de carbone asymétriques et étant sans plan de symétrie, il se présente sous la forme de deux paires d'énantiomères, diastéréoisomères entre elles. Une paire d'énantiomères est connue sous le nom d'acide ascorbique tandis que l'autre est distinguée par le nom d'acide isoascorbique (aussi appelé acide érythorbique).
- (5R)-5-[(1S)-1,2-dihydroxyéthyl]-3,4-dihydroxyfuran-2-one ou acide L-(+)-ascorbique, numéro CAS , forme naturelle et connue sous le nom de vitamine C
- (5S)-5-[(1R)-1,2-dihydroxyéthyl]-3,4-dihydroxyfuran-2-one ou acide D-(–)-ascorbique, numéro CAS
- (5R)-5-[(1R)-1,2-dihydroxyéthyl]-3,4-dihydroxyfuran-2-one ou acide D-isoascorbique, numéro CAS
- (5S)-5-[(1S)-1,2-dihydroxyéthyl]-3,4-dihydroxyfuran-2-one ou acide L-isoascorbique, numéro CAS

Tautomérie
L’acide ascorbique est majoritairement sous sa forme stable « énolique » car cette dernière fait apparaître une conjugaison des liaisons doubles, ce qui est stabilisant. Néanmoins, cette forme est en équilibre avec une hydroxycétone par transfert de proton. La réaction associée est une tautomérisation céto-énolique. Il y a deux formes possibles d'hydroxycétone.

Les sels, appelés ascorbates, possèdent les mêmes propriétés physiologiques et sont donc inclus dans la dénomination « Vitamine C ».
Usage
On utilise l’acide ascorbique dans l'industrie agroalimentaire en tant qu'antioxydant sous le code E300. Il a pour fonction d'empêcher la prolifération de bactéries qui pourraient dégrader le produit (surtout dans la nourriture à conservation longue et non réfrigérée). Il est aussi utilisé :
- dans certaines bières ;
- dans le vin, pour son pouvoir réducteur ; en effet, en milieu acide, il fixe l’oxygène dissous, à la température ordinaire, en formant l’acide déhydro-ascorbique. Il permet d’une part d’économiser une petite quantité d’anhydrides sulfureux libre pour éviter l’oxydation des vins et de plus, il a des applications pratiques intéressantes en protégeant le vin de la casse ferrique lors du dernier stade, la mise en bouteille.
- dans le traitement de certains fruits afin d'éviter leur oxydation (ex. : mirabelles) ;
- dans certaines farines ou dans les adjuvants, afin d'améliorer la panification. Paradoxalement, il a un effet oxydant dans la pâte, augmentant le volume et donnant une croûte brillante et une mie plus blanche[6] ;
- dans certains jus de fruits (ex : Tropico) et sodas (ex. Orangina) ;
- dans certaines boissons au café (ex : Starbucks).
Il est aussi utilisé par des toxicomanes comme diluant de l'héroïne brune ou du crack[7].
Synthèse
Bien que présent naturellement dans certains aliments, l'acide ascorbique peut être synthétisé grâce au procédé Reichstein à partir du D-glucose. C'est une synthèse difficile faisant intervenir une étape biologique pour un rendement global d'environ 15 à 18 %[8].
Références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams, vol. 2, Huston, Texas, Gulf Pub. Co., (ISBN 0-88415-858-6)
- « Acide ascorbique » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 23 avril 2009
- (en) « Acide ascorbique », sur ChemIDplus, consulté le 9 août 2009
- (en) Volker Kuellmer, Kirk-Othmer encyclopedia of chemical technology: Ascorbic acid, vol. 25, John Wiley & Sons, , 4e éd.
- Pierre Feillet, Le grain de blé: Composition et utilisation, Editions Quae, (ISBN 9782738008961, lire en ligne), p. 215
- https://www.emcdda.europa.eu/attachements.cfm/att_134811_FR_FR%20-%20Infectious%20risk%20reduction%20among%20injecting%20drug%20users.pdf page 20/21
- (de) T. Reichstein et A. Grüssner, « Eine ergiebige Synthese der l‐Ascorbinsäure (C‐Vitamin) », (DOI 10.1002/hlca.19340170136, consulté le )
Voir aussi
- Ascorbate minéral
- Acide érythorbique (acide isoascorbique)
- Liste d'acides


