Polyacide
Un polyacide ou acide polyfonctionnel est un acide qui a la possibilité de libérer en solution aqueuse plusieurs ions H+ (ou protons) par opposition aux monoacides qui ne peuvent en libérer qu'un. Cette libération de protons se fait de manière successive ou simultanée[1]. À chaque libération de protons correspond un unique couple acide-base et son pKa associé.
Exemple de réactions
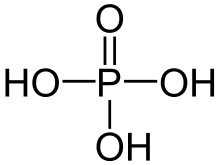
Structure de l'acide phosphorique.
Cas de l'acide phosphorique qui peut céder trois protons et est alors triacide :
- H3PO4 + H2O H2PO4− + H3O+ pKa1 = 2,15
- H2PO4− + H2O HPO42− + H3O+ pKa2 = 7,20
- HPO42− + H2O PO43− + H3O+ pKa3 = 12,42
Exemples
- Diacides :
- Acide ascorbique et acide érythorbique (acides organiques)
- Acide carbonique : H2CO3
- Acide chromique
- Acide sulfurique (acide minéral) : H2SO4
- Triacides :
- Ion oxonium : H3O+
- Acide phosphorique : H3PO4
- Acide citrique (acide tricarboxylique) : C6H8O7
Références
- Jean-Louis Brisset, Ahmed Addou, Mustapha Draoui, David Moussa et Fatiha Abdelmalek, Chimie analytique en solution : Principes et applications, Lavoisier, 2011.
Cet article est issu de wikipedia. Text licence: CC BY-SA 4.0, Des conditions supplémentaires peuvent s’appliquer aux fichiers multimédias.
