Tétracarbonyle de nickel
Le tétracarbonyle de nickel, souvent appelé nickel carbonyle, est un composé chimique de formule Ni(CO)4. Il s'agit d'un liquide incolore à jaune pâle parmi les plus toxiques utilisés en milieu industriel, intervenant dans le procédé Mond de purification du nickel ainsi que dans la chimie des organométalliques.
| Tétracarbonyle de nickel | |
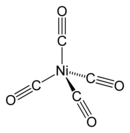 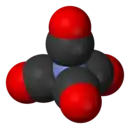 Structure du tétracarbonyle de nickel |
|
| Identification | |
|---|---|
| Nom UICPA | tétracarbonylnickel |
| Synonymes |
nickel carbonyle, |
| No CAS | |
| No ECHA | 100.033.322 |
| No CE | 236-669-2 |
| No RTECS | QR6300000 |
| PubChem | 26039 |
| ChEBI | 30372 |
| SMILES | |
| InChI | |
| Apparence | liquide incolore |
| Propriétés chimiques | |
| Formule | Ni(CO)4 |
| Masse molaire[1] | 170,733 8 ± 0,004 8 g/mol C 28,14 %, Ni 34,38 %, O 37,48 %, |
| Propriétés physiques | |
| T° fusion | −25 °C[2] |
| T° ébullition | 43 °C[2] |
| Solubilité | 2 mg·l-1 à 20 °C[2] |
| Masse volumique | 1,32 g·cm-3[2] |
| T° d'auto-inflammation | 35 °C[2] |
| Point d’éclair | −20 °C[2] |
| Pression de vapeur saturante | 42,5 kPa à 20 °C 63,7 kPa à 30 °C 92,9 kPa à 40 °C[2] |
| Précautions | |
| SGH[2] | |
    Danger |
|
| Transport[2] | |
| Classification du CIRC | |
| Cancérogène du groupe 1 | |
| Unités du SI et CNTP, sauf indication contraire. | |
Structure
Le tétracarbonyle de nickel possède 18 électrons de valence et un atome de nickel à l'état d'oxydation 0. C'est un agrégat atomique à géométrie tétraédrique dans lequel quatre ligands carbonyle CO sont liés à l'atome de nickel par une liaison carbone-métal. Les analyses géométriques par diffraction des électrons ont permis de mesurer la longueur des liaisons Ni–C et C≡O respectivement à 183,8(2) pm et 114,1(2) pm[3].
Préparation
La première synthèse du tétracarbonyle de nickel a été réalisée par Ludwig Mond en 1890 par réaction directe de nickel métallique avec le monoxyde de carbone CO[4]. Ce travail de pionnier a éclipsé l'existence de nombreux autres carbonyles métalliques, entre autres ceux de vanadium, de chrome, de manganèse, de fer et de cobalt. Il a trouvé une application industrielle avant la fin du XIXe siècle dans la purification du nickel[5] en faisant circuler du monoxyde de carbone sur du nickel non purifié à 50 °C, le rendement optimal se situant autour de 130 °C[6].
Le tétracarbonyle de nickel ne se trouve pas facilement dans le commerce ; il est en revanche aisément généré en laboratoire par carbonylation du bis(1,5-cyclooctadiène)nickel qui est, quant à lui, disponible dans le commerce.
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Entrée « Tetracarbonylnickel » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 29 novembre 2011 (JavaScript nécessaire)
- (en) Lise Hedberg, Takao Iijima et Kenneth Hedberg, « Nickel tetracarbonyl, Ni(CO)4. I. Molecular structure by gaseous electron diffraction. II. Refinement of quadratic force field », The Journal of Chemical Physics, vol. 70, no 7, , p. 3224 (DOI 10.1063/1.437911)
- (en) Ludwig Mond, C. Langer et F. Quincke, « Action of Carbon Monoxide on Nickel », J. Chem. Soc., Trans., vol. 57, , p. 749–53 (DOI 10.1039/CT8905700749)
- (en) « The Extraction of Nickel from its Ores by the Mond Process », Nature, vol. 59, no 1516, , p. 63-64 (DOI 10.1038/059063a0)
- (en) Lascelles,Keith; Morgan, Lindsay G.; & Nicholls, David, « Nickel Compounds », Ullmann's Encyclopedia of Industrial Chemistry, vol. A17, no 5, , p. 235–249 (ISBN 3527306730, DOI 10.1002/14356007.a17_157)

