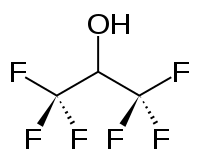
Hexafluoropropan-2-ol
L'hexafluoropropan-2-ol ou hexafluoroisopropanol, couramment abrégé en HFIP, est un composé organique de formule (CF3)2CHOH appartenant à la famille des alcools fluorés. À température ambiante, il se présente sous la forme d'un liquide incolore, volatil avec une odeur piquante caractéristique. Il est utilisé comme solvant notamment pour les polymères, mais aussi de par sa forte polarité et sa forte capacité à produire des liaisons hydrogène, il est utilisé pour dissoudre des composés capable d'accepter ces liaisons hydrogène, comme des amides ou des éthers. L'hexafluoropropan-2-ol est transparent à la lumière UV, il est dense, peu visqueux et a un indice de réfraction faible.
| Hexafluoropropan-2-ol | ||
| ||
 | ||
| Identification | ||
|---|---|---|
| Nom UICPA | 1,1,1,3,3,3-hexafluoropropan-2-ol | |
| Synonymes |
hexafluoroisopropanol |
|
| No CAS | ||
| No ECHA | 100.011.873 | |
| No CE | 213-059-4 | |
| No RTECS | UB6450000 | |
| PubChem | 13529 | |
| SMILES | ||
| InChI | ||
| Apparence | Liquide incolore | |
| Propriétés chimiques | ||
| Formule | C3H2F6O [Isomères] |
|
| Masse molaire[1] | 168,037 8 ± 0,002 8 g/mol C 21,44 %, H 1,2 %, F 67,84 %, O 9,52 %, |
|
| Propriétés physiques | ||
| T° fusion | −4,00 °C[2] | |
| T° ébullition | 57,85 °C[3] | |
| Paramètre de solubilité δ | 19,3 J1/2·cm-3/2 (25 °C)[4] | |
| Masse volumique | 1.596 g/mL à 25 °C | |
| Propriétés optiques | ||
| Indice de réfraction | = 1,275[5] | |
| Précautions | ||
| NFPA 704 | ||
| Directive 67/548/EEC[5] | ||
| Transport | ||
| Écotoxicologie | ||
| DL50 | 600 mg·kg-1 (souris, oral)[6] 180 mg·kg-1 (souris, i.v.)[7] 300 mg·kg-1 (souris, i.p.)[6] |
|
| LogP | 1,66[2] | |
| Composés apparentés | ||
| Autres composés | ||
| Unités du SI et CNTP, sauf indication contraire. | ||
Synthèse
L'hexafluoropropan-2-ol est en général synthétisé à partir de l'hexafluoropropylène. Celui-ci est transformé en hexafluoroacétone qui est ensuite réduite par un réducteur fort comme le tétrahydruroaluminate de lithium ou le tétrahydruroborate de sodium. Il est également possible de faire subir à l'hexafluoroacétone une hydrogénation, catalysée par exemple par le nickel de Raney, du platine ou du palladium.
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) « Hexafluoroisopropanol », sur NIST/WebBook, consulté le 12/11/2010
- PCR Inc., Research Chemicals Catalog 1990-1991, PCR Inc., Gainesville, FL, 1990, 1.
- (en) Yitzhak Marcus, The Properties of Solvents, vol. 4, England, John Wiley & Sons Ltd, , 239 p. (ISBN 0-471-98369-1)
- 1,1,1,3,3,3-Hexafluoro-2-propanol chez Sigma-Aldrich.
- Journal of Medicinal Chemistry. Vol. 13, Pg. 1215, 1970.
- U.S. Army Armament Research & Development Command, Chemical Systems Laboratory, NIOSH Exchange Chemicals. Vol. NX#03623

