Bromure de césium
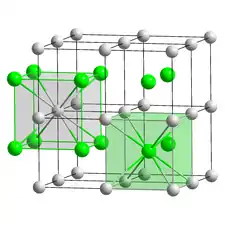
Le bromure de césium est un composé ionique du césium et du brome de formule chimique CsBr. C'est un solide blanc ou transparent avec un point de fusion de 636 °C qui se dissout facilement dans l'eau. Ses cristaux massifs possèdent le même type de structure cubique que le chlorure de césium, mais prennent une structure de type cubique à faces centrées similaire à celle du chlorure de sodium dans les films nanométriques formés sur des substrats de mica, LiF, KBr ou NaCl[8].
| Bromure de césium | |
| |
| __ Cs+ __ Br− | |
| Identification | |
|---|---|
| DCI | Bromure de césium |
| Synonymes |
Bromure de césium(I) |
| No CAS | |
| No ECHA | 100.029.209 |
| No CE | 232-1300 |
| PubChem | 24592 |
| SMILES | |
| InChI | |
| Apparence | cristaux blancs ou inolores |
| Propriétés chimiques | |
| Formule | CsBr |
| Masse molaire[1] | 212,809 ± 0,001 g/mol Br 37,55 %, Cs 62,45 %, |
| Susceptibilité magnétique | −67,2×10−6 cm3·mol-1[2] |
| Propriétés physiques | |
| T° fusion | 636 °C[3] |
| T° ébullition | 1 300 °C[3] |
| Solubilité | 1 230 g·L-1 (eau, 25 °C)[3] |
| Masse volumique | 4,43 g·cm-3[3] |
| Thermochimie | |
| ΔfH0solide | −406 kJ·mol-1[4] |
| Cristallographie | |
| Système cristallin | cubique |
| Symbole de Pearson | |
| Classe cristalline ou groupe d’espace | Pm3m (no 221) [5]
|
| Structure type | CsCl |
| Paramètres de maille | a= 0,429 1 nm |
| Volume | 0,079 0 nm3 |
| Propriétés optiques | |
| Indice de réfraction | 1,8047 (0,3 µm) 1,6974 (0,59 µm) 1,6861 (0,75 µm) 1,6784 (1 µm) 1,6678 (5 µm) 1,6439 (20 µm)[6] |
| Précautions | |
| SGH | |
 |
|
| Écotoxicologie | |
| DL50 | 1400 mg/kg (oral, rat)[7] |
| Composés apparentés | |
| Autres cations | Bromure de sodium Bromure de potassium Bromure de rubidium Bromure de francium |
| Autres anions | Fluorure de césium Chlorure de césium Iodure de césium Astature de césium |
| Unités du SI et CNTP, sauf indication contraire. | |
Synthèse
Le bromure de césium peut être préparé par les réactions suivantes :
- CsOH (aq) + HBr (aq) → CsBr (aq) + H2O (l)
- Cs2(CO3) (aq) + 2 HBr (aq) → 2 CsBr (aq) + H2O (l) + CO2 (g)
- Synthèse directe :
- 2 Cs (s) + Br2 (g) → 2 CsBr (s)
La synthèse directe est une réaction violente du césium avec les autres halogènes. À cause de son coût élevé, elle n'est pas utilisée en préparation.
Utilisations
Le bromure de césium est parfois utilisé en optique comme miroir semi-réfléchissant dans les spectrophotomètres à large bande.
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Caesium bromide » (voir la liste des auteurs).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Haynes, p. 4.132
- Haynes, p. 4.57
- (de) A.F. Holleman, E. Wiberg et N. Wiberg, Lehrbuch der Anorganischen Chemie, Berlin, de Gruyter, , 102e éd., 2149 p. (ISBN 978-3-11-017770-1), p. 1281
- J. Vallin, O. Beckman et K. Salama, « Elastic Constants of CsBr and CsI from 4.2°K to Room Temperature », Journal of Applied Physics, vol. 35, no 4, , p. 1222 (DOI 10.1063/1.1713597)
- Haynes, p. 10.240
- Caesium bromide. nlm.nih.gov
- L. G. Schulz, « Polymorphism of cesium and thallium halides », Acta Crystallographica, vol. 4, no 6, , p. 487 (DOI 10.1107/S0365110X51001641)
Liens externes
- MSDS at Oxford University
- Physical data, [ Crystran PDF version]« http://www.crystran.co.uk/getfile.php?file=104 »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?), , PDF version
- IR transmission spectrum
- Ultra-violet photoabsorption measurements in alkali iodide and caesium bromide evaporated films



