Organocadmien
Un organocadmien est un composé organométallique contenant une liaison carbone-cadmium. Le cadmium est un élément du groupe 12 tout comme le zinc et le mercure et partage une grande partie de leurs propriétés chimiques.
Tous les organocadmiens sont sensibles à l'air, à la lumière et à l'humidité.
Exemples
Le diméthylcadmium est une molécule linéaire avec une liaison C-Cd de 213 pm[1]. Le diéthylecadmium est un liquide huileux incolore avec un point de fusion de 21 °C. Le diphénylcadmium est un solide avec un point de fusion de 174 °C.
Synthèse
Les premiers organocadmiens, le diméthylcadmium, CH3-Cd-CH3 et le diéthylcadmium, CH3CH2-Cd-CH2CH3 ont été synthétisés en 1917 par Erich Krause. En général, ils sont préparés par transmétallation ou par réaction d'échange entre un réactif organométallique et un sel de cadmium[2].
Une méthode de synthèse du diéthylcadmium est la réaction du bromure de cadmium avec deux équivalents d'un réactif de Grignard, le bromure d'éthylmagnésium dans le diéthyléther (un sous-produit de cette réaction étant le bromure de magnésium).
Le diphénylcadmium peut être synthétisé par réaction entre le phényllithium et le bromure de cadmium.
Réactions
L'utilité synthétique des organocadmiens est limitée. Les groupes alkyles sont moins nucléophiles que ceux des organozinciques de la hausse de l'électronégativité dans le sens descendant dans le groupe 12 (1,69 pour le cadmium contre 1,65 pour le zinc, la différence d'électronégativté avec le carbone — 2,55 — est donc moindre rendant celui-ci moins nucléophile). Cette baisse de réactivité se montre par exemple par la transformation de chlorures d'acyle en cétone avec ces réactifs[3]. Cette réaction a été découverte en 1936 par Henry Gilman et fut utilisés jusqu'à ce que l'on découvre qu'il soit possible de la faire également avec des organocuprates, bien moins toxiques. Avec d'autres réactifs organométalliques, une telle réaction se poursuit jusqu'à l'alcool correspondant.
Un exemple de l'utilisation d'organocadmien en synthèse organique est la réaction entre le diisoamylcadmium et le chlorure de β-carbométhoxypropionyle pour former le 4-céto-7-méthyloctanoate de méthyle sans réduire le groupe cétone ou le groupe ester[4].
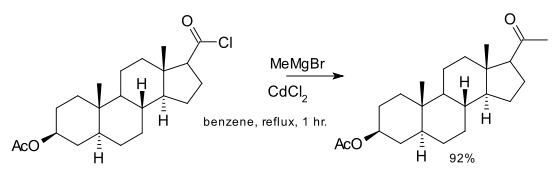
Un autre exemple est l'utilisation du méthylcadmium (synthétisé in situ par réaction entre le chlorure de cadmium et le bromure d'organomagnésium) dans une des étapes de la synthèse totale du cholestérol[5] :
Le diméthylcadmium est aussi utilisé dans la synthèse de nanocristaux colloïdaux, même si sa nature toxique et volatile font que les chercheurs essayent de trouver d'autres précurseurs du cadmium, comme l'oxyde de cadmium[6] - [7].
Cette sélectivité peut aussi montrer l'absence de sels dans la réaction[8] : quand le cadmium réactif est généré in situ à partir de sels de cadmium, la présence de sels d'halogénures rend le composé du cadmium bien plus réactif, même avec les cétones. Le même effet peut être observé avec les organozinciques.
Notes et références
- (en) Felix Hanke, Sarah Hindley, Anthony C. Jones et Alexander Steiner, « The Solid State Structures of the High and Low Temperature Phases of Dimethylcadmium », Chemical Communications, vol. 52, , p. 10144-10146 (DOI 10.1039/c6cc05851e)
- (en) Erich Krause, « Einfache Cadmiumdialkyle. (I. Mitteilung über organische Cadmium-Verbindungen.) », Berichte der deutschen chemischen Gesellschaft, vol. 50, no 2, , p. 1813–1822 (DOI 10.1002/cber.19170500292)
- (en) James Cason, « The Use of Organocadmium Reagents for the Preparation of Ketones », Chemical Reviews, vol. 40, no 1, , p. 15–32 (PMID 20287882, DOI 10.1021/cr60125a002)
- Organic Syntheses, Coll. Vol. 3, p. 601 (1955); Vol. 28, p. 75 (1948) Article
- The Total Synthesis of Steroids R. B. Woodward, Franz Sondheimer, David Taub, Karl Heusler, W. M. McLamore J. Am. Chem. Soc., 1952, 74 (17), p. 4223–4251 DOI 10.1021/ja01137a001
- Formation of High-Quality CdTe, CdSe, and CdS Nanocrystals Using CdO as Precursor Peng and Peng, J. Am. Chem. Soc. 2001, 123, 183-184
- « http://www.cchem.berkeley.edu/~pagrp/index.html »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?) (consulté le )
- The less familiar reactions of organocadmium reagents Paul R. Jones and Peter J. Desio Chem. Rev.; 1978; 78(5) p. 491 - 516 DOI 10.1021/cr60315a001
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Organocadmium compound » (voir la liste des auteurs).
Voir aussi
| C-H | He | |||||||||||||||||
| C-Li | C-Be | C-B | C-C | C-N | C-O | C-F | Ne | |||||||||||
| C-Na | C-Mg | C-Al | C-Si | C-P | C-S | C-Cl | C-Ar | |||||||||||
| C-K | C-Ca | C-Sc | C-Ti | C-V | C-Cr | C-Mn | C-Fe | C-Co | C-Ni | C-Cu | C-Zn | C-Ga | C-Ge | C-As | C-Se | C-Br | C-Kr | |
| C-Rb | C-Sr | C-Y | C-Zr | C-Nb | C-Mo | C-Tc | C-Ru | C-Rh | C-Pd | C-Ag | C-Cd | C-In | C-Sn | C-Sb | C-Te | C-I | C-Xe | |
| C-Cs | C-Ba | * | C-Lu | C-Hf | C-Ta | C-W | C-Re | C-Os | C-Ir | C-Pt | C-Au | C-Hg | C-Tl | C-Pb | C-Bi | C-Po | C-At | Rn |
| Fr | C-Ra | * * |
Lr | Rf | Db | C-Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
| ↓ | ||||||||||||||||||
| * | C-La | C-Ce | C-Pr | C-Nd | C-Pm | C-Sm | C-Eu | C-Gd | C-Tb | C-Dy | C-Ho | C-Er | C-Tm | C-Yb | ||||
| * * |
Ac | C-Th | C-Pa | C-U | C-Np | C-Pu | C-Am | C-Cm | C-Bk | C-Cf | C-Es | Fm | Md | No | ||||
| Liaison de base en chimie organique | Nombreuses utilisations en chimie |
| Recherche académique, peu d'usages courants | Liaison inconnue / non évaluée |