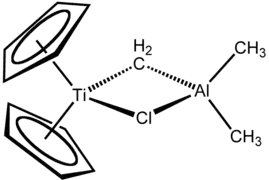
Composé organoaluminique
Un composé organoaluminique est un composé organométallique contenant une liaison carbone–aluminium[1]. Leurs propriétés découlent de la polarité de la liaison C–Al et de la forte acidité de Lewis des espèces tricoordonnées. Leur principal emploi industriel est la production de polyoléfines. Ce sont par exemple le triméthylaluminium (CH3)6Al2, le triéthylaluminium (CH3CH2)6Al2, le triisobutylaluminium ((CH3)2CHCH2)3Al ou encore le réactif de Tebbe.
Les composés alkylaluminium R3Al sont des liquides incolores. Ceux à chaînes alkyle R courtes s'enflamment spontanément à l'air et réagissent de manière explosive au contact de l'eau ; ceux qui portent des groupes R plus longs sont moins réactifs. Les dérivés RnAlX3–n, où X = F, Cl, Br, I, OR, NR2, etc. se comportent également de manière sensiblement moins réactive. Les composés organoaluminiques réagissent avec la plupart des solvants, hormis les hydrocarbures saturés et aromatiques ; le contact avec le chloroforme CHCl3 est susceptible de provoquer des explosions. La décomposition thermique par déshydroalumination commence à 80 °C pour les composé organoaluminiques avec des groupes alkyle β-ramifiés et à 120 °C pour les organoaluminiques avec des groupes n-alkyle.
Structure et liaisons
Composés d'aluminium(III)

Les composés organoaluminiques présentent généralement des centres Al à trois ou quatre ligands coordonnés, bien que des coordinences plus élevées soient observées avec des ligands inorganiques tels que l'anion fluorure Cl−. L'aluminium tétracoordonné tend à adopter une géométrie tétraédrique. L'atome d'aluminium est plus gros que celui de bore et peut de ce fait coordonner quatre ligands carbonés.
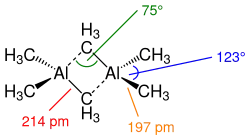
Les composés organoaluminiques tricoordonnés sont généralement des dimères ayant deux ligands alkyle pontants. Ainsi, la molécule de triméthylaluminium, malgré son nom, est formée de deux atomes d'aluminium et six groupes méthyle, pour donner une structure Me2Al(µ-Me)2AlMe2.
Lorsque le composé organoaluminique porte un ligand hydrure ou halogénure, ces ligands de petite taille occupent les sites pontants ; en revanche, lorsque les chaînes carbonées R sont volumineuses, la coordinence de l'aluminium se limite à 3, ce qui est, par exemple, le cas avec les ligands mésityle 2,4,6-(CH3)3C6H2− ou isobutyle (CH3)2CHCH2−[3].
Échanges de ligands dans les composés trialkylaluminium
Les dimères de trialkylaluminium sont souvent impliqués dans des équilibres dynamiques, entraînant l'échange de ligands pontants et terminaux ainsi qu'entre les dimères. Même dans des solvants non coordinants, l'échange Al–Me est rapide, comme le confirme la RMN du proton. Par exemple, à −25 °C, le spectre RMN du 1H du triméthylaluminium Me6Al2 comprend deux pics dans un rapport 1:2, comme calculé à partir de la structure à l'état solide. À 20 °C, un seul pic est observé car l'échange de groupes méthyle terminaux et pontants est trop rapide pour être résolu par RMN[4]. Le fait que les monomères soient des acides de Lewis forts est lié à la taille du centre Al(III) et à sa tendance à atteindre une configuration électronique satisfaisant la règle de l'octet.
Composés d'aluminium(II) ou d'aluminium(I)
Le premier composé organoaluminique ayant une liaison Al–Al a été observé en 1988 avec le dialane de formule ((Me3Si)2CH)2Al–Al(CH(SiMe3)2)2. Ils sont généralement préparés par réduction des chlorures de dialkylaluminium (R2AlCl)2 par du potassium métallique[5] :
Un autre groupe notable d'alanes est formé par les tétraalanes ayant quatre centres Al(I). Ces composés adoptent un noyau tétraédrique, comme illustré par le (Cp*Al)4 et ((Me3Si3C)Al)4. Le groupe [Al12(i-Bu)12]2− a été obtenu à partir d'études connexes sur la réduction des composés organoaluminiques. Ce dianion adopte une structure icosaédrique rappelant l'anion dodécaborate [B12H12]2−. Son état d'oxydation formel est inférieur à 1.
Préparation
De manière semblable aux composés organosiliciés, les composés organoaluminiques sont principalement formés par les trois processus suivants :
- par addition oxydante d'halogénure de composé organique et d'aluminium (procédé direct) :
- 2 Al + 3 RX ⟶ RAlX2 / R2AlX ;
- par substitution nucléophile des halogénures d'aluminium par des anions organiques (métathèse) :
- R2AlX + R− ⟶ R2AlR + X− ;
- par insertion d'alcènes ou d'alcynes dans la liaison Al–H des alanes organiques (hydroalumination) :
- R2AlH + H2C=CH2 R2AlCH2CH3.
La transmétallation des organomercuriels est rarement utilisée :
À partir d'halogénures d'alkyle et d'aluminium
Industriellement, les composés alkylaluminium simples de type R6Al2, avec R = Me ou Et, sont préparés selon un procédé en deux étapes commençant par l'alkylation de la poudre d'aluminium pour donner du sesquichlorure d'éthylaluminium (CH3CH2)3Al2Cl3 :
- 2 Al + 3 CH3CH2Cl ⟶ (CH3CH2)3Al2Cl3.
La réaction est semblable à la synthèse des réactifs de Grignard. Le sesquichlorure formé peut être réduit en dérivé triorganoaluminique :
- 2 (CH3CH2)3Al2Cl3 + 6 Na ⟶ (CH3CH2)6Al2 + 2 Al + 6 NaCl.
C'est le procédé employé pour la production de triméthylaluminium Me6Al2 et le triéthylaluminium Et6Al2[6].
Hydroalumination
La poudre d'aluminium réagit directement avec certains alcènes terminaux en présence d'hydrogène. Le procédé comprend deux étapes, la première produisant des hydrures de dialkylaluminium. De telles réactions sont généralement conduites à des températures élevées et nécessitent une activation par des réactifs de trialkylaluminium :
Les hydrures organoaluminiques ayant des substituants R peu volumineux sont généralement trimériques. Dans une étape ultérieure, ces hydrures sont traités avec un excès d'alcène pour réaliser l'hydroalumination :
- 2 [(C2H4R)2AlH]3 + 3 CH2=CHR ⟶ 3 (C2H4R)3Al2.
L'hydrure de diisobutylaluminium [((CH3)2CHCH2)2AlH]2, qui est dimérique, est préparé par élimination à partir de triisobutylaluminium ((CH3)2CHCH2)3Al :
Carboalumination
Les composés organoaluminiques peuvent réagir avec les alcènes et les alcynes, entraînant l'addition nette d'un résidu organique et d'un fragment métallique sur la liaison multiple (carboalumination (en)). Ce procédé peut se dérouler de manière purement thermique ou en présence d'un catalyseur à base de métal de transition. Pour le procédé non catalysé, la monoaddition n'est possible que lorsque l'alcène est substitué. Pour l'éthylène, la carboalumination conduit à une distribution de Poisson d'espèces alkylaluminium supérieures. La réaction est régiosélective pour les alcènes terminaux[7]. La « réaction ZACA (en) », publiée pour la première fois par le prix Nobel de chimie japonais Ei-ichi Negishi, est un exemple de carboalumination asymétrique d'alcènes catalysée par un catalyseur zirconocène chiral[8].
La méthylalumination des alcynes en présence de dichlorure de zirconocène (C5H5)2ZrCl2[9] - [10] est employée pour la synthèse de fragments d'alcènes trisubstitués stéréodéfinis, qui sont un motif courant dans les terpènes et polycétides naturels. La synthèse de (E)-4-iodo-3-méthylbut-3-én-1-ol ci-dessous[11] est une application typique de cette réaction :
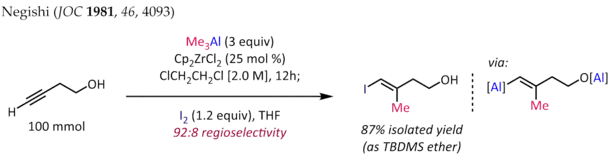
La régiosélectivité de la réaction est généralement assez élevée avec les alcynes terminaux (> 90:10 rr), pour lesquels on obtient une sélectivité syn complète même en présence de substituants hétéroatomiques propargyliques ou homopropargyliques. Cependant, la méthylalumination catalysées par le zirconocène donne des rendements et une régiosélectivité dégradés avec les alkyles supérieurs.
Préparation à l'échelle du laboratoire
Bien que les composés organoaluminiques les plus simples soient disponibles dans le commerce à prix modique, de nombreuses méthodes ont été développées pour la synthèse des organoaluminiques en laboratoire, notamment la métathèse ou la transmétallation. La métathèse du chlorure d'aluminium AlCl3 avec un organolithien RLi ou un réactif de Grignard RMgX donne le trialkyle R3Al, par exemple du tributylaluminium Bu3Al à partir de n-butyllithium BuLi :
La transmétallation d'un organomercuriel est également possible, par exemple à partir de diphénylmercure Ph2Hg, qui donne du triphénylaluminium Ph3Al :
Réactions
La forte réactivité des composés organoaluminiques vis-à-vis des électrophiles est attribuée à la séparation de charge entre l'aluminium et l'atome de carbone.
Acidité de Lewis
Les composés organoaluminiques sont des acides durs et forment facilement des adduits avec des bases telles que la pyridine, le tétrahydrofurane (THF) et les amines tertiaires. Ces adduits ont un centre Al à géométrie tétraédrique.
Électrophiles
La liaison Al–C est polarisée de sorte que le carbone soit hautement basique. Les acides réagissent pour donner des alcanes. Par exemple, les alcools donnent des alcoolates :
Une grande variété d'acides peut être employée outre les simples acides minéraux. Les amines donnent des amides. Avec le dioxyde de carbone, les composés trialkylaluminium donnent le carboxylate de dialkylaluminium, puis les dicarboxylates d'alkylaluminium, évoquant la carbonatation des réactifs de Grignard[12] - [13] :
La réaction entre les composés trialkylaluminium et le dioxyde de carbone a été utilisée pour produire des alcools, des alcènes[12] et des cétones[14]. L'oxygène donne les alcoolates correspondants, qui peuvent être hydrolysés en alcools :
- 2 R3Al + 3 O2 ⟶ 2 (RO)3Al.
Un peroxyde organoaluminique Al–O–O–C dont la structure a été caractérisée est par exemple (C6H5N(Me)C)2CH(R)Al–O–O–CMe3, avec R = (Me3Si)2CH–[15].
La réaction des composés trialkylaluminium purs avec l'eau, les alcools, les phénols, les amines, le dioxyde de carbone, les oxydes de soufre, les oxydes d'azote, les halogènes et les hydrocarbures halogénés peut être violente.
Polymérisation d'alcènes
Industriellement, les composés organoaluminiques sont utilisés comme catalyseurs pour la polymérisation des alcènes en polyoléfines, comme c'est le cas du méthylaluminoxane.
Notes et références
- (en) D. F. Shriver et P. W. Atkins, Inorganic Chemistry, Oxford University Press, 2006. (ISBN 978-0199264636)
- (de) A. F. Holleman et N. Wiberg, Anorganische Chemie, 103e éd., vol. 1, Grundlagen und Hauptgruppenelemente, Walter de Gruyter, Berlin & Boston 2016, p. 1366. (ISBN 978-3-11-049585-0)
- (en) C. Elschenbroich, Organometallics, 3e éd., Wiley-VCH, 2006. (ISBN 978-3-527-29390-2)
- (en) Frank Albert Cotton et Geoffrey Wilkinson, Advanced Inorganic Chemistry: A Comprehensive Text, John Wiley & Sons, 4e éd., 1980, p. 343. (ISBN 978-0-471-02775-1)
- (en) Werner Uhl, « Organoelement Compounds Possessing Al–Al, Ga–Ga, In–In, and Tl–Tl Single Bonds », Advances in Organometallic Chemistry, vol. 51, , p. 53-108 (DOI 10.1016/S0065-3055(03)51002-4, lire en ligne)
- (en) Michael J. Krause, Frank Orlandi, Alfred T. Saurage et Joseph R. Zietz Jr., « Aluminum Compounds, Organic », Ullmann's Encyclopedia of Industrial Chemistry, (DOI 10.1002/14356007.a01_543, lire en ligne)
- (en) Barry M. Trost, Martin F. Semmelhack et Ian Fleming, Comprehensive Organic Synthesis: Additions to and substitutions at C-C[pi]-Bonds, Pergamon, 1992. (ISBN 978-0080405957)
- (en) Ei-ichi Negishi, « 3. Discovery of ZACA reaction − Zr-catalyzed asymmetric carboalumination of alkenes », ARKIVOC, vol. VIII, , p. 34-53 (DOI 10.3998/ark.5550190.0012.803, lire en ligne)
- (en) Ei-ichi Negishi, Guangwei Wang, Honghua Rao et Zhaoqing Xu, « Alkyne Elementometalation−Pd-Catalyzed Cross-Coupling. Toward Synthesis of All Conceivable Types of Acyclic Alkenes in High Yields, Efficiently, Selectively, Economically, and Safely: “Green” Way », The Journal of Organic Chemistry, vol. 75, no 10, , p. 3151-3182 (PMID 20465291, PMCID 2933819, DOI 10.1021/jo1003218, lire en ligne)
- (en) Ei-ichi Negishi, Organometallics In Synthesis: A Manual, M. Schlosser, Wiley, 2002, p. 963-975. (ISBN 978-0471984160)
- (en) Cynthia L. Rand, David E. Van Horn, Mark W. Moore et Eiichi Negishi, « A versatile and selective route to difunctional trisubstituted (E)-alkene synthons via zirconium-catalyzed carboalumination of alkynes », The Journal of Organic Chemistry, vol. 46, no 20, , p. 4093-4096 (DOI 10.1021/jo00333a041, lire en ligne)
- (en) V. P. Yur'ev, A. V. Kuchin et G. A. Tolstikov, « Reaction of aluminum trialkyls with carbon dioxide », Bulletin of the Academy of Sciences of the USSR, Division of chemical science, vol. 23, , p. 817-819 (DOI 10.1007/BF00923507, lire en ligne)
- (de) Karl Ziegler, « Neue Entwicklungen der metallorganischen Synthese », Angewandte Chemie, vol. 68, no 23, , p. 721-729 (DOI 10.1002/ange.19560682302, lire en ligne)
- (en) David W. Marshall pour ConocoPhillips Co, Brevet U.S. 3168570A : Preparation of ketones, déposé le 24 juillet 1961, publié le 2 février 1965, sur Google Patents.
- (en) Werner Uhl et Barun Jana, « A Persistent Alkylaluminum Peroxide: Surprising Stability of a Molecule with Strong Reducing and Oxidizing Functions in Close Proximity », Chemistry, vol. 14, no 10, , p. 3067-3071 (PMID 18283706, DOI 10.1002/chem.200701916, lire en ligne)
| C-H | He | |||||||||||||||||
| C-Li | C-Be | C-B | C-C | C-N | C-O | C-F | Ne | |||||||||||
| C-Na | C-Mg | C-Al | C-Si | C-P | C-S | C-Cl | C-Ar | |||||||||||
| C-K | C-Ca | C-Sc | C-Ti | C-V | C-Cr | C-Mn | C-Fe | C-Co | C-Ni | C-Cu | C-Zn | C-Ga | C-Ge | C-As | C-Se | C-Br | C-Kr | |
| C-Rb | C-Sr | C-Y | C-Zr | C-Nb | C-Mo | C-Tc | C-Ru | C-Rh | C-Pd | C-Ag | C-Cd | C-In | C-Sn | C-Sb | C-Te | C-I | C-Xe | |
| C-Cs | C-Ba | * | C-Lu | C-Hf | C-Ta | C-W | C-Re | C-Os | C-Ir | C-Pt | C-Au | C-Hg | C-Tl | C-Pb | C-Bi | C-Po | C-At | Rn |
| Fr | C-Ra | * * |
Lr | Rf | Db | C-Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
| ↓ | ||||||||||||||||||
| * | C-La | C-Ce | C-Pr | C-Nd | C-Pm | C-Sm | C-Eu | C-Gd | C-Tb | C-Dy | C-Ho | C-Er | C-Tm | C-Yb | ||||
| * * |
Ac | C-Th | C-Pa | C-U | C-Np | C-Pu | C-Am | C-Cm | C-Bk | C-Cf | C-Es | Fm | Md | No | ||||
| Liaison de base en chimie organique | Nombreuses utilisations en chimie |
| Recherche académique, peu d'usages courants | Liaison inconnue / non évaluée |