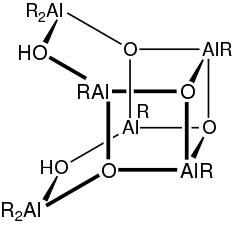
Méthylaluminoxane
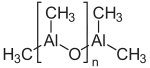
Le méthylaluminoxane, souvent appelé MAO, est un mélange de composés organoaluminiques de formule chimique approximative (Al(CH3)O)n[3]. Il est généralement distribué en solution dans des solvants aromatiques, souvent le toluène mais aussi le xylène, le cumène ou le mésitylène. Utilisé en fort excès, il active des précatalyseurs pour la polymérisation des alcènes[4] - [5]. Il peut être obtenu par hydrolyse incomplète du triméthylaluminium Al2(CH3)6, comme indiqué par l'équation idéalisée[6] :
| Méthylaluminoxane | |||
| |||
| Structure du méthylaluminoxane | |||
| Identification | |||
|---|---|---|---|
| Nom UICPA | méthyl(oxo)alumane | ||
| No CAS | |||
| No ECHA | 100.105.493 | ||
| No CE | 485-360-0 | ||
| SMILES | |||
| InChI | |||
| Apparence | liquide incolore transparent[1] | ||
| Propriétés chimiques | |||
| Formule | CH3AlO |
||
| Masse molaire[2] | 58,015 5 ± 0,001 3 g/mol C 20,7 %, H 5,21 %, Al 46,51 %, O 27,58 %, |
||
| Propriétés physiques | |||
| T° ébullition | 111 °C[1] | ||
| Masse volumique | 0,895 g/cm3[1] à 25 °C | ||
| Point d’éclair | 4 °C[1] | ||
| Limites d’explosivité dans l’air | 1,2 % à 7 % en volume[1] | ||
| Pression de vapeur saturante | 28 hPa[1] à 20 °C | ||
| Précautions | |||
| SGH[1] | |||
    Danger |
|||
| Transport[1] | |||
|
|||
| Unités du SI et CNTP, sauf indication contraire. | |||
Divers mécanismes ont été proposés pour la formation du MAO[7]. Il existe par ailleurs des analogues bien définis de ce composé avec des substituants tert-butyle[8] - [9].
Le MAO est bien connu pour être un activateur de catalyseurs de polymérisation d'alcènes par catalyse homogène. En catalyse de Ziegler-Natta classique, du chlorure de titane(III) TiCl3 activé au triméthylaluminium Al2(CH3)6. Ce dernier n'active que faiblement les précatalyseurs homogènes comme le dichlorure de zirconocène (η5-C5H5)2ZrCl2, mais Walter Kaminsky et al. ont découvert dans le milieu des années 1970 que les dichlorures de métallocènes du groupe 4 sont en revanche très fortement activés par le MAO, en donnant les catalyseurs de Kaminsky[10]. Cet effet a été découvert en versant un petite quantité d'eau sur un système catalytique Ziegler-Natta, qui s'en est trouvé activé.
Le MAO intervient de plusieurs manières dans le processus d'activation. Il intervient dans l'alkylation du chlorure de métal précatalyseur en donnant des intermédiaires méthyle de titane ou de zirconium. Il intervient également en retirant un ligand du précatalyseur méthylé pour donner un catalyseur insaturé électrophile. Ce catalyseur activé est une paire d'ions formée du catalyseur cationique et d'un dérivé anionique du MAO faiblement basique[11]. Le MAO permet également d'éliminer les impuretés protiques.
Notes et références
- Fiche Sigma-Aldrich du composé Methylaluminiumoxane, 10% in Toluene, consultée le 22 juin 2022.
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Eugene You-Xian Chen et Tobin J. Marks, « Cocatalysts for Metal-Catalyzed Olefin Polymerization: Activators, Activation Processes, and Structure−Activity Relationships », Chemical Reviews, vol. 100, no 4, , p. 1391-1434 (PMID 11749269, DOI 10.1021/cr980462j, lire en ligne)
- (en) W. Kaminsky et A. Laban, « Metallocene catalysis », Applied Catalysis A: General, vol. 222, nos 1-2, , p. 47-61 (DOI 10.1016/S0926-860X(01)00829-8, lire en ligne)
- (en) Walter Kaminsky, « Highly active metallocene catalysts for olefin polymerization », Journal of the Chemical Society, Dalton Transactions, no 9, , p. 1413-1418 (DOI 10.1039/a800056e, lire en ligne)
- Ralf-Jürgen Becker, Stefan Gürtzgen et Rolf Schrader pour Chemtura Organometallics GmbH : brevet européen EP0623624A1 « Procédé de préparation d'aluminoxanes », déposé le 11 novembre 1993, publié le 19 août 1998.
- (en) Lacramioara Negureanu, Randall W. Hall, Leslie G. Butler et Larry A. Simeral, « Methyaluminoxane (MAO) Polymerization Mechanism and Kinetic Model from Ab Initio Molecular Dynamics and Electronic Structure Calculations », Journal of the American Chemical Society, vol. 128, no 51, , p. 16816-16826 (PMID 17177432, DOI 10.1021/ja064545q, lire en ligne)
- (en) C. Jeff Harlan, Mark R. Mason et Andrew R. Barron, « tert-Butylaluminum Hydroxides and Oxides: Structural Relationship between Alkylalumoxanes and Alumina Gels », Organometallics, vol. 13, no 8, , p. 2957-2969 (DOI 10.1021/om00020a011, lire en ligne)
- (en) Mark R. Mason, Janna M. Smith, Simon G. Bott et Andrew R. Barron, « Hydrolysis of tri-tert-butylaluminum: the first structural characterization of alkylalumoxanes [(R2Al)2O]n and (RAlO)n », Journal of the American Chemical Society, vol. 115, no 12, , p. 4971-4984 (DOI 10.1021/ja00065a005, lire en ligne)
- (en) Arne Andresen, Hans-Günther Cordes, Jens Herwig, Walter Kaminsky, Alexander Merck, Renke Mottweiler, Joachim Pein, Hansjörg Sinn et Hans-Jürgen Vollmer, « Halogen-Free Soluble Ziegler Catalysts for the Polymerization of Ethylene. Control of Molecular Weight by Choice of Temperature », Angewandte Chemine International Edition, vol. 15, no 10, , p. 630-632 (DOI 10.1002/anie.197606301, lire en ligne)
- (en) Hansjörg Sinn, Walter Kaminsky, Hans-Jürgen Vollmer et Rüdiger Woldt, « “Living Polymers” on Polymerization with Extremely Productive Ziegler Catalysts », Angewandte Chemie International Edition, vol. 19, no 5, , p. 390-392 (DOI 10.1002/anie.198003901, lire en ligne)