Diéthylzinc
Le diéthylzinc, parfois abrégé en DEZn en anglais scientifique, est un corps organozincique hautement pyrophorique, caractérisé par une molécule constituée d'un centre de zinc divalent lié à deux groupes éthyles étalés en deux "aile mobiles" à température ambiante, de formule Zn(C2H5)2.
| Diéthyzinc | |
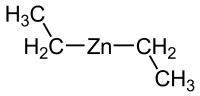
| |
| Identification | |
|---|---|
| Synonymes |
Zincdiéthyle, DEZ, Et2Zn, DEZn, autrefois zinc-éthyl |
| No CAS | |
| No ECHA | 100.008.330 |
| No CE | 209-161-3 |
| PubChem | 11185 |
| SMILES | |
| InChI | |
| Apparence | liquide incolore, odeur désagréable[1] |
| Propriétés chimiques | |
| Formule | C4H10Zn |
| Masse molaire[2] | 123,5 ± 0,02 g/mol C 38,9 %, H 8,16 %, Zn 52,95 %, |
| Propriétés physiques | |
| T° fusion | −28 °C[1] |
| T° ébullition | 118 °C[1] |
| Solubilité | 4,140 g·l-1 (eau, 25 °C)[3] |
| Masse volumique | 1,206 5 g·cm-3 (20 °C[1] |
| Point d’éclair | −40 °C[1] −18 °C (coupelle fermée)[4] |
| Pression de vapeur saturante | 27,7 mbar (25 °C) 3 mbar (30 °C) 92 mbar (50 °C)[1] |
| Cristallographie | |
| Système cristallin | tétragonal centré |
| Propriétés optiques | |
| Indice de réfraction | 1,498[4] |
| Précautions | |
| SGH[1] - [4] | |
   |
|
| NFPA 704[4] | |
| Transport | |
| Écotoxicologie | |
| LogP | 1,610[3] |
| Unités du SI et CNTP, sauf indication contraire. | |
Il se présente sous la forme d'un liquide mobile et incolore, à l'odeur désagréable, bouillant à 118 °C et s'enflammant à l'air spontanément. C'est un important réactif, un précieux agent de synthèse ou d'éthylation, en chimie organique. Il est disponible dans le commerce, par exemple vendu en solution stabilisée dans l'hexane, l'heptane ou le toluène
Synthèse ou préparation
Il est obtenu au laboratoire par exemple de façon ancienne par l'action du zinc sur l'iodure d'éthyle ou iodoéthane en présence de sodium métal.
Le chimiste anglais Edward Frankland a le premier synthétisé les premiers composés organo-zinciques en 1848, en particulier le "iodure d'éthylzinc" à partir de zinc et d'iodure d'éthyle, puis par distillation de ce produit le diéthylzinc, en inventant au passage des techniques de synthèse à reflux ou de distillation en atmosphère inerte. Il s'agit du premier corps organozincique purifié découvert[5] - [6]. Il améliora par la suite la synthèse en utilisant du diéthylmercure comme réactif initial[7].
Le principe réactionnel, par ailleurs le même pour de nombreux métaux comme le Bi, exige un chauffage au reflux en présence de métaux alcalins :
- Zn corps simple métal + 2 C2H5I "iodure alcoolique" → Zn(C2H5)2 corps séparé par distillation + ZnI2 iodure de zinc avec les autres sels métalliques anhydres des métaux présents
En pratique, le chimiste chauffait au bain-marie dans un ballon bien sec, par exemple un mélange de 75 parties massiques de zinc anhydre en grenaille pour 100 parties d'iodure d'éthyle, avec 7 parties massiques d'alliage ZnNa. Le réacteur est muni d'un réfrigérant ascendant et le milieu réactionnel est un milieu inerte ultra-pur purifié grâce aux techniques du vide.
Une synthèse contemporaine, rapide et efficace, consiste en la réaction d'un mélange 1:1 d'iodoéthane et de bromoéthane avec un alliage cuivre-zinc, source de zinc[8].
Propriétés physiques et chimiques, toxicologie
Ce liquide incolore de densité de l'ordre de 1,18 à 1,2 est mobile, réfringent. Il est très réactif à l'air, libérant des fumées blanches d'oxyde de zinc, et surtout il se décompose avec dégagement de lumière en présence de gaz oxygène, de corps halogènes gazeux, comme le chlore, le brome ou l'iode.
Le diéthylzinc C2H5)2Zn est un liquide pyrophorique c'est-à-dire spontanément inflammable[1]. Il peut en effet réagir dans l'air à température ambiante, même sans apport d'énergie initiale, puis s'échauffer et s'enflammer et brûler avec une flamme bleue. Il peut aussi s'enflammer spontanément s'il est placé dans un milieu à base de dioxyde de carbone. En contact avec l'eau, il réagit violemment, il relâche rapidement des gaz inflammables qui s'enflamment spontanément.
La molécule de diéthylzinc en milieu inerte se décompose au-dessus de 200 °C, libérant essentiellement du gaz éthane, du zinc métal (poudre de zinc) et d'autres hydrocarbures à faible masse moléculaire, résultat de réactions radicalaires.
Le diéthylzinc conservé en milieu anhydre et inerte permettait au laboratoire d'obtenir d'autres corps métaux-diéthyles, comme le mercure-éthyl et le silicium-éthyl, par simples réactions de déplacement.
- Zn(C2H5)2 zinc-éthyl + HgCl2chlorure mercurique → Hg(C2H5)2 mercure éthylé + ZnCl2 chlorure de zinc
- Zn(C2H5)2 zinc-éthyl + SiCl2chlorure de silicium → Si(C2H5)2 silicium éthylé + ZnCl2 chlorure de zinc
Sécurité, toxicologie
Sa manipulation efficace requiert la maîtrise des diverses techniques en atmosphère inerte. Outre l'auto-inflammation avec l'air ou l'oxygène, le corps diéthylzinc présente un risque d'explosion en contact avec les oxydants forts, mais aussi les alcènes en présence de diiodométhane et le dioxyde de soufre. Il réagit dangereusement avec les halogènes, les agents oxydants triviaux, l'eau, le trichlorure d'arsenic, l'hydrazine, le méthanol et les composés nitro.
Il présente des risques la santé, de façon aiguë ou chronique. Il est dangereux pour la vie aquatique.
Structure cristalline à l'état solide
Le diéthylzinc pur cristallise en dessous de −28 °C dans un système cristallin tétragonal, à réseau de Bravais à symétrie tétragonale centrée et de groupe d'espace I41md. À l'état solide, le diéthylzinc présente des centres Zn presque linéaires. La longueur de liaison Zn-C est de 194,8 ± 0,5 pm, et l'angle de liaison C-Zn-C est légèrement plié à 176,2(4)°[9]. La structure en phase gazeuse présente une distance Zn-C presque similaire (195,0(2) pm)[10].
Utilisations
Agent de synthèse en chimie
Malgré le danger de sa nature hautement pyrophorique, le diéthylzinc est un important réactif chimique. Il est utilisé en synthèse organique comme source de carbanion éthyle dans les réactions d'additions sur les groupes carbonyle, par exemple l'addition asymétrique d'un groupe éthyle sur le benzaldéhyde[11] and imines[12].
Il est également couramment utilisé en association avec le diiodométhane dans le réarrangement de Simmons-Smith, pour convertir les alcènes en groupes cyclopropyle[13] - [14].
Il est moins nucléophile que les organolithiens ou les réactifs de Grignard proches, il peut donc être utilisé comme nucléophile plus « doux » si besoin.
Source de zinc métal
Il est aussi utilisé de façon extensive en chimie des matériaux comme une source en zinc dans la synthèse de nanoparticules de zinc ou encore de dépôts en microélectronique (dopant potentiel) ou dans la lutte anti-corrosion d'installations spécifiques.
Comme le zinc réagit avec le soufre, on le retrouve en particulier pour la formation de coquille de sulfure de zinc pour les boîtes quantiques de type coquille/noyau[15].
Source de radicaux éthyles... ou de cations
En chimie des polymères, il est peut-être utilisé partiellement comme catalyseur pour la polymérisation à navette de chaîne (en)[16].
Autres
L'utilisation du diéthylzinc n'est pas limitée à la chimie organique ou la synthèse chimique. Du fait de sa grande réactivité dans l'air, il est utilisé en petites quantités comme hypergolique ou liquide à « auto-inflammation » pour carburant pour fusée — il s'allume en contact avec un oxydant, ainsi le moteur de la fusée a seulement besoin d'une pompe, sans besoin d'une étincelle pour l'allumage.
Le diéhylzinc a aussi fait l'objet de recherches par la Bibliothèque du Congrès des États-Unis comme moyen de désacidification de masse de livres imprimés sur du papier à base de pâte de bois. Les vapeurs de diéthylzinc neutraliseraient en théorie les résidus acides dans le papier, laissant des résidus légèrement alcalins d'oxyde de zinc. Si les premiers résultats furent encourageants, le projet fut finalement abandonné, la méthode posant de nombreux problèmes. Le plus gênant fut sans doute que le prototype final ait souffert d'une série d'explosions résultant du contact entre des quantités infimes de diéthylzinc et de vapeur d'eau dans la chambre de test[17].
Notes et références
- Entrée « Diethylzinc » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 22 juin 2013 (JavaScript nécessaire)
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) « Diéthylzinc », sur ChemIDplus, consulté le 22 juin 2013.
- Fiche Sigma-Aldrich du composé Diethylzinc, consultée le 22 juin 2013.
- E. Frankland, « On the isolation of the organic radicals », Quarterly Journal of the Chemical Society, vol. 2, no 3, , p. 263 (DOI 10.1039/QJ8500200263)
- Dietmar Seyferth, « Zinc Alkyls, Edward Frankland, and the Beginnings of Main-Group Organometallic Chemistry », Organometallics, vol. 20, , p. 2940–2955 (DOI 10.1021/om010439f)
- E. Frankland et B. F. Duppa, « On a new reaction for the production of the zinc-compounds of the alkyl-radical », Journal of the Chemical Society, vol. 17, , p. 29–36 (DOI 10.1039/JS8641700029)
- C. R. Noller, Diethyl Zinc, Org. Synth., coll. « vol. 2 », , p. 184
- John Bacsa, Felix Hanke, Sarah Hindley, Rajesh Odedra, George R. Darling, Anthony C. Jones et Alexander Steiner, « The Solid State Structures of Dimethylzinc and Diethylzinc », Angewandte Chemie International Edition, vol. 50, , p. 11685–11687 (DOI 10.1002/anie.201105099)
- A. Haaland, J. C. Green, G. S. McGrady, A. J. Downs, E. Gullo, M. J. Lyall, J. Timberlake, A. V. Tutukin, H. V. Volden et K.-A. Østby, « The length, strength and polarity of metal–carbon bonds: dialkylzinc compounds studied by density functional theory calculations, gas electron diffraction and photoelectron spectroscopy », Dalton Transactions, , p. 4356–4366 (DOI 10.1039/B306840B)
- Masato Kitamura, Hiromasa Oka, Seiji Suga, and Ryōji Noyori, Catalytic Enantioselective Addition of Dialkylzincs to Aldehydes Using (2S)-(−)-3-exo-(Dimethylamino)isoborneol [(2S)-DAIB]: (S)-1-Phenyl-1-propanol, Org. Synth., coll. « vol. 10 », , p. 635
- Jean-Nicolas Desrosiers, Alexandre Côté, Alessandro A. Boezio, and André B. Charette, Preparation of Enantiomerically Enriched (1S)-1-Phenylpropan-1-amine Hydrochloride by a Catalytic Addition of Diorganozinc Reagents to Imines, Org. Synth. 83, coll. « vol. », , 5 p.
- André B. Charette and Hélène Lebel, (2S,3S)-(+)-(3-Phenylcyclopropyl)methanol, Org. Synth., coll. « vol. 10 », , p. 613
- Yoshihiko Ito, Shotaro Fujii, Masashi Nakatuska, Fumio Kawamoto, and Takeo Saegusa, One-Carbon Ring Expansion of Cycloalkanones to Conjugated Cycloalkenones: 2-Cyclohepten-1-one, Org. Synth., coll. « vol. 6 », , p. 327
- Dmitri V. Talapin, Ivo Mekis, Stephan Götzinger, Andreas Kornowski, Oliver Benson, and Horst Weller†, « CdSe/CdS/ZnS and CdSe/ZnSe/ZnS Core−Shell−Shell Nanocrystals », Journal of Physical Chemistry B, vol. 108, no 49, , p. 18826–18831 (DOI 10.1021/jp046481g)
- Mitsuo Sawamoto, Chihiro Okamoto et Toshinobu Higashimura, « Hydrogen iodide/zinc iodide: a new initiating system for living cationic polymerization of vinyl ethers at room temperature », Macromolecules, vol. 20, no 11, , p. 2693–2697 (DOI 10.1021/ma00177a010)
- Kenneth E. Harris et Chandru J. Shahani, Mass Deacidification: An Initiative To Refine The Diethyl Zinc Process, Washington, D.C., Library of Congress, (lire en ligne).
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Diethylzinc » (voir la liste des auteurs).
Bibliographie
- G. Dupuis, Introduction à la chimie des composés organométalliques, en particulier passage sur "organozincique et dialkylzincique", Cours du lycée Faidherbe de Lille en ligne



