Acétate de zinc
L'acétate de zinc est un composé chimique de formule Zn[OOCCH3]2 ayant souvent la structure d'un dihydrate Zn[OOCCH3]2·2H2O. Anhydre ou hydratée, l'acétate se présente sous l'aspect d'un solide blanc faiblement odorant et les deux formes sont utilisées en synthèse chimique et comme compléments alimentaires. Il est produit par action de l'acide acétique CH3COOH sur du carbonate de zinc ZnCO3 (smithsonite) ou du zinc élémentaire (métallique).
| Acétate de zinc | |
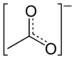 Structure de l'acétate de zinc |
|
| Identification | |
|---|---|
| Nom UICPA | diacétate de zinc |
| Synonymes |
dicarbométhoxyzinc |
| No CAS | (anhydre) (dihydrate) |
| No ECHA | 100.008.338 |
| No CE | 209-170-2 |
| PubChem | 11192 |
| ChEBI | 62984 |
| No E | E650 |
| SMILES | |
| InChI | |
| Apparence | solide cristallisé blanc à faible odeur acétique |
| Propriétés chimiques | |
| Formule | C4H6O4Zn |
| Masse molaire[1] | 183,47 ± 0,02 g/mol C 26,19 %, H 3,3 %, O 34,88 %, Zn 35,64 %, |
| Propriétés physiques | |
| T° fusion | 237 °C[2] (décomposition; le dihydrate perd son eau à 100 °C) |
| Solubilité | 430 g·L-1[2] |
| Masse volumique | 1,84 g·cm-3[2] (anhydre) 1,735 g·cm-3[2] (dihydrate) |
| Précautions | |
| SGH[2] | |
  Attention |
|
| Transport[2] | |
| Unités du SI et CNTP, sauf indication contraire. | |
Les deux atomes d'oxygène du groupe acétate peuvent se lier à des ions métalliques de plusieurs façons et par plusieurs types de liaison. L'acétate de zinc anhydre adopte une structure polymérique dans laquelle l'atome de zinc est coordonné à quatre atomes d'oxygène selon une géométrie tétraédrique, chacun de ces tétraèdres étant lié à ses voisins par les groupes acétate.
Les ligands acétate ne sont pas bidentates. A contrario, la plupart des diacétates métalliques présentent des atomes métalliques en coordination octaédrique avec des groupes acétate bidentates. Dans le dihydrate d'acétate de zinc, l'atome de zinc est octaédrique, et les deux groupes acétate sont bidentates[3].
L'acétate de zinc est utilisé pour réduire l'absorption intestinale de cuivre dans la maladie de Wilson.
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Entrée « Zinc acetate » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 24 janvier 2013 (JavaScript nécessaire)
- (en) J. N. van Niekerk, F. R. L. Schoening et J. H. Talbot, « The crystal structure of zinc acetate dihydrate, Zn(CH3COO)2.2H2O », Acta Crystallographica, vol. 6, nos 8-9, , p. 720-723 (lire en ligne) DOI 10.1107/S0365110X53002015