Phosphure de zinc
Le phosphure de zinc (Zn3P2) est un composé chimique minéral ou inorganique. Il est utilisé comme rodenticide et fait l'objet de recherches pour des applications dans l'énergie solaire photovoltaïque. Il est l'un des deux composés dans le système zinc-phosphore, l'autre étant le diphosphure de zinc (ZnP2).
| Phosphure de zinc | |||
| |||
| Identification | |||
|---|---|---|---|
| Nom UICPA | Phosphure de zinc | ||
| No CAS | |||
| No ECHA | 100.013.859 | ||
| No CE | 215-244-5 | ||
| PubChem | 25113606 | ||
| SMILES | |||
| InChI | |||
| Apparence | cristaux, poudre gris acier ou pâte gris foncé, d'odeur caractéristique[1]. | ||
| Propriétés chimiques | |||
| Formule | Zn3P2 | ||
| Masse molaire[2] | 258,09 ± 0,06 g/mol P 24 %, Zn 76,01 %, |
||
| Propriétés physiques | |||
| T° fusion | 1 160 °C[3] | ||
| Solubilité | Dans l'eau : nulle, décomposition lente[1], insoluble dans l'alcool, soluble avec réaction dans les acides dilués, l'acide nitrique, etc. | ||
| Masse volumique | 4,61 g·cm-3 | ||
| Propriétés électroniques | |||
| Bande interdite | Direct: ~1,50 eV[4] Indirect (controversé): ~1,3 eV[5] |
||
| Cristallographie | |||
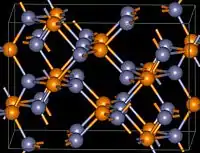
| Système cristallin | tétragonal | ||
| Réseau de Bravais | tP | ||
| Classe cristalline ou groupe d’espace | 4/mmm | ||
| Notation Schönflies | D15 4h (intl. P42/nmc) |
||
| Paramètres de maille | a = 0,807 85 nm c = 1,139 66 nm[6] |
||
| Précautions | |||
| SGH[7] | |||
   Danger |
|||
| Transport[8] | |||
|
|||
| Écotoxicologie | |||
| DL50 | 23,7 mg/kg (oiseau sauvage, oral)[8] 37,5 mg/kg (canard, oral)[8] 40 mg/kg (souris, oral)[8] 12 mg/kg (rat, oral)[8] 263 mg/kg (souris, i.p.)[8] 450 mg/kg (rat, i.p.)[8] |
||
| Unités du SI et CNTP, sauf indication contraire. | |||
Propriétés physiques et chimiques
Il s'agit d'un corps solide gris acier. Sa structure cristalline se transforme d'une structure tétragonale, stable à basse température, en une structure cubique aux alentours de 850 °C[3].
Il se décompose lentement dans l'eau pure, sans être soluble. Le phosphure de zinc réagit avec l'eau pour former de la phosphine (PH3) et de l'hydroxyde de zinc (Zn(OH)2):
- Zn3P2 + 6 H2O → 2 PH3 + 3 Zn(OH)2
Il est soluble dans les acides dilués et l'acide nitrique, mais insoluble dans l'éthanol.
Le phosphure de zinc se décompose dans l'acide sulfurique en sulfate de zinc solubilisé et en gaz phosphine PH3. Il se décompose sous un flux de gaz dihydrogène.
Préparation
Le phosphure de zinc Zn3P2 peut être préparé par réaction directe du zinc avec le phosphore :
- 3 Zn + 2 P → Zn3P2
Sécurité et toxicité
Les substances qui ne doivent pas entrer en contact avec le phosphure de zinc sont les acides, l'eau, le dioxyde de carbone (CO2) et les oxydants forts. Il peut être mortel en cas d'ingestion car il réagit avec les acides gastriques dans l'estomac et pour former du gaz phosphine.
Usages
Historique
Le phosphure de zinc, dans sa forme polymorphique tétragonale α-Zn3P2, stable à température ambiante, a été considéré pour des applications dans le photovoltaïque depuis les années 1950[9]. Le record d'efficacité énergétique de conversion de cellules solaires à base de ce matériau a été atteint en 1981 et reste encore imbattu à ce jour[10]. La cellule record, avec une efficacité de seulement 6%[11], a longtemps été considérée comme constituée d'une jonction Schottky (en) entre du magnésium et du phosphure de zinc. Elle était en réalité constituée d'une jonction Mg / Mg(MgxZn1-x)2P2 / Zn3P2 non intentionnelle[12].
Présentation
La recherche sur le phosphure de zinc dans des applications photovoltaïques est conduite par ses propriétés qui en font potentiellement un bon matériau absorbeur pour des cellules solaires et par l'abondance de ses éléments constituants dans la croûte terrestre[10]. Ses propriétés qui en font un bon candidat sont sa bande interdite directe de 1,5 eV[4], une forte absorption de la lumière visible[13] et une grande longueur de diffusion des porteurs de charge minoritaires[14].
L'une des raisons principales pour la faible efficacité de la cellule record (6%), comparée à l'efficacité maximum théorique de près de 30%, est une densité de défauts électroniques aux interfaces systématiquement élevée[15].
Présentation
Les phosphures de métal sont utilisés comme rodenticides. Un mélange d'aliment et de phosphure de zinc est laissé où les rongeurs peuvent le manger. L'acide de leur système digestif réagit avec le phosphure en générant un gaz toxique, la phosphine. Cette méthode de contrôle des Muridés est utilisable dans le cas de rongeurs immunisés à la plupart des poisons communs. Les autres rodenticides similaires au phosphure de zinc sont le phosphure d'aluminium et le phosphure de calcium. Il est notamment utilisé dans la lutte contre les nuisibles Campagnol des champs, Campagnol agreste et Campagnol rousseâtre.
Le phosphure de zinc est typiquement additionné aux appâts pour rongeurs dans une quantité de 0,75 - 2 % en masse. Les appâts ont une odeur forte âcre ressemblant celle de l'ail caractéristique de phosphines, dimérisée ou substituée, libérée par hydrolyse. Cette odeur attire les rongeurs mais a un effet répulsif sur d'autres animaux. En revanche les oiseaux, spécialement les dindons, n'ont pas l'odorat sensible à cette odeur. Les appâts contiennent suffisamment de phosphure de zinc dans une nourriture suffisamment attractive pour pouvoir tuer les rongeurs en une seule fois, une dose non létale pouvant causer une aversion future au phosphure de zinc chez les rongeurs survivants.
Le phosphure de zinc de grade rodenticide est habituellement une poudre noire contenant 75 % de Zn3P2 et 25 % de tartrate d'antimoine et de potassium, un émétique qui provoque le vomissement du produit s'il est accidentellement ingéré par des humains ou des animaux domestiques. Il reste efficace contre les rats, les souris, les cochons d'Inde, cobayes et les lapins, ceux qui n'ont pas le réflexe de vomir[16].
Il s'agissait autrefois d'un mode (radical et toxique) d'administration du phosphore en agriculture.
Commercialisation
En Europe, le phosphure de zinc est notamment commercialisé sous les noms « Ratron GL » et « Ratron GW », une autorisation de mise sur le marché détenue par le laboratoire Allemand fabricant de pesticides Frunol delicia. Réservé aux agriculteurs professionnels munis de certificat d'utilisation, le « Ratron GW » qui contient 2,5% de phosphure de zinc semble montrer des résultats intéressants. Cependant, il est très toxique pour les organismes aquatiques, entraîne des effets néfastes à long terme (H410), est nocif en cas d'ingestion (H302) et peut en cas de mauvaise utilisation être toxique pour l'opérateur et l'environnement (H401)[17] - [18]. Aussi, des associations environnementales comme l'ASPAS alertent sur la destruction consécutive des prédateurs naturels des rongeurs ciblés[19].
Face à la pullulation de Rat taupier dans certains massifs montagneux comme le Jura et le Massif central et en raison de l'interdiction de la bromadiolone en décembre 2020, de nombreux agriculteurs utilisent ces nouveaux produits depuis l'été et l'automne de cette même année, la coordination locale étant menée par les Groupements de Défense contre les Organismes Nuisibles[18]. La mise en place du produit est manuelle et ne doit pas dépasser 2kg/ha/an, mais nombreux sont ceux qui demandent une dérogation pour sa mécanisation[18] - [19].
Références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Zinc phosphide » (voir la liste des auteurs).
- PHOSPHURE DE ZINC, Fiches internationales de sécurité chimique
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Ghasemi, M., Stutz, E. Z., Escobar Steinvall, S., Zamani, M. et Fontcuberta i Morral, A., « Thermodynamic re-assessment of the Zn-P binary system », Materialia, Elsevier Ltd, vol. 6, , p. 100301 (DOI 10.1016/j.mtla.2019.100301)
- (en) Kimball, G. M., Müller, A. M., Lewis, N. S. et Atwater, H. A., « Photoluminescence-based measurements of the energy gap and diffusion length of Zn3P2 », Applied Physics Letters, vol. 95, no 11, , p. 112103 (DOI 10.1063/1.3225151)
- (en) Pawlikowski, J. M., Misiewicz, J. et Mirowska, N., « Direct and indirect Optical Transitions in Zn3P2 », Journal of Physics and Chemistry of Solids, vol. 40, , p. 1027-1033
- (en) Zanin, I. E., Aleinikova, K. B., Afanasiev, M. M. et Antipin, M. Y., « Structure of Zn3P2 », Journal of Structural Chemistry, vol. 45, no 5, , p. 844-848
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- (en) « Phosphure de zinc », sur ChemIDplus.
- Lagrenaudie, J., « Propriétés du phosphure de zinc P2Zn3 en cristaux », Journal de Physique et le Radium, vol. 16, no 3, , p. 234-235 (DOI 10.1051/jphysrad:01955001603023401)
- (en) Paul, R., Humblot, N., Escobar Steinvall, S., Stutz, E. Z., Joglekar, S. S., Leran, J.-B., Zamani, M., Cayron, C., Logé, R., Granados del Aguila, A., Xiong, Q. et Fontcuberta i Morral, A., « van der Waals Epitaxy of Earth-Abundant Zn3P2 on Graphene for Photovoltaics », Crystal Growth and Design, vol. 20, no 6, , p. 3816-3825 (DOI 10.1021/acs.cgd.0c00125)
- (en) Bhushan, M. et Catalano, A., « Polycrystalline Zn3P2 Schottky barrier solar cells », Applied Physics Letters, vol. 38, no 1, , p. 39-41 (DOI 10.1063/1.92124)
- (en) Katsube, R., Kazumi, K., Tadokoro, T. et Nose, Y., « Reactive Epitaxial Formation of a Mg–P–Zn Ternary Semiconductor in Mg/Zn3P2 Solar Cells », ACS Applied Materials & Interfaces, (DOI 10.1021/acsami.8b11423)
- (en) Fagen, E. A., « Optical properties of Zn3P2 », Journal of Applied Physics, vol. 50, no 10, , p. 6505-6515 (DOI 10.1063/1.325746)
- (en) Convers Wyeth, N. et Catalano, A., « Spectral response measurements of minority-carrier diffusion length in Zn3P2 », Journal of Applied Physics, vol. 50, no 3, , p. 1403-1407 (DOI 10.1063/1.326122)
- (en) Nayar, P. S. et Catalano, A., « Zinc phosphide-zinc oxide heterojunction solar cells », Applied Physics Letters, vol. 39, no 1, , p. 105-107 (DOI 10.1063/1.92537)
- (en) l'absence du réflexe de vomir chez le rat
- ARMOSA SAS (distributeur de produits phytosanitaires), « Plaquette de présentation commerciale du RATRON® GW », sur aedes.fr (consulté le )
- Sandrine Laffont, « Campagnols terrestres, le Phosphure de zinc prend le relais », Auvergne Agricole, (lire en ligne, consulté le )
- Rédaction, « Campagnols dans le Mézenc : une dérogation demandée pour mécaniser l'usage d'un raticide », sur la Commère 43, jeudi, 11 mars 2021 (consulté le )

