Fluorure de zinc
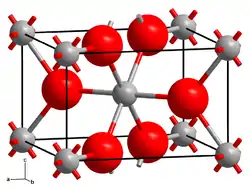
Le fluorure de zinc est un composé chimique de formule ZnF2 cristallisé dans le système réticulaire tétragonal avec une structure cristalline de type rutile, dans le groupe d'espace P42/mnm (no 136) avec six atomes de zinc coordonnés. Ses liaisons sont fortement ioniques mais le solide est faiblement soluble dans l'eau, contrairement aux autres halogénures de zinc[3], chlorure de zinc ZnCl2, bromure de zinc ZnBr2 et iodure de zinc ZnI2. Il forme l'hydroxyfluorure de zinc Zn(OH)F par hydrolyse dans l'eau chaude[4]. On le trouve souvent sous forme de tétrahydrate ZnF2·4H2O, rhomboédrique[5].
| Fluorure de zinc | |
| |
| Maille cristalline du fluorure de zinc __ Zn2+ __ F− |
|
| Identification | |
|---|---|
| No CAS | (tétrahydrate) |
| No ECHA | 100.029.092 |
| No CE | 232-001-9 |
| No RTECS | ZH3500000 |
| PubChem | 10129912 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | ZnF2 |
| Masse molaire[1] | 103,38 ± 0,02 g/mol F 36,75 %, Zn 63,26 %, |
| Propriétés physiques | |
| T° fusion | 872 °C[2] |
| T° ébullition | 1 500 °C[2] |
| Solubilité | 16,2 g·L-1[2] à 25 °C |
| Masse volumique | 4,95 g·cm-3[2] à 20 °C |
| Précautions | |
| SGH[2] | |
  Danger |
|
| Unités du SI et CNTP, sauf indication contraire. | |
On peut obtenir du fluorure de zinc par réaction directe du zinc avec du fluor F2 ou par réaction du fluorure d'hydrogène sur le zinc avec libération d'hydrogène H2[3]. Il est également possible de former du fluorure de zinc à partir de carbonate de zinc ZnCO3 :
Le fluorure de zinc peut être utilisé dans des traitements conservateurs des bois et pour préparer d'autres composés fluorés tels que le trifluorure de phosphore (en) PF3.
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- « Fiche du composé Zinc fluoride, Puratronic®, 99.995% (metals basis) », sur Alfa Aesar (consulté le ).
- (en) Norman N. Greenwood et A. Earnshaw, Chemistry of the Elements, 2e édition, Butterworth-Heinemann, Oxford, 1997. (ISBN 0-7506-3365-4)
- (en) O. K. Srivastava et E. A. Secco, « Studies on metal hydroxy compounds. I. Thermal analyses of zinc derivatives ϵ-Zn(OH)2, Zn5(OH)8Cl2.H2O, β-ZnOHCl, and ZnOHF », Revue canadienne de chimie, vol. 45, no 6, , p. 579-583 (DOI 10.1139/v67-096, lire en ligne)
- (en) D. L. Perry et S. L. Phillips, Handbook of Inorganic Compounds, CRC Press, 1995. (ISBN 0-8493-8671-3)