Pile Bichromate
La Pile Bichromate est une pile électrique. Elle consistait en une anode de zinc dans une solution d'acide sulfurique dilué, et une cathode de carbone dans une solution acidifiée de dichromate de potassium. L'ancien nom du dichromate de potassium était bichromate de potassium. La pile a été réalisée sous deux formes - du type à fluide unique, attribuée à Poggendorff et du type à deux fluides, attribuée à Fuller. Dans les deux cas, la tension de pile était de 2 volts[1].
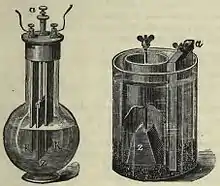
Pile Poggendorff
La pile était mise en place dans une bouteille en verre à goulot long avec une plaque de zinc située entre deux plaques de carbone. L'électrolyte et l'oxydant étaient mélangés. Le mélange dissolvait la plaque de zinc, même lorsque la pile n'était pas utilisée, il y avait donc un mécanisme de retrait de la plaque de zinc du liquide et de mise à l'abri dans le goulot de la bouteille.
_(14776920973).jpg.webp) Batterie de 6 piles Radiguet et Massiot au bichromate (vers 1900)
Batterie de 6 piles Radiguet et Massiot au bichromate (vers 1900)
Pile Fuller
La pile était mise en place dans un pot de verre contenant la solution acidifiée de dichromate de potassium, la plaque de carbone et un pot poreux. Le pot poreux contenait de l'acide sulfurique dilué et la plaque de zinc.
Détails
La tension électrique de la Pile Bichromate est de 2 volts et provient de la réaction suivante[2] :
- 3Zn + 7H2SO4 + K2Cr2O7 → 3ZnSO4 + K2SO4 + Cr2(SO4)3 + 7H2O
Notes et références
- Ayrton, W.E. and Mather, T. Practical Electricity, Cassell et Cie, London, 1911, p. 185-187
- https://drc.libraries.uc.edu/bitstream/handle/2374.UC/731651/The_Dichromate_Cell.pdf?sequence=1