Nitrate de zinc
Il peut se produire une réaction exothermique avec le cuivre, les sulfures métalliques, le phosphore ou le soufre. Mélangé avec des combustibles, il peut exploser. Utilisé comme mordant.
2_dans_eau.png.webp)
Solubilité dans l'eau
| Nitrate de zinc anhydre | |
| |
| Identification | |
|---|---|
| Synonymes |
Dinitrate de zinc |
| No CAS | |
| No ECHA | 100.029.038 |
| No CE | 231-943-8 |
| PubChem | 24518 |
| SMILES | |
| InChI | |
| Apparence | cristaux incolores[1]., ou poudre blanche |
| Propriétés chimiques | |
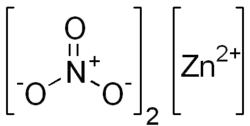
| Formule | Zn(NO3)2 |
| Masse molaire[2] | 189,39 ± 0,02 g/mol N 14,79 %, O 50,69 %, Zn 34,53 %, |
| Propriétés physiques | |
| T° fusion | ca. 110 °C[1] |
| Solubilité | dans l'eau : bonne[1] |
| Masse volumique | 2,07 g·cm-3 (hexahydrate)[1] |
| Précautions | |
| SIMDUT[3] | |
  C, D2B, |
|
| Directive 67/548/EEC | |
 Xn  O |
|
| Unités du SI et CNTP, sauf indication contraire. | |
| Nitrate de zinc tétrahydraté | |
| Identification | |
|---|---|
| No CAS | |
| No ECHA | 100.029.038 |
| Propriétés chimiques | |
| Formule | Zn(NO3)2,4H2O |
| Masse molaire | 261.466627 |
| Propriétés physiques | |
| T° fusion | 45 °C |
| Masse volumique | ≈1 000 kg·m-3 |
| Unités du SI et CNTP, sauf indication contraire. | |
| Nitrate de zinc hexahydraté | |
| Identification | |
|---|---|
| No CAS | |
| No ECHA | 100.029.038 |
| Apparence | cristaux incolores inodores |
| Propriétés chimiques | |
| Formule | Zn(NO3)2,6H2O |
| Masse molaire | 297.497200 |
| Propriétés physiques | |
| T° fusion | déc 36,4 °C |
| T° ébullition | déshydratation 105 à 131 °C |
| Solubilité | 1 843 g·l-1 eau à 20 °C. Librement sol dans l'alcool. |
| Masse volumique | 2,065 g·cm-3 à 14 °C |
| Unités du SI et CNTP, sauf indication contraire. | |
Notes et références
- NITRATE DE ZINC, Fiches internationales de sécurité chimique
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- « Nitrate de zinc » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 23 avril 2009
Voir aussi
Bibliographie
- Al-Baldawi, S. A., Brooker, M. H., Gough, T. E., & Irish, D. E. (1970). Raman, infrared, and proton magnetic resonance investigation of solutions of zinc nitrate in anhydrous methanol. Canadian Journal of Chemistry, 48(8), 1202-1208 (résumé).
- Bacaksiz, E., Parlak, M., Tomakin, M., Özçelik, A., Karakız, M., & Altunbaş, M. (2008). The effects of zinc nitrate, zinc acetate and zinc chloride precursors on investigation of structural and optical properties of ZnO thin films. Journal of Alloys and Compounds, 466(1), 447-450 (résumé).
- Chen, Q. P., Xue, M. Z., Sheng, Q. R., Liu, Y. G., & Ma, Z. F. (2006). Electrochemical growth of nanopillar zinc oxide films by applying a low concentration of zinc nitrate precursor. Electrochemical and solid-state letters, 9(3), C58-C61 (résumé).
- Dagnall, S. P., Hague, D. N., & Towl, A. D. (1982). X-ray diffraction study of aqueous zinc (II) nitrate. Journal of the Chemical Society, Faraday Transactions 2: Molecular and Chemical Physics, 78(12), 2161-2167.
- Hester, R. E., & Scaife, C. W. J. (1967). Vibrational Spectra of Molten Salts. III. Infrared and Raman Spectra of Variably Hydrated Zinc Nitrate. The Journal of Chemical Physics, 47(12), 5253-5258 (résumé).
- Ishizaki, H., Imaizumi, M., Matsuda, S., Izaki, M., & Ito, T. (2002). Incorporation of boron in ZnO film from an aqueous solution containing zinc nitrate and dimethylamine-borane by electrochemical reaction. Thin Solid Films, 411(1), 65-68 (résumé).
- Jiang, Q., Wu, Z. Y., Wang, Y. M., Cao, Y., Zhou, C. F., & Zhu, J. H. (2006). Fabrication of photoluminescent ZnO/SBA-15 through directly dispersing zinc nitrate into the as-prepared mesoporous silica occluded with template. Journal of Materials Chemistry, 16(16), 1536-1542 (résumé).
- Kimura, M. (1977). Trace enrichment with activated carbon and determination of trace metals in high-purity zinc and zinc (II) nitrate. Talanta, 24(3), 194-196 (résumé).
- Otani, S., Katayama, J., Umemoto, H., & Matsuoka, M. (2006). Effect of bath temperature on the electrodeposition mechanism of zinc oxide film from zinc nitrate solution. Journal of the Electrochemical Society, 153(8), C551-C556 (résumé).
- Soldatov, D. V., Logvinenko, V. A., & Dyadin, Y. A. (1995). Clathrate Formation and the Phase Equilibria in the Pyridine-Zinc Nitrate System. Russian journal of inorganic chemistry, 40(2), 309-313.
- Studenikin, S. A., Golego, N., & Cocivera, M. (1998). Optical and electrical properties of undoped ZnO films grown by spray pyrolysis of zinc nitrate solution. Journal of applied physics, 83(4), 2104-2111.
- Sze, Y. K., & Irish, D. E. (1978). Vibrational spectral studies of ion-ion and ion-solvent interactions. I. Zinc nitrate in water. Journal of Solution Chemistry, 7(6), 395-415 (résumé).
- Zhang, Y. L., Yang, Y., Zhao, J. H., Tan, R. Q., Cui, P., & Song, W. J. (2009). Preparation of ZnO nanoparticles by a surfactant-assisted complex sol–gel method using zinc nitrate. Journal of sol-gel science and technology, 51(2), 198-203 (DOI 0.1007/s10971-009-1959-5).
Articles connexes
Cet article est issu de wikipedia. Text licence: CC BY-SA 4.0, Des conditions supplémentaires peuvent s’appliquer aux fichiers multimédias.