Pile zinc-air
Les piles zinc-air (non-rechargeables) et les piles à combustible zinc-air (rechargeables mécaniquement) sont des accumulateurs métal-air tirant leur énergie de l'oxydation du zinc avec l'oxygène de l'air ambiant. Ces piles possèdent de hautes densités énergétiques et sont peu chères. Leur format varie des piles boutons pour les audioprothèses[2] à des formats intermédiaires, pouvant être utilisés dans des appareils tels les caméras[note 1], ainsi qu'en grands formats pouvant être utilisés dans les véhicules électriques.
| Pile zinc-air | |
 Piles boutons zinc-air. | |
| Caractéristiques | |
|---|---|
| Énergie/Poids | 470 (pratique) 1 370 (théorique)[1] Wh/kg |
| Énergie/Volume | 1 480-9 780 Wh/ℓ |
| Tension nominale par élément | 1,65 V |
Réaction
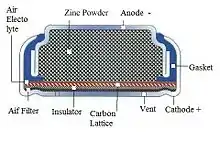
Lors de la décharge, les particules de zinc de l'anode baignent dans un électrolyte alors que le dioxygène de l'air réagit à la cathode, formant des ions hydroxyle qui attaquent le zinc métal en produisant du zincate (en) (Zn(OH)42−), ce qui libère 2 électrons par atome de zinc. Le zincate se décompose en oxyde de zinc (insoluble dans l'eau, il précipite hors de l'électrolyte), eau, et ions hydroxyle.
En théorie, la réaction produit une différence de potentiel de 1,65 volt, mais en pratique, les piles fournissent plutôt 1,35 à 1,4 V.
L'équation chimique s'écrit[1] :
- Anode : Zn + 4OH− → Zn(OH)42− + 2e− (E0 = –1,25 V)
- Fluide : Zn(OH)42− → ZnO + H2O + 2OH−
- Cathode : 1/2O2 + H2O + 2e− → 2OH− (E0 = 0,34 V, pH=11)
- Total : 2Zn + O2 → 2ZnO (E0 = 1,59 V et un courant de 4 électrons)
la cathode et l'anode sont séparés par une membrane perméable à l'eau et aux ions hydroxyles pour éviter l'attaque directe du zinc par l'oxygène, qui produirait de l'oxyde de zinc sans courant électrique.
En l'absence d'oxygène la pile ne se décharge pas spontanément. La réaction est irréversible : la pile n'est pas rechargeable.
La production de 1 ampère-heure (une grosse pile bouton) selon cette réaction (et sans pertes) requiert 0,0187 mole[3] de zinc (soit ~1,22 g ) et 0,0093 mole de dioxygène (soit ~0,30 g), c'est-à-dire le contenu de 1 litre d'air. Ce volume d'air requis est trop important pour permettre l'usage de pile zinc-air (ou plus généralement métal-air) dans un boîtier scellé.
Notes et références
Notes
- Les piles zinc-air peuvent être utilisées pour remplacer les anciennes piles au mercure de 1,35 V, dont la production est désormais arrêtée.
Références
- (en) « Duracell: Zinc–air Technical Bulletin », sur duracell.com (version du 10 juillet 2011 sur Internet Archive)
- (en) « Why is zinc-air technology used in hearing aids? », sur renata.com, Renata SA, (consulté le ).
- Cf. Ampère-heure#Équivalences, en notant que bien que 1 mole de zinc produit 2 moles de charges élémentaires
Bibliographie
![]() : document utilisé comme source pour la rédaction de cet article.
: document utilisé comme source pour la rédaction de cet article.
- (en) « An Air-Depolarized Primary Cell with Caustic Alkali Electrolyte », Transactions of the Electrochemical Society, vol. 62, , p. 363